胃康颗粒的制备及初步质量评价
刘 璐,于双雨,牛 阳,刘艳华,
(1.宁夏医科大学,银川 750004;2.宁夏少数民族医药现代化教育部重点实验室,银川 750004)
胃康颗粒由蜥蜴、山药、旋覆花、乌梅、延胡索、牡蛎、川楝子、山楂、白芍、三七、藕节、白及、黄芪、乌药、半枝莲和甘草组成[1-2],该中药方剂是临床经验方,在临床上的剂型为散剂,主要用于治疗慢性胃炎[3-4]、溃疡性结肠炎[5-6]、术后残胃炎[7]、胃癌合并上消化道出血[8]等疾病。受制药工艺水平和生产设备水平的限制,用于治疗慢性胃炎的剂型为直接普通粉碎药材制备的散剂,粒度不均一,且在普通粉碎过程中会产生过热现象,一些对热不稳定的中药材有效成分可能会受到影响;同时,纤维成分丰富的药材采用普通粉碎机粉碎后不易过筛,而经多次粉碎后仍不能过筛的则被当作杂质扔掉,导致处方中纤维成分丰富的药材用量不准确,影响药效的发挥。为此,针对上述问题需研究开发出粒度均一、药材比例更准确、疗效更好的中药制剂产品。
本研究采用万能粉碎机将干燥药材粉碎为初粉,将初粉采用低温振动式粉碎机粉碎为胃康极细粉,再采用湿法制粒技术制备为胃康颗粒。采用单因素实验优化胃康颗粒制备过程中的药材干燥时间、药材粉碎时间和湿法制粒黏合剂,以确定胃康极细粉和胃康颗粒的最佳制备工艺,并且对制备的极细粉、颗粒进行粉体学性质考察和质量检查。为保证工艺变更以后的产品质量稳定可靠,本研究对胃康颗粒进行了质量标准研究。根据《中华人民共和国药典》(简称《中国药典》)2020年版一部对所制胃康颗粒的水分、粒度、溶化性等进行测定;采用薄层色谱定性鉴别胃康颗粒中的黄芪、三七、延胡索;采用HPLCELSD定量测定胃康颗粒中人参皂苷Rb1和黄芪甲苷的含量;根据《中国药典》2020年版一部[9]对所制胃康颗粒进行了影响因素实验,以期为胃康颗粒的质量控制提供依据。
1 仪器与试剂
98-1-B型电子调温电热套(天津市泰斯特仪器有限公司);RE-2000A旋转蒸发器(上海亚荣生化仪器厂);Agilent 1220高效液相色谱仪(安捷伦科技有限公司);Agilent G4260B型蒸发光散射检测器(安捷伦科技有限公司);低温振动式粉碎机(济南倍力粉体技术工程有限公司);综合药品稳定性试验箱(重庆市永生实验仪器厂);PH-240(A)型干燥/培养二用箱(上海齐欣科学仪器有限公司)。
黄芪甲苷对照品(批号:110781-201616,供含量测定用);人参皂苷Rb1对照品(批号:110704-201827,供含量测定用);延胡索乙素对照品(批号:110726-201819,供含量测定用)均购自中国食品药品检定研究院;甲醇、乙腈为色谱纯(美国飞世尔科学世界公司);水为娃哈哈水;甲醇、乙醇、正丁醇和氨水为分析纯。
2 胃康颗粒的制备工艺研究
2.1 药材的干燥
根据《中国药典》2020年版四部通则“颗粒剂”项下规定,中药颗粒剂水分含量不得超过8.0%,且为了便于药材粉碎,需要对药材进行干燥处理。将药材进行不同时间的干燥后测定含水量,实验结果见表1,不同干燥时间的6份药材的含水量均<8%,在尽量降低含水量的前提下最大程度保留活性成分,选取于60℃干燥12 h。
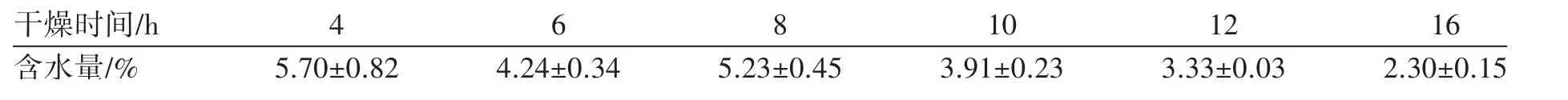
表1 干燥时间的筛选
2.2 药材的粉碎
将药材采用万能粉碎机粉碎成初粉(出粉率为99.65%,65目的过筛率为78.71%),再采用低温振动式粉碎机粉碎不同时间后进行粒度测定,结果见表2,在粉碎5 min后的粉末可全部通过150目,且200目的过筛率>95%,达到了《中国药典》2020年版中对极细粉的要求,因此,选取粉碎时间为5 min制得胃康极细粉。本研究针对胃康散剂现有制剂技术的缺陷,采用低温振动式粉碎机将药材制备为极细粉药材,可以克服普通粉碎技术制备的散剂粒度不均一、纤维性药材比例不准确的缺点,并采用低温粉碎解决因普通粉碎过程中温度升高而影响热不稳定药材的有效成分的问题。

表2 超微粉粹时间的筛选
2.3 胃康极细粉的粉体学性质考察
对制备的胃康极细粉进行粉体学性质考察,结果见表3,极细粉的出粉率为98.32%,200目的过筛率为95.50%,且激光粒度仪测得粒径分布均匀。但胃康极细粉的休止角较大,结合堆密度和振实密度结果,可进一步认为其流动性较差,这可能是由于粒度极小而导致的。通过测定吸湿平衡时间和临界相对湿度(CRH),考察了胃康极细粉的吸湿性。吸湿平衡时间结果见表4、图1,极细粉的引湿增重小于15%,但不小于2%,表明有引湿性,且吸湿平衡时间为4 h。胃康极细粉的CRH约为57%,因此极细粉的贮存及制粒环境应控制在57%以下。

表3 胃康极细粉的粉体学性质考察

表4 胃康极细粉的吸湿平衡时间考察
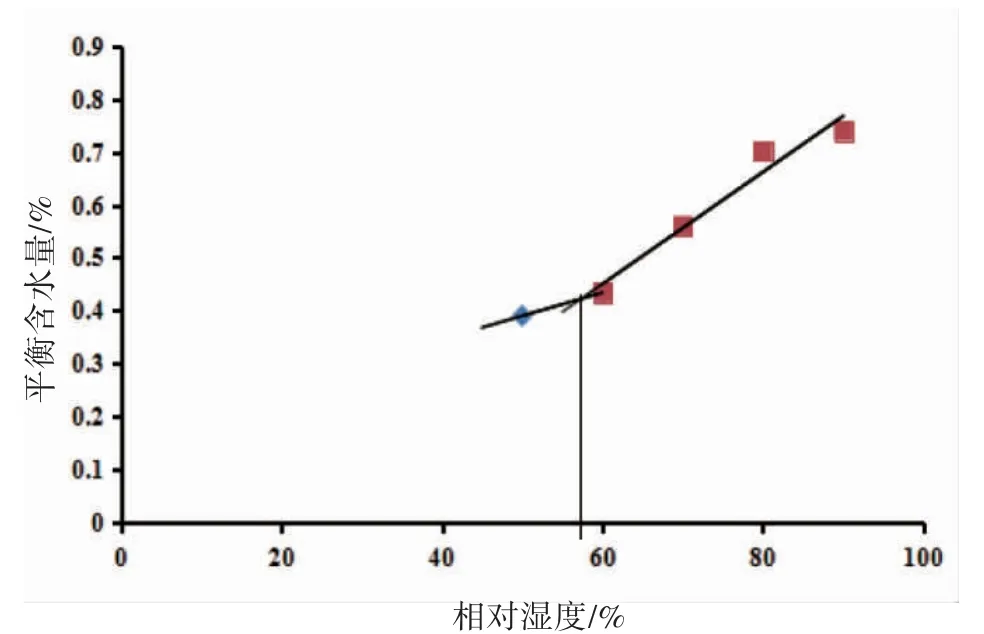
图1 胃康颗粒的CRH
2.4 黏合剂的筛选
参照相关研究[10-11]分别选取纯水、60%乙醇(体积分数)、95%乙醇(体积分数)的3种黏合剂进行制备。取胃康极细粉适量,将纯水、60%乙醇(体积分数)、95%乙醇(体积分数)分别加入上述极细粉中,混匀,制软材,以12目尼龙筛制粒,放至60℃的电热恒温干燥箱中进行干燥处理,过12目筛整粒,并将颗粒剂溶化性、合格颗粒收率、外观均匀度为综合评价指标,对其进行筛选。合格颗粒收率=(能通过1号筛而不能通过5号筛的颗粒质量/颗粒总质量)×100%。结果见表5,采用60%乙醇制备的合格颗粒收率最高、外观均匀度最好,因此选取60%乙醇作为黏合剂。

表5 胃康颗粒的黏合剂筛选
本研究针对胃康极细粉的缺陷,采用制粒技术进一步对极细粉进行制粒,将颗粒剂作为最终剂型,可克服极细粉由于粒度极细导致流动性差、不方便包装的问题,比表面积的增大使药物的吸湿性相应增大,改善制剂的吸湿性和流动性。
2.5 胃康颗粒的制备
取蜥蜴、山药、旋覆花、乌梅、延胡索、牡蛎、川楝子、山楂、白芍、三七、藕节、白及、黄芪、乌药、半枝莲和甘草饮片,用纯化水快速清洗,待水分蒸发后喷洒乙醇,待乙醇挥发后放在恒温烘箱60℃干燥12 h,用清洁和消毒的万能粉碎机在洁净间将饮片粉碎成初粉,再用低温振动式粉碎机粉碎5 min,达到极细粉的粒度要求(能全部通过8号筛,且能通过9号筛的粉末不少于95%)。将制得的胃康极细粉用60%乙醇喷洒制粒,混匀,制软材,以12目尼龙筛制粒,放至60℃的电热恒温干燥箱中干燥6 h,过12目筛整粒,即得胃康颗粒。
3 胃康颗粒的质量研究
3.1 水分检查
取上述胃康颗粒适量,按照《中国药典》2020年版水分测定法(第二法:烘干法)进行测定。结果:水分含量为4.99%,符合《中国药典》2020年版(四部)“颗粒剂”项下水分不得超过8.0%的要求。
3.2 粒度检查
称取所制胃康颗粒3份,每份10 g,参照《中国药典》2020年版(四部)通则0982中双筛分法测定。结果,胃康颗粒的粒度为0.17%,符合《中国药典》2020年版(四部)“颗粒剂”项下粒度不得超过15%的要求。
3.3 溶化性检查
称取所制胃康颗粒3份,每份10 g,放入3个相同烧杯中加热水200 mL,玻璃棒同时搅拌,观察颗粒溶化情况。结果,胃康颗粒全部溶化,符合《中国药典》2020年版(四部)“颗粒剂”项下溶化性要求。
3.4 休止角、堆密度、振实密度检查
对胃康颗粒的休止角、堆密度、振实密度进行检查,结果见表6,相比于胃康极细粉的休止角明显减小,且卡尔指数进一步表明其流动性得到了显著改善。

表6 胃康颗粒的质量检查结果
3.5 胃康颗粒的薄层鉴别
采用薄层色谱法对胃康颗粒中黄芪、三七、延胡索、山药、蜥蜴、白及进行定性鉴别,结果表明,山药、蜥蜴、白及色谱专属性不佳,黄芪、三七、延胡索色谱效果良好,斑点显色清晰。
3.5.1 黄芪的薄层鉴别 取胃康颗粒6 g,加甲醇40 mL,加热回流1 h,滤过,滤液挥干,残渣加20 mL水,微热使其溶解,用水饱和的正丁醇振摇提取4次,每次20 mL,合并正丁醇液,用40%氨水洗涤2次,每次30 mL,弃去氨液,正丁醇液蒸干,残渣加甲醇2 mL使其溶解,作为供试品溶液。取黄芪甲苷对照品,加甲醇制成每1 mL含0.5 mg的溶液,作为对照品溶液。按处方组成及比例,取除去黄芪以外的其余药材,按照本品制备工艺制备阴性样品。取阴性样品4.9 g,同供试品溶液制备方法制备阴性对照溶液。照薄层色谱法(通则0502)试验,吸取上述三种溶液各2μL,分别点于同一硅胶G薄层板上,以三氯甲烷-甲醇-水(13∶5∶2,v/v/v)的下层溶液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰。供试品色谱中,在紫外光灯(365 nm)下显相同的荧光斑点。
薄层鉴别结果见图2,供试品和对照品色谱图中,两者相应的地方显同色的主斑点,而且黄芪阴性对照色谱图中相应位置没有此颜色点。
3.5.2 三七的薄层鉴别 取胃康颗粒6 g,加甲醇40 mL,加热回流1 h,滤过,滤液挥干,残渣加20 mL水,微热使溶解,用水饱和的正丁醇振摇提取4次,每次20 mL,合并正丁醇液,用40%氨水洗涤2次,每次30 mL,弃去氨液,正丁醇液蒸干,残渣加甲醇2 mL使溶解,作为供试品溶液。取人参皂苷Rb1对照品,加甲醇制成每1 mL含0.4 mg的溶液,作为对照品溶液。按处方组成及比例,取除去三七以外的其余药材,按照本品制备工艺制备阴性样品。取阴性样品5.45 g,同供试品溶液制备方法制备阴性对照溶液。照薄层色谱法(通则0502)试验,吸取上述三种溶液各2μL,分别点于同一硅胶G薄层板上,以三氯甲烷-甲醇-水(13∶7∶2,v/v/v)的下层溶液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰。供试品色谱中,在紫外光灯(365 nm)下显相同的荧光斑点。
薄层鉴别结果见图2,供试品和对照品色谱图中,两者相应的地方显同色的主斑点,而且三七阴性对照色谱图中相应位置没有此颜色点。
3.5.3 延胡索的薄层鉴别 取胃康颗粒11 g,加甲醇50 mL,超声处理30 min,滤过,滤液蒸干,残渣加水10 mL使其溶解,加浓氨试液调至碱性,用乙醚振摇提取3次,每次10 mL,合并乙醚液,蒸干,残渣加甲醇1 mL使其溶解,作为供试品溶液。取延胡索乙素对照品,加甲醇制成每1 mL含0.5 mg的溶液,作为对照品溶液。按处方组成及比例,取除去延胡索以外的其余药材,按照本品制备工艺制备阴性样品。取阴性样品10 g,同供试品溶液制备方法制备阴性对照溶液。照薄层色谱法(通则0502)试验,吸取上述3种溶液各2~3μL,分别点于同一1%氢氧化钠溶液制备的硅胶G薄层板上,以甲苯-丙酮(9∶2,v/v)为展开剂,展开,取出,晾干,置碘缸中约3 min。供试品色谱中,在紫外光灯(365 nm)下显相同的荧光斑点。
薄层鉴别结果见图2,供试品和对照品色谱图中,两者相应的地方显同色的主斑点,而且延胡索阴性对照色谱图中相应位置没有此颜色点。

图2 胃康颗粒的薄层鉴别结果
3.6 胃康颗粒中人参皂苷Rb1和黄芪甲苷的含量测定
3.6.1 色谱条件 色谱柱:XBridgeRShield RP18(4.6 mm×250 mm,5μm);流动相:乙腈-水(32∶68,v/v);流速:1.0 mL·min-1;柱温:30℃;进样量:20μL;蒸发光散射检测器,漂移管温度为60℃,雾化室温度为33℃,载气流量为1.7 SLM。
3.6.2 供试品溶液的制备 取本品5 g,精密称定,置圆底烧瓶中,精密加入甲醇30 mL,称定重量,回流提取1.5 h,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,精密量取续滤液20 mL,蒸干,残渣加水20 mL使其溶解,用水饱和的正丁醇提取5次,每次20 mL,合并正丁醇提取液,用浓氨试液洗涤2次,每次30 mL,弃去洗涤液,正丁醇液蒸干,残渣加甲醇溶解并转移至5 mL量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。
3.6.3 对照品溶液的制备 精密称定黄芪甲苷5 mg和人参皂苷Rb14 mg,置10 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得混合对照品溶液。
3.6.4 阴性对照溶液的制备 按处方比例取除黄芪和三七的其余中药饮片,照胃康颗粒的制法制成黄芪阴性和三七阴性样品,分别取黄芪阴性样品4.09 g、三七阴性样品4.55 g,照供试品溶液的制备方法制成黄芪阴性对照溶液和三七阴性对照溶液。
3.6.5 系统适用性实验 取对照品、供试品和阴性对照品溶液各20μL,注入液相色谱仪,按“3.6.1”项下色谱条件测定,人参皂苷Rb1的保留时间约为8 min,黄芪甲苷的保留时间约为12 min,峰形对称尖锐,基线平稳,与其他色谱峰分离良好,阴性样品无干扰,详见图3。建立的HPLCELSD测定人参皂苷Rb1和黄芪甲苷含量,线性关系良好(r>0.9997),日内日间精密度均<1%,加样回收率分别为95.65%和100.57%,稳定性和重复性的相对标准偏差(RSD)均<3%。
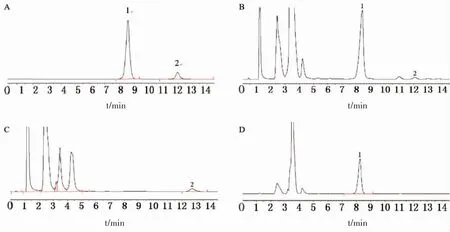
图3 胃康颗粒的HPLC图
3.6.6 样品含量测定 取3批中试样品,按建立的方法测定人参皂苷Rb1和黄芪甲苷的含量。分别精密吸取对照品溶液10、20μL,供试品溶液20μL,注入液相色谱仪,测定,以外标两点法对数方程计算,即得。结果如表7所示,胃康颗粒中人参皂苷Rb1和黄芪甲苷的平均含量分别为2.8630 mg·g-1和0.2576 mg·g-1,RSD分别为0.62%和1.51%。
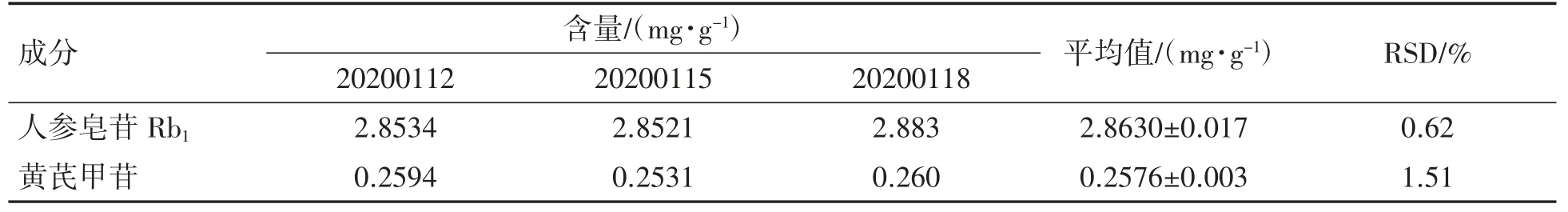
表7 胃康颗粒中人参皂苷Rb1和黄芪甲苷的含量测定结果
3.7 胃康颗粒的影响因素实验
3.7.1 高温实验 将1批实验室制得的胃康颗粒在除去模拟市售包装条件下,置密封洁净容器中,在高温60℃条件下放置10 d,于0、5、10 d取样检测,考察高温对胃康颗粒的影响。观察性状,进行含量测定、薄层鉴别,检查粒度、水分、溶化性,结果见表8。因在高温60℃条件下,胃康颗粒的性状、薄层鉴别、粒度、水分、溶化性与0 d比较无明显变化,但供试品含量低于规定限度,则在40℃条件下同法进行实验,胃康颗粒的性状、薄层鉴别、粒度、水分、溶化性、含量与0 d比较无明显变化,因此,高温60℃对胃康颗粒稳定性有影响。
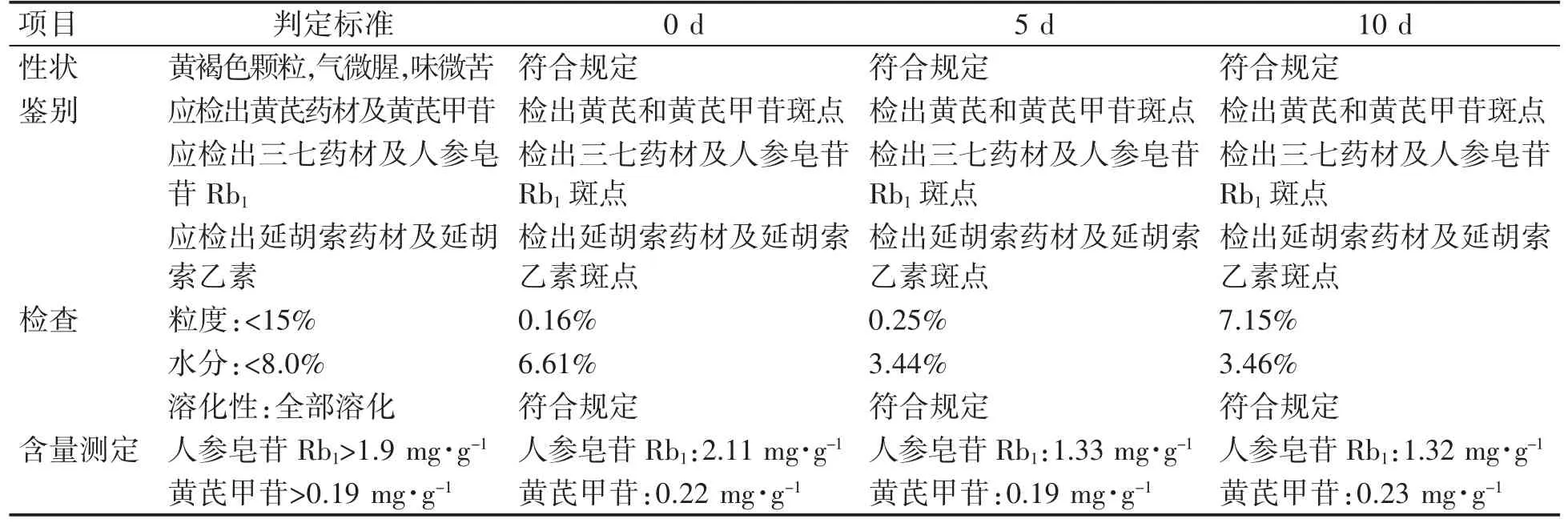
表8 胃康颗粒的高温60℃实验结果
3.7.2 高湿实验 将1批实验室制得的胃康颗粒在除去模拟市售包装条件下,置于恒温恒湿箱中,于25℃、相对湿度(RH)为92.5%±5%条件下放置10 d,在0、5、10 d取样检测,考察高湿对胃康颗粒的影响。观察性状,进行含量测定、薄层鉴别,检查粒度、水分、溶化性,结果见表9。因在高湿92.5%条件下,供试品含量低于规定限度,水分高于规定限度,则在相对湿度75%条件下同法进行试验,水分检查结果仍高于规定限度,且吸湿增重在5%以上,因此认为湿度对胃康颗粒有较大影响。
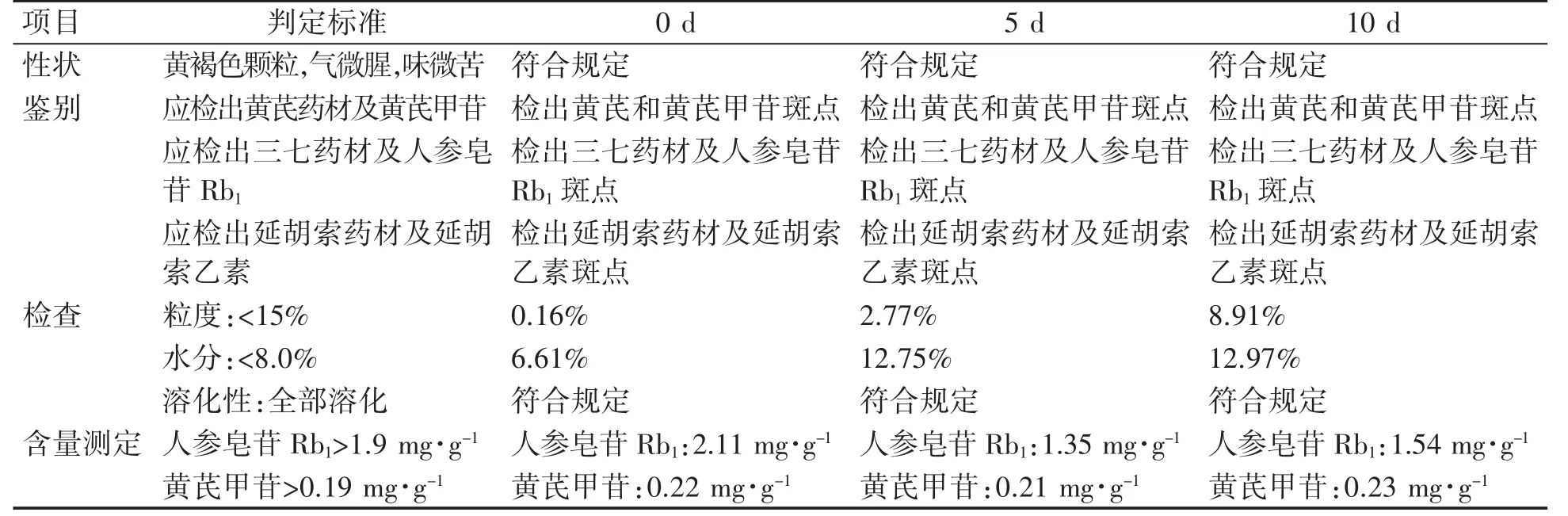
表9 胃康颗粒的高湿92.5%实验结果
3.7.3 强光照射实验 将1批实验室制得的胃康颗粒在除去模拟市售包装条件下,置于装有日光灯的综合药品稳定性实验箱内,在光照强度为4500±500 lx条件下放置10 d,在0、5、10 d取样检测,考察强光照射对胃康颗粒的影响。观察性状,进行含量测定、薄层鉴别,检查粒度、水分、溶化性,结果见表10,胃康颗粒的性状、薄层鉴别、粒度、水分、溶化性与0 d比较无明显变化,但供试品含量低于规定限度,因此认为强光对胃康颗粒有影响。
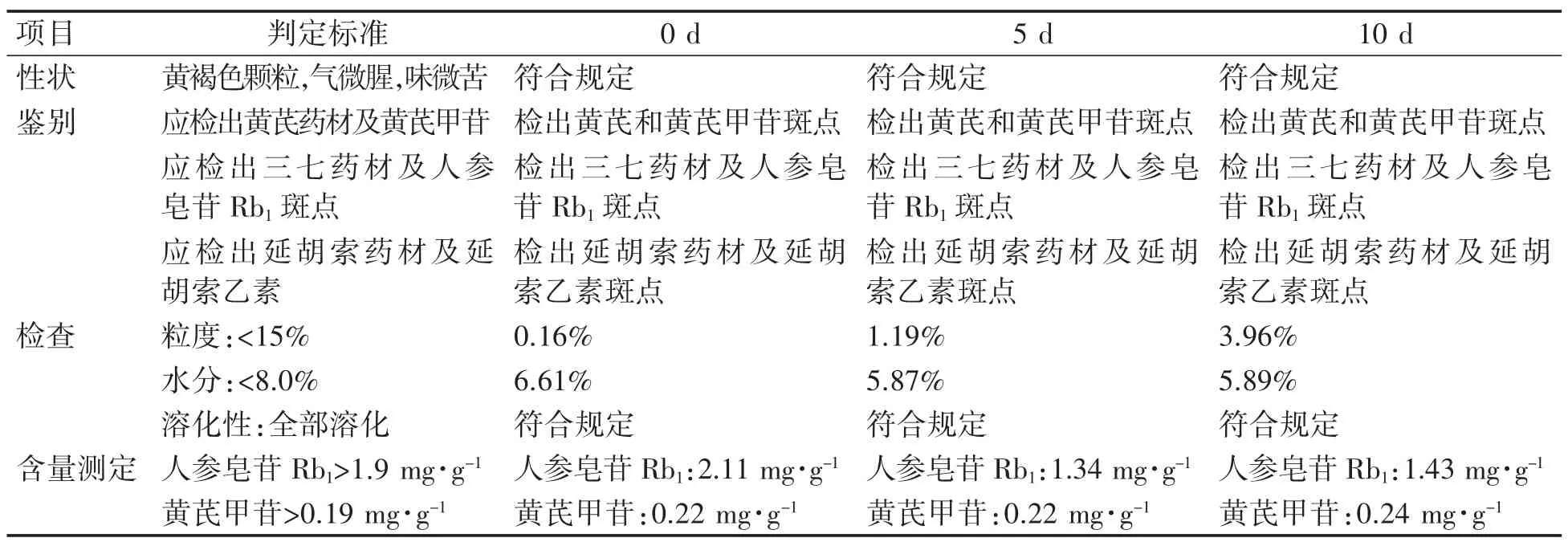
表10 胃康颗粒的强光实验结果
4 讨论
采用单因素实验优化制备工艺中的药材干燥时间和药材粉碎时间制备的胃康极细粉,粒度均一、药材比例准确,并且采用低温粉碎避免影响热不稳定药材的有效成分。在成型工艺研究中,考虑采用湿法制粒,以60%乙醇作为黏合剂制备的合格颗粒收率最高、外观均匀度最好,改善了制剂的吸湿性和流动性。胃康颗粒的质量标准研究中,采用薄层色谱法对胃康颗粒中黄芪、三七、延胡索进行定性鉴别,效果良好,斑点显色清晰[12-16]。对胃康颗粒的粒度、水分、溶化性等进行了测定,结果符合《中国药典》2020年版的相关质量要求。同时建立了测定胃康颗粒中人参皂苷Rb1和黄芪甲苷含量的HPLC-ELSD方法[17-24]。胃康颗粒的影响因素实验中[25],强光照射、高温、高湿条件下,胃康颗粒的检测指标均有不同程度的改变,在之后的实验中会进行胃康颗粒的加速实验、长期实验等。本研究优选的制备工艺合理可行,具有较好的稳定性,可用于工业化生产,制定的质量标准可控,为胃康颗粒制剂研究提供实验依据。

