重庆市主城区无偿献血者血液筛查不合格情况分析
魏 兰,杨冬燕,王 芳,黎美君,韩继姝
重庆市血液中心,重庆 400052
为最大限度降低经输血传播疾病的风险,保障受血者健康,《全血及成分血质量要求》规定,对无偿献血标本进行乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、人类免疫缺陷病毒(HIV)、梅毒螺旋体(TP)标志物检测。本研究对2017—2020年重庆市主城区589 882例无偿献血标本血液筛查结果进行回顾性分析,以了解重庆市主城区无偿献血者血液筛查不合格分布情况及经输血传播病原体在献血人群中的流行情况,为传染病防控、血液筛查策略的制订提供数据支撑,现报道如下。
1 材料与方法
1.1标本来源 收集重庆市血液中心2017—2020年采集的主城区无偿献血者血液标本共计589 882例,无偿献血者筛查均符合《献血者健康检查要求(GB18467-2011)》相关规定。数据来源于本中心的血站信息管理系统(BMIS)。
1.2仪器与试剂 主要仪器包括全自动加样仪(Xantus,深圳爱康)、全自动酶联免疫分析仪(FAME24/20,瑞士Hamilton)、全自动核酸检测仪(Tigris/Panther,西班牙盖立复)、全自动生化分析仪(AU640/680,美国Beckman),所有仪器均经过校准。主要试剂包括乙型肝炎表面抗原(HBsAg,北京万泰/意大利索林)、抗-HIV+P24(北京万泰/美国伯乐)、抗-HCV(北京万泰/美国强生)、抗-TP(上海科华/北京万泰),丙氨酸氨基转移酶(ALT)检测试剂(烟台澳斯邦),以及核酸筛查(NAT)试剂Ultrio Plus/Elite(西班牙盖立复)。上述试剂均合格且在效期内使用。
1.3方法 采用速率法检测ALT,酶联免疫吸附试验(ELISA)检测HBsAg、抗-HCV、抗-HIV+P24、抗-TP;采用以转录介导的扩增技术(TMA)为原理的全自动核酸检测系统进行NAT。所有项目均按照说明书操作。献血前采集指尖血进行ALT初筛,金标法快速检测HBsAg和抗-TP。留样管送回实验室,采用ELISA和NAT同步进行的策略。其中HBsAg、抗-HIV+P24和抗-HCV采用国产试剂初检,进口试剂复检;抗-TP采用上海科华初检,北京万泰复检。随机采用盖立复Tigris/Panther系统进行单人份核酸联检(TRI-NAT),联检反应性标本用配套的HBV/HIV/HCV鉴别试剂进行鉴别试验,鉴别阳性率=鉴别阳性数/联检阳性数×100%。
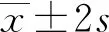
1.5统计学处理 采用SPSS20.0统计软件对数据进行统计分析,计数资料以例数或百分率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.12017—2020年重庆市主城区无偿献血者血液检测不合格标本结果 2017—2020年重庆市主城区无偿献血标本共计589 882例,其中不合格15 539例,总不合格率为2.63%,各项目不合格率差异有统计学意义(P<0.05)。检测不合格率由高到低为ALT(1.05%)、TRI-NAT(0.71%)、HBsAg(0.55%)、抗-TP(0.29%)、抗-HCV(0.28%)、抗-HIV+P24(0.17%)。6个项目各年间的不合格率差异均有统计学意义(P<0.05)。见表1。
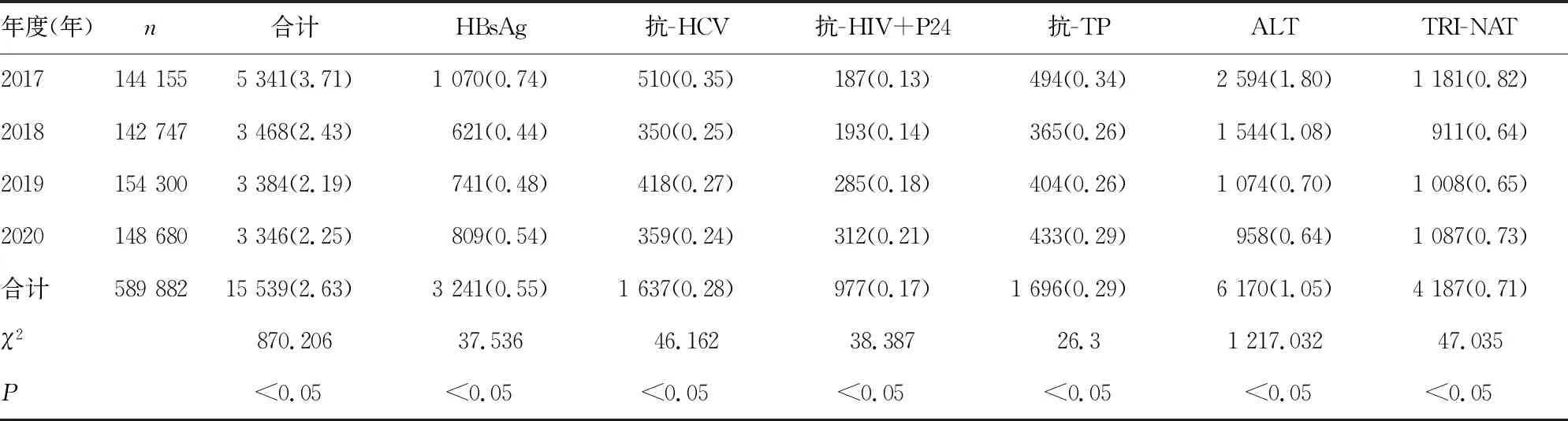
表1 2017—2020年无偿献血者血液检测不合格标本分布 [n(%)]
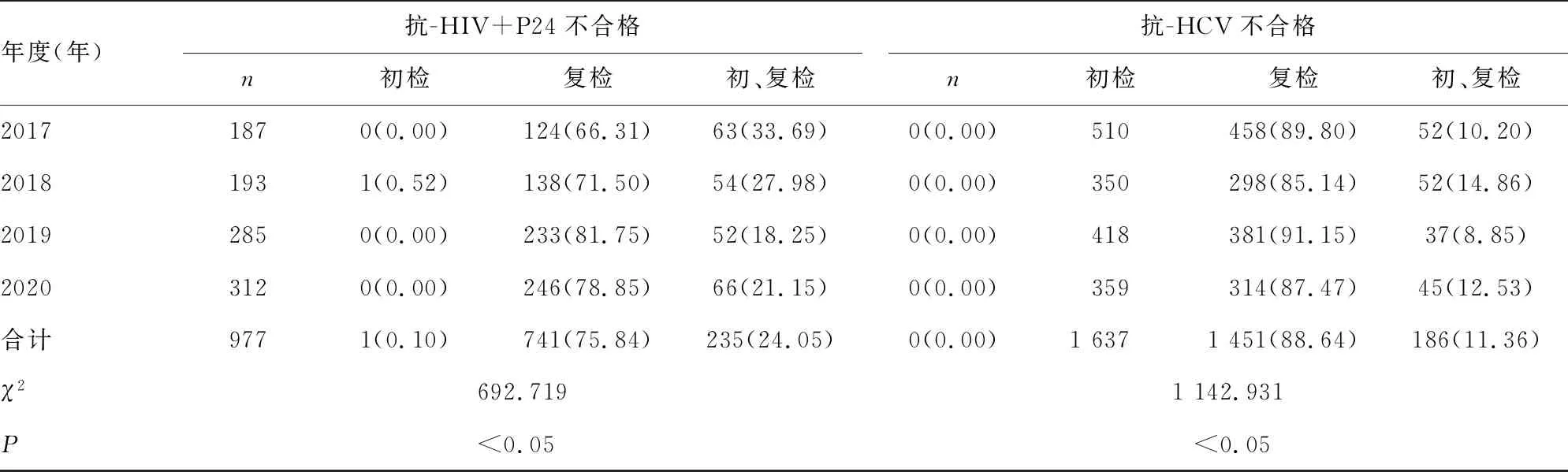
2.2ELISA不合格标本的初、复检结果 初、复检均不合格的项目占比由高到低为抗-TP(65.33%)、HBsAg(57.61%)、抗-HIV+P24(24.05%)、抗-HCV(11.36%)。初检单项不合格仅2018年出现1例,为抗-HIV+P24初检不合格。复检单项不合格标本较多,4年共4 154例,占不合格标本的26.7%(4 154/15 539)。见表2。复检单项不合格率由高到低为抗-HCV(1 451/589 882,2.4‰)、HBsAg(1 374/589 882,2.3‰)、抗-HIV+P24(741/589 882,1.3‰)、抗-TP(588/589 882,1.0‰)。
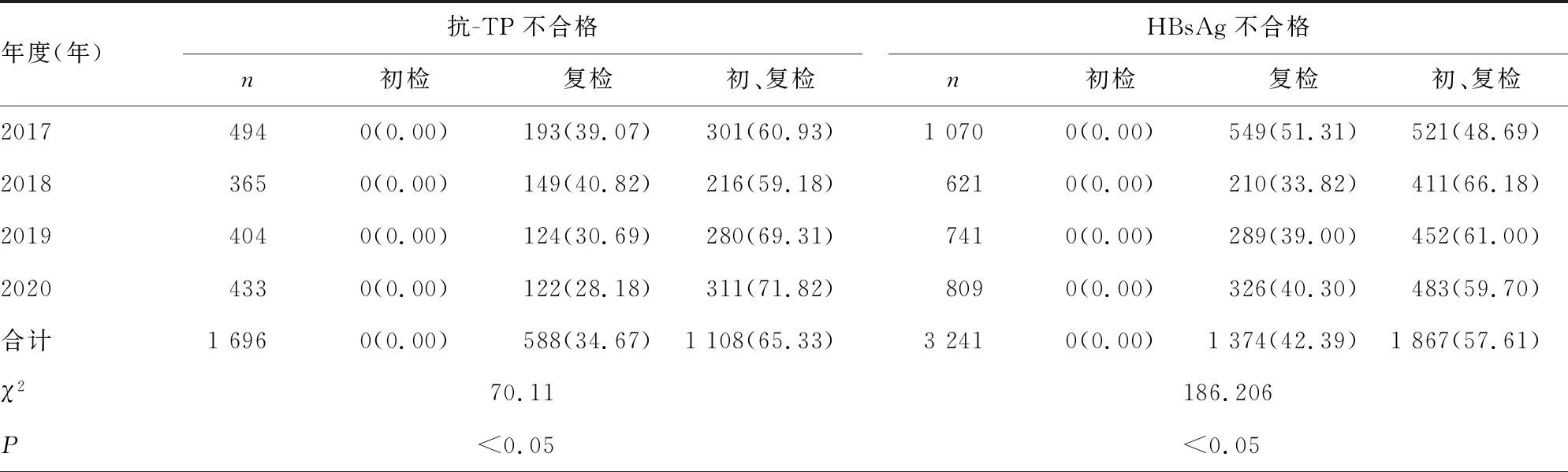
表2 ELISA不合格标本的初、复检结果[n(%)]
年度(年)抗-HIV+P24不合格n初检复检初、复检抗-HCV不合格n初检复检初、复检20171870(0.00)124(66.31)63(33.69)0(0.00)510458(89.80)52(10.20)20181931(0.52)138(71.50)54(27.98)0(0.00)350298(85.14)52(14.86)20192850(0.00)233(81.75)52(18.25)0(0.00)418381(91.15)37(8.85)20203120(0.00)246(78.85)66(21.15)0(0.00)359314(87.47)45(12.53)合计9771(0.10)741(75.84)235(24.05)0(0.00)1 6371 451(88.64)186(11.36)χ2692.7191 142.931P<0.05<0.05
2.3NAT不合格标本鉴别结果 2017—2020年TRI-NAT不合格4 187例,占不合格标本的26.95%(4 187/15 539)。鉴别阳性率由高到低为HBV-DNA(58.56%)、HIV-RNA(5.42%)、HCV-RNA(2.15%)。HBV-DNA和HCV-RNA各年间鉴别阳性率差异有统计学意义(P<0.05);HIV-RNA各年间鉴别阳性率及总鉴别阳性率差异无统计学意义(P>0.05)。见表3。
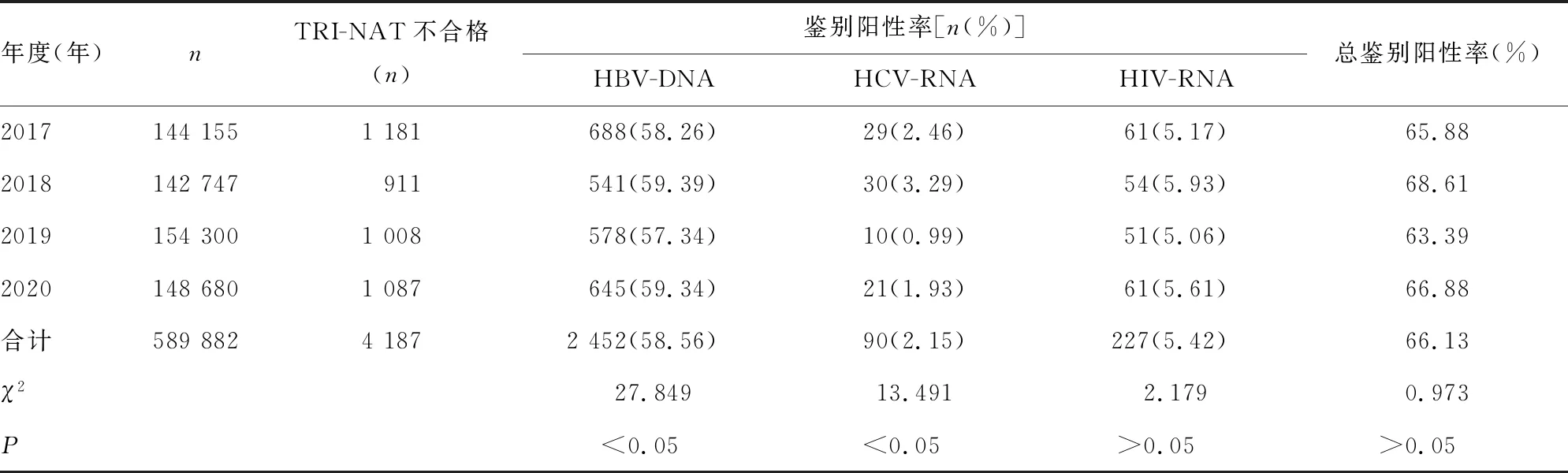
表3 NAT不合格标本鉴别结果
3 讨 论
2017—2020年,重庆市主城区无偿献血标本筛查总不合格率各年依次为3.71%、2.43%、2.19%、2.25%,平均为2.63%,高于无锡(1.03%)[1]、渭南(1.76%)[2]、长沙(2.00%)[3],低于太原(3.28%)[4]等地区。ALT不合格率最高,4年ALT不合格率依次为1.80%、1.08%、0.70%、0.64%,逐年降低。可能原因:本中心加强了献血前注意事项的宣传、规范了献血前的健康征询和初筛;部分采血点使用小型多通道生化分析仪QL1000替代干化学法分析仪,且该仪器能进行脂血判断,重度脂血标本检测时会超过ALT线性范围[5],2018年开始对无法测出ALT的标本自动稀释复测。不合格率位于第2位的是TRI-NAT(0.71%),远高于国内同行报道结果[6-7],这与本中心ELISA、NAT同步检测策略相关。同步检测缩短了报告时限,但也导致酶免强反应性标本进入核酸检测,易引起核酸实验室污染,且增加检测成本。目前,本中心已启动策略转变工作,以期节约成本,保证检测质量。
相同项目2种检测试剂结果差异有统计学意义(P<0.05),这可能与不同试剂包被的抗原抗体片段不同有关。血站技术操作规程(2019版)中4.2.4条目明确指出,HIV/HBV/HCV 3个项目可只进行一次ELISA。从表2可知,复检试剂的检出标本几乎完全涵盖初检试剂。复检单项不合格标本4 154例,占献血总人数的7‰(4 154/589 882),假如去掉1遍ELISA筛查,如何选择试剂值得探讨。虽然复检试剂灵敏度高,但与此伴随的特异度低的问题也亟待解决。目前国内多数同行未对筛查反应性标本进行补充试验以明确其结果,这将导致血液因假反应性而淘汰。因此,选择试剂和评价其性能时,应建立实验室的质量监测体系及评估方案,为试剂的选择提供数据支撑。
2017-2020年重庆市主城区HBV-DNA、HIV-RNA、HCV-RNA总鉴别阳性率差异无统计学意义(P>0.05),联检反应性标本鉴别阳性率由高到低为HBV-DNA、HIV-RNA、HCV-RNA,与这3个项目对应的ELISA不合格率排序相符。值得注意的是,重庆市主城区抗-HIV+P24筛查不合格率为0.17%,高于扬州(0.06%)[8]、盐城(0.08%)[9],低于宝鸡(0.27%)[10]等地区。相关报道显示,目前艾滋病已从高危人群向普通人群蔓延,感染者以24~45岁男性群体为主[11]。不排除有高危行为的人员以体检为目的到血站捐献血液[12]。随着核酸检测技术在血液筛查领域的推广,HIV检测窗口期虽已大大缩短,但无法被消除。因此,加强无偿献血知识的普及,提高献血者血液安全意识,从低危人群中招募献血者,从源头遏制不合格血液,是保障血液安全不可忽视的重要环节。
本研究回顾性分析了2017-2020年重庆市主城区无偿献血标本不合格情况,与相关报道对比,各项目不合格率均有降低空间。但数据仅供参考,因为筛查不合格率与实验室选择的检测系统、试剂、策略密切相关。本研究尚有不足之处:数据从BMIS直接导出,无法得出多项不合格的标本数及NAT单反应数,这也将是本中心信息系统后续改进的方向;回顾性分析时2018年有1例抗-HIV+P24初检单反应性标本,但未及时做确认试验,未能获得确证结果,分析可能是标本的非特异性反应所致。本文旨在探讨重庆市主城区无偿献血人群血液筛查不合格标本分布情况,但重庆市主城区有解放军血站,该站为军队系统直接管理,本文数据未涵盖此站点,特此说明。
综上所述,应加强献血知识宣传,提高献血者血液安全意识,在低危人群中招募献血者;加强专业人员培训,规范献血前初筛;建立实验室质量监测体系和评估方案。这对保障血液安全,降低血液筛查不合格率至关重要。

