HLA-DQB1*02:106鉴定和相关单体型分析及蛋白三级结构分析①
王天菊 齐 珺 李恒新 王满妮 王小芳 (西安市中心血站HLA高分辨分型确认实验室,西安710061)
人类白细胞抗原(human leukocyte antigen,HLA)位于染色体6p21.3 区域,与机体自我识别和免疫应答密切相关,在人类遗传学、移植免疫学、输血医学等领域中发挥重要作用[1-5]。精准的HLA 分型技术促使越来越多的HLA 等位基因被发现和鉴定,为造血干细胞移植、疾病相关性研究、群体遗传学等提供数据支持。截至2020 年4 月,IMGT/HLA数据库 3.40 版(http://www. ebi. ac. uk/ipd/imgt/hla/stats)报道已发现的HLA 等位基因有27 258 个,其中HLA-DQB1等位基因有1 826个。HLA-DQB1位点属于HLA-Ⅱ类分子基因位点,与HLA-A/B/C/DRB1 位点相比,多态性较少,随着对HLA-DQB1 位点研究的逐渐深入,发现其与自身免疫性疾病、感染性疾病、肿瘤等有相关性。另外,HLA-DQB1抗原是移植免疫中最重要的抗原之一,2006 年HORN等[6]提出应将HLA-DQB1 分型列入造血干细胞移植前的组织配型实验中,其在造血干细胞移植中的作用也逐渐被认知和总结。
作者所在实验室应用聚合酶链反应-直接测序法(polymerase chain reaction-sequence based typing,PCR-SBT)和序列特异性寡核苷酸探针(polymerase chain reaction-sequence-specific oligonucleotide probes,PCR-SSOP)对临床异基因造血干细胞移植前HLA 高分辨确认分型时,发现HLA-DQB1 位点分型结果存在模棱两可,进一步采用基于Ion Torrent S5测序系统的下一代测序技术(next generation sequencing,NGS)进行鉴别,鉴定出一个罕见HLADQB1 等位基因 HLA-DQB1*02:106,通过对变异氨基酸在其三级结构中的位置比对和模拟分析,进一步分析变异氨基酸是否影响分子的高级结构。将罕见等位基因与经家系调查总结出其相应的HLAA/B/C/DRB1/DQB1 单体型,查询其在不同人种中的分布,现报告如下。
1 资料与方法
1.1 资料
1.1.1 样本来源 先证者为西安交通大学第一附属医院血液内科就诊的一名急性髓细胞白血病患者,陕西籍,汉族,女性,在本实验室HLA 高分辨分型中因HLA-DQB1 位点分型结果存在模棱两可而进一步确认。先证者及其亲属,包括父亲、母亲、弟弟均为陕西籍,经患者及家属知情同意后采集静脉血2管(EDTA抗凝管,5 ml/管)。
1.1.2 主要试剂与设备 血液基因组DNA 提取试剂盒(北京TIANGEN,批号S7709);Magcore DNA 提取试剂盒(中国台湾芮宝公司);HLA-A/B/C/DRB1/DQB1 SecoreTMSBT 分型试剂(美国Thermo Fisher Life Technologies 公司);HLA-A/B/C/DRB1/DQB1 SSO 高分辨分型试剂(美国 One Lambda 公司);NX TypeTMNGS 测序试剂(美国Thermo Fisher Scientific公司)。核酸蛋白定量检测仪(美国,GeneQuant pro);全自动核酸提取仪(中国台湾芮宝公司);PCR扩增仪(德国SENSO 公司,Sensoquest Labcycler);全自动DNA 测序分析仪(美国ABI公司,ABI-3730xl);FLEXMAP-3DTM荧光磁珠流式分析仪(美国Lunimex公司);Ion Torrent S5TM测序仪(美国Thermo Fisher Scientific公司)。
1.2 方法
1.2.1 两种方法提取基因组DNA 制备 分别采用血液基因组DNA 提取试剂盒(提取DNA 标识此样本①号)和Magcore自动提取仪(提取DNA 标识此样本②号)严格按照试剂操作说明提取血液基因组DNA,进行浓度和纯度的检测并标识,提取DNA的浓度范围为20~80 ng/μl,纯度A260n/mA280nm为1.6~1.9。
1.2.2 PCR-SBT 分型 采用 SeCore®HLA-SBT 分型试剂盒对该样本进行常规高分辨的HLA 基因分型(批号 HLA-A:007,HLA-B:010,HLA-C:006,HLA-DRB1:008,HLA-DQB1:008)。对 1.2.1 提取的 DNA 进行 HLA-A/B/C/DRB1/DQB1 位点 PCR 扩增,扩增产物用ExoⅠ/SAP 酶纯化后,对HLA-A/B进行第1~5外显子正反向测序反应,C 位点进行1~7外显子正反向测序反应,HLA-DRB1 进行第2 外显子正反向及Condon86 正向测序反应,DQB1 位点进行2、3 外显子正反向测序反应。测序产物再经乙醇/醋酸钠沉淀,95℃热变性迅速冷却后的产物用ABI 测序仪进行毛细管电泳,将电泳序列导入uTYPE 7.2 分析软件进行分析后发现HLA-DQB1 位点存在模棱两可组合,无法区分。
1.2.3 PCR-SSO 分型 采用 LABType SSO 试剂对1.2.1 提取的①号DNA 进行HLA-A/B/C/DRB1/DQB1 5 个位点的特异性扩增。在杂交板加入1.5 μl变性液,吸取3.0 μl扩增产物与变性液混合,室温反应10 min。每孔加入中和液,将按比例稀释的磁珠加入各孔,60℃孵育15 min 后加入洗涤液,4 000/rmin 离心 5 min,弃上清液,重复 3 次洗涤步骤。加入荧光标记,60℃孵育5 min,洗涤1 次后加入缓冲液,转移到上机板后放入Luminex 3D 荧光磁珠流式分析仪读取数据,分析软件为One Lambda HLA Fusion 4.2。
1.2.4 NGS 主要分为文库制备、模板制备、测序反应和数据分析三大步骤。
1.2.4.1 文库制备 测定DNA 浓度后均一化,采用NXTypeTMNGS 试剂扩增HLA-A/B/C 位点全长,HLA-DRB1/DQB1 位点第2~6 外显子。扩增产物纯化和定量后,浓度均一化。将处理好的产物片段化,接头连接,末端修复,加标签,磁珠纯化选择300~1 000 bp 长度的目标片段。二次扩增,纯化和定量后,将HLAⅠ类和Ⅱ类产物进行等摩尔混合。
1.2.4.2 模板制备 将50 μl 制备好的文库加入Ion S5 ExT Chef Reagents 试剂盒指定管中进行单克隆扩增。
1.2.4.3 测序反应和数据分析 将扩增产物加载至Ion 530TMChip 芯片,在Ion S5 测序平台上加入4 种脱氧核苷酸,开始测序反应,采用Type Stream Visual 软件指定 HLA-A/B/C/DRB1/DQB1 等位点基因型。
1.2.5 家系单体型分析及地区分布分析 通过家系分析,推导含有HLA-DQB1*02:106 的HLA-A/B/C/DRB1/DQB1 5 位点单体型。在HaploStats 网站(http://www. HaploStats. org)查询该单体型在不同人种的分布情况。
1.2.6 HLA-DQB1*02:01:01:01 与 HLA-DQB1*02:106 编码蛋白三维空间结构预测分析 IMGT/HLA 查询 HLA-DQB1*02:106 氨基酸序列,提交SWISS MODEL(https://swissmodel. expasy. org/)进行同源建模,选定 PDB 数据库 ID 号为 5KSU[7]作为模板进行两分子间结构和差异氨基酸的比较,找出差异氨基酸的位置并标明氨基酸结构差异。将HLA-DQB1*02:01:01:01 分子外显子 2 的氨基酸、外显子 2 和 3 的氨基酸,HLA-DQB1*02:106 分子外显子2的氨基酸、外显子2和3的氨基酸序列分别提交Phyre2蛋白折叠识别建模在线软件(http://www.sbg.bio.ic.ac.uk/phyre2/htm/lpage.cgi?id=index),下载得到的pdb 格式文件。将相应文件导入FATCAT(http://fatcat.godziklab.org/)[8]在线比对分析两者结构,以两分子间的均方根偏差(RMSD,单位nm)作为表示两分子结构大小的参数。
2 结果
2.1 PCR-SBT 分型结果 先证者HLA-A/B/C/DRB1 位点 PCR-SBT 分型结果分别为 A*02:06,31:01;B*13:01,35:08;C*03:04,04:01;DRB1*03:01,15:01。DQB1 位点的分型结果为模棱两可组合02:01,06:109 与02:106,06:02,无法确定唯一高分指定结果,与常见等位基因组合02:01,06:02 组合相比,在619位核苷酸有差异。常见等位基因组合02:01,06:02 在619 位为G,模棱两可组合为R(A+G),见图1。

图1 该样本HLA-DQB1位点测序结果Fig.1 Sequencing results of HLA-DQB1 locus of the sample
2.2 PCR-SSO 分型 先证者 HLA-A/B/C/DRB1 位点PCR-SSO 分型结果分别为A*02:06:01G,31:01:02G;B*13:01:01G,35:08:01G;C*03:04:01G,04:01:01G;DRB1*03:01:01G,15:01:01G。DQB1 位点分型结果为 DQB1*02:01:01G(G 组包含 02:106),06:02:01G(G 组包含06:109)。扩增值良好,未发现有异常反应的磁珠,但结果为模棱两可组合,无法区分(图2)。
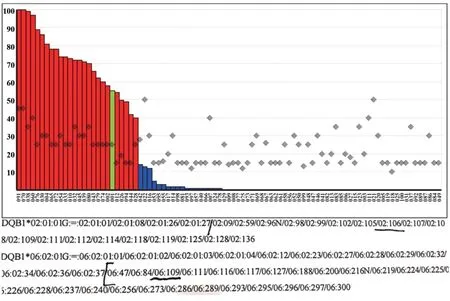
图2 HLA-DQB1位点Luminex SSO 分型结果Fig.2 HLA-DQB1 locus Lumines SSO results
2.3 NGS 结果 经NGS 方法验证,该样本HLA-A/B/C/DRB1 位点分型结果与PCR-SBT 和PCR-SSO两种方法检测结果相同,HLA-DQB1 结果确定为02:106,06:02。
2.4 DQB1*02:106 与 DQB1*02:01:01:01 核苷酸和氨基酸序列比对 与DQB1*02:01:01:01 相比,DQB1*02:106 在第 3 外显子 619 位置有一个氨基酸的差异,DQB1*02:01:01:01 为 G,DQB1*02:106 为A,造成第175位氨基酸由非极性疏水性氨基酸缬氨酸Val(GTG)变成极性中性氨基酸蛋氨酸Met(ATG),见图3。

图3 DQB1*02:106 与 DQB1*02:01:01:01 差异核苷酸和氨基酸比较Fig.3 Comparison of nucleotide and amino acid differ⁃ence between DQB1*02:106 and DQB1*02:01:01:01
2.5 HLA-DQB1*02:01:01:01 与 HLA-DQB1*02:106 三维同源建模与分子间RMSD HLA-DQB1*02:106 分子与氨基酸序列最接近HLA-DQB1*02:01:01:01分子相比,差异氨基酸位于β2链β折叠的部分,接近β2 链的尾端。经FATCAT 在线软件对三维结果的比对分析,含有183 个氨基酸的HLADQB1*02:106 与 HLA-DQB1*02:01:01:01 分 子RMSD值为1.65,见图4。

图4 HLA-DQB1*02:106 与 HLA-DQB1*02:01:01:01 差异氨基酸和三维结构比较Fig.4 Comparisons of difference amino acid and threedimensional structure of HLA-DQB1*02:106 and HLA-DQB1*02:01:01:01 molecule models
2.6 通过家系单体型分析及地区分布分析 根据家系分析先证者的HLA 两条单体型为A*31:01-B*15:18-C*04:01-DRB1*03:01-DQB1*02:106 和 A*02:06-B*13:01-C*03:04-DRB1*15:01-DQB1*06:02。经家系分析该等位基因遗传于父亲,见图5。

图5 先证者HLA-A/B/C/DRB1/DQB1 5 位点单体型家系分析Fig.5 Pedigree analysis of HLA-A/B/C/DRB1/DQB1 haplotype
2.7 查询单体型地区分布 在HaploStats(http://www.HaploStats.org)在线数据库查询单体型A*31:01-B*15:18-C*04:01-DRB1*03:01-DQB1*02:106在世界所有人群中的分布,未查询到该单体型的分布。以HLA-DQB1*02:106 查询无相关单体型。以单体型 A*31:01-B*15:18-DRB1*03:01-DQB1*02:01 查询到的单体型有3 种,相关联的C 位点等位基因不同,单体型和频率如表1。A*31:01-C*03:03-B*15:18-DRB1*03:01-DQB1*02:01 在西班牙人种中频率最高(5.712E-8),在高加索人种的频率为2.391E-8,在非裔美国人频率为7.542E-10,亚洲和太平洋岛民和印第安人未发现该单体型。A*31:01-C*07:01-B*15:18-DRB1*03:01-DQB1*02:01 仅在非裔美国人种发现。A*31:01-C*07:04-B*15:18-DRB1*03:01-DQB1*02:01在非裔美国人种,高加索人种,西班牙人种都有发现。

表1 A*31:01-B*15:18-DRB1*03:01相关单体型在不同人种的分布Tab.1 Distribution of A*31:01-B*15:18-DRB1*03:01 related haplotypes in different races
3 讨论
目前,应用于临床HLA 的检测方法主要有序列特异性寡核苷酸探针、序列特异性引物、PCR-SBT、NGS 等[9-11]。PCR-SBT 被誉为 HLA 基因分型的金标准,由于测序结果存在多种等位基因组合在检测区域内具有相同的杂合序列,模棱两可组合出现越来越多[12-13]。NGS技术应用于HLA 等位基因测序主要有两个优势,第一,针对HLA 单链测序,分别得到特定单一等位基因序列,很大程度上减少了模棱两可的结果;第二,NGS 技术针对HLA 位点整个基因组序列进行测定,得到的HLA 分型结果更精准。本次临床HLA 检测工作中,HLA-DQB1 测序分析的结果为常见等位基因+罕见等位基因模棱两可组合(DQB1*02:01:01+06:109 和DQB1*02:106+06:02:01:01),PCR-SSO 及检测结果为 DQB1*02:01G(包含DQB1*02:106)+06:02G(包含DQB1*06:109),这两种方法均无法确定唯一高分辨结果。经NGS 技术鉴定,该样本HLA-DQB1 位点最终结果为DQB1*02:106,06:02:01:01。至此,最终确定该样本HLADQB1 位点的结果为罕见等位基因DQB1*02:106 与常见等位基因DQB1*06:02:01:01组合。
根据 IMGT/HLA 数据库(版本 3.40.0,2020 年4 月发布),共有1 826 种HLA-DQB1 等位基因,根据中国常见及确认HLA 等位基因CWD 表2.4 版,HLA-DQB1 位点常见及确认等位基因有60 种,罕见等位基因占95.36%。HLA-DQB1*02组共有228种等位基因,常见等位基因有4 种:HLA-DQB1*02:01,HLA-DQB1*02:02,HLA-DQB1*02:03,HLADQB1*02:12,提示虽然HLA 等位基因众多,但罕见等位基因占了大多数,约40%的HLA 等位基因只被报道过 1 次。DQB1*02:106 在 2018 年首次被瑞士报道后,未查询到在其他实验室和人种的关于此等位基因和单体型的相关报道,直到本次被再次检测到并且有相关单体型,因此需要在临床检测工作中不断地对罕见等位基因和单倍型进行分析和总结,对于研究人群特异性免疫遗传学基础和临床移植免疫有重要意义。
HLA 抗原具有高度遗传多态性,主要表现在同一基因座位等位基因的高度多态性,在机体的免疫应答启动和免疫调节中发挥重要作用,HLA-DQB1*02:01 与疾病间的相关性研究已有诸多报道。HJELMSTRÖM 等[14]报道 HLA-DQB1*02:01 与重症肌无力发病呈阳性关联,Ala57β于早期发病患者中频率升高。HLA-DQB1*02:01 在伊朗人群中与1 型糖尿病显著相关,与韩国儿童1 型糖尿病抗胰岛素抗体相关[15-16]。在印度南部人群中HLA-DQB1*02:01是自身免疫性甲状腺疾病的保护性等位基因,Ala86β、Tyr87β、Gly26β、Ser74β、Phe9β和 Ser57β是 自 身免 疫性甲状腺疾病的保护性氨基酸残基[17]。HLADQB1*02 与慢性丙型肝炎感染和干燥综合症相关[18]。关于HLA-DQB1 位点的等位基因和氨基酸残基与疾病相关的研究都是针对HLA-DQB1 等位基因 Exon2 编码的 β1 链的 90 个氨基酸,因为 β1 链是最具多态性的部位,同时也是与抗原肽结合的部位。Exon3 编码的β2 链是免疫球蛋白样区,作用主要为与T 细胞的CD4 分子结合和稳定HLA Ⅱ类分子的结构。DQB1*02:106 核苷酸序列与DQB1*02:01:01:01 相比,只在 619 位有一个核苷酸的差异(G>A),导致 β2 链 175 位氨基酸由缬氨酸(GTG,Val)变为蛋氨酸(ATG,Met),该位置的氨基酸变化是否会影响HLA 分子与抗原肽结合,还需在后续的研究中探讨。在对HLA 等位基因与疾病相关性研究中,为了确保检验效能,一般不统计分析频率小于2%的等位基因,罕见等位基因如HLA-DQB1*02:106 通常不被计算。自 2010 年 4 月起,HLA 命名委员会基于抗原结合槽核苷酸序列相同(HLAⅠ类等位基因外显子2、3 核苷酸序列相同和HLA Ⅱ类抗原外显子2 序列相同)将HLA 等位基因分为不同的G 组,HLA-DQB1*02:106 属于 HLA-DQB1*02:01:01G,在病例对照研究中,是否应该基于G 组进行频率的差异统计,分析与疾病相关性的等位基因组,有待于进一步研究。
在异基因造血干细胞移植中,HLA-A/B/C/DRB1/DQB1 是影响移植存活率的主要因素之一。与HLA-A/B/C 分子相比,HLA-DQB1 分子在细胞表面的表达量少,多态性少,与HLA-DRB1 位点的等位基因呈强连锁不平衡,直到2006年才被确认为异基因造血干细胞移植前必须检测的HLA 等位基因之一。随着异基因造血干细胞移植技术的广泛开展,HLA 不完全相合移植在逐渐增多。HLA-A/B/C/DRB1/DQB1 等位基因错配对异基因造血干细胞移植后效果的评估由只是单纯统计不相合等位基因的个数逐渐向基因功能和表达量分析转变[19-20]。目前对DQB1 位点异基因移植错配后是否会引起移植物抗宿主病(graft versus host disease,GVHD)还没有统一的结论。在一项德国人群移植后回顾性分析发现,DQB1 等位基因不相合与其他HLA 等位基因不相合有相同的危险比[21],但在一项HLA-A/B/C/DRB1/DQB1 9/10 匹配临床回顾性研究发现,与HLA-A,-B,-C 位点的不相合相比,DRB1/DQB1 有些错配是允许的[22]。目前在可允许错配方面还没有建立统一的标准,一些采用交叉反应组,还有一些采用氨基酸残基匹配方案。这两种方案都是建立在抗原结合槽的基础上,分析HLA-Ⅰ类抗原α1和 α2 区域和 HLA-Ⅱ类抗原的 β1 区域。HLA 分子关键位置的氨基酸替换会引起严重的急性GVHD[20,23]。与HLA-DQB1*02:01氨基酸序列相比,HLA-DQB1*02:106 尽管只在 175 位有一个氨基酸的差异,由非极性疏水性氨基酸缬氨酸(GTG,Val)变为极性中性氨基酸蛋氨酸(ATG,Met),但氨基酸侧链大小不同可能会导致HLA 分子空间结构不同,仅1个氨基酸的差别也可引起HLA分子三维结构明显变化;而HLA-DQB1*02:106 与HLA-DQB1*02:01的RMSD 值为1.65,分子间结构差异较大。既往研究表明,供受体之间HLA-Ⅱ类分子间RMSD 值大于0.02 nm,极有可能发生严重的 GVHD[24]。DQB1*02:106 与 DQB1*02:01 分子错配移植是否会发生GVHD,需要建立在HLA 三维结构和功能基础上的对异基因造血干细胞移植后GVHD、总生存率、移植后是否产生HLA 分子的抗体产生等方面回顾性研究来最终确定。
HLA 高度的多态性使得异基因造血干细胞移植供受者之间HLA-A/B/C/DRB1/DQB1 位点10/10 完全匹配的可能性降低,尤其是携带罕见等位基因的患者,找到全相合无关异基因捐献者的可能性更低。某些罕见基因可能与某些单体型关联或仅存在于保守的单体型中,本次临床检测样本HLADQB1 位点的结果为 HLA-DQB1*02:106,家系分析其 相 关 单 体 型 为 A*31:01-B*15:18-C*04:01-DRB1*03:01-DQB1*02:106,来源于先证者父亲,并且稳定遗传至先证者和弟弟,可以进行亲缘的半相合造血干细胞移植。基于家系分析等位基因和单体型,在相同的遗传背景下更容易找到相合的供者。
本研究基于在临床HLA 高分辨确认分型实验中检出HLA-DQB1 模棱两可组合,经NGS 确认为HLA-DQB1*02:106,进一步分析该等位基因核苷酸和氨基酸序列及对三维结构进行预测和比对分析,同时对先证者进行家系分析确定HLA-DQB1*02:106 相关的单体型并查询该单体型在不同人群的分布,对罕见等位基因和单体型的总结研究为临床指导非亲缘造血干细胞移植供者的选择提供理论依据,保证携带确认和罕见等位基因的患者最大可能地找到匹配的供者。