大黄牡丹汤调控HMGB1/RAGE/NF-κB信号通路干预急性胰腺炎模型大鼠的机制
宋 冰,辜吉秀,汪永锋,张延英,余四九*
(1.甘肃农业大学,兰州 730070;2.甘肃中医药大学实验动物中心 甘肃省实验动物行业技术中心,兰州 730000;3.甘肃省疾病预防控制中心,兰州 730000)
急性胰腺炎(acute pancreatitis,AP)作为急腹症的一种,在临床诊疗中较为常见,其特点是可以由多种病因引发,导致胰酶在胰腺内被异常激活,从而引起胰腺组织发生自身消化、水肿、充血、出血直至进一步坏死的局部性炎症反应,严重时甚至能引发全身炎性反应并伴随多个脏器损伤,引发死亡风险[1-3]。因此,如何有效阻断炎性反应的发生成为目前研究的重点。本研究复制AP动物模型并使用具有“泻热通腑”功效的大黄牡丹汤进行干预,前期研究[4]已经表明,大黄牡丹汤可以有效改善大鼠一般生存状况、肝肾功能以及胰腺组织病理改变,然而,关于其有效降低炎性反应的机制尚不明晰。大量研究表明[5-6],腺泡细胞的损伤致使大量的高迁移族率蛋白B1(high mobility group protein,HMGB1)分泌于细胞外,进而激活下游糖基化终产物受体(receptor for advanced glycation endproducts, RAGE)表达,放大核因子κB(nuclear factor kappa-B,NF-κB)所介导的炎性反应发生。目前鲜有基于该信号通路开展大黄牡丹汤有效干预AP的研究报道。本文旨在继续研究大黄牡丹汤治疗对胰腺组织内HMGB1/RAGE/NF-κB信号通路关键分子基因和蛋白表达水平以及下游炎性因子含量的影响,以揭示其对AP的作用机制,为临床防治急性胰腺炎提供科学依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 选取2月龄SPF级Wistar大鼠96只,雌雄各半,体质量(180±20)g,购自甘肃中医药大学SPF级实验动物中心。动物生产许可证号:SCXK(甘)2015-0001,实验动物质量合格证号:62001000000580(甘肃中医药大学),实验动物设施使用证明号:00000563(甘肃中医药大学)。饲养条件同文献[4]。
1.1.2 主要试剂与仪器 大黄牡丹汤组方及来源同文献[4]。奥曲肽,批号:171018,国药一心制药有限公司生产;大鼠TNF-α试剂盒、大鼠IL-6试剂盒、大鼠IL-1β试剂盒均购自江苏菲亚生物科技有限公司,批号:1907R;GAPDH抗体、HMGB1抗体购自美国ImmunoWay公司,批号:B1501、B8301;RAGE抗体、p-NF-κB p65抗体、p-IκBα抗体购自美国GeneTex公司,批号:821904538、821904930、821403585;凝胶成像分析系统、逆转录仪、酶联免疫检测仪均购自美国BIO-RAD公司;实时定量PCR仪购自美国Thermo Fisher公司。
1.2 方法
1.2.1 动物模型复制 采用胰胆管逆行注射牛磺胆酸钠溶液建立大鼠急性胰腺炎模型,同文献[4],假手术组采用相同方法注射生理盐水。
1.2.2 动物分组及试验干预 分组方法同文献[4],按照随机数字表法将大鼠随机分为6组:假手术组(A组)、模型组(B组)、阳性药物对照组(C组)和大黄牡丹汤高(D组)、中(E组)、低(F组)3个试验剂量组,每组16只。假手术组和模型组大鼠灌胃给予生理盐水10 mL·kg-1;阳性药物对照组皮下注射奥曲肽10 μg·kg-1;高、中、低3个剂量试验组分别灌胃大黄牡丹汤14、7和3.5 g·kg-1,连续给药6 d(大黄牡丹汤给药剂量设定方法:大黄牡丹汤剂量参考《中药药理实验方法学》[11],根据临床用量的体重折算,大鼠的等效剂量约为7 g·kg-1,即大黄牡丹汤中剂量组;按照等比级数分组确定大黄牡丹汤高、低剂量组的给药剂量分别为14和3.5 g·kg-1)。
1.2.3 形态指标测试及取材 同文献[4]记录大鼠摄食量及体重,药物干预6 d后心脏采血分离血清,常规麻醉后行颈椎脱臼法处死,取胰腺组织。
1.2.4 血清生化学指标检测 检测各组大鼠血清中淀粉酶(amylase,AMS)、谷草转氨酶(aspartate transaminase,AST)、谷丙转氨酶(alamine aminotransferase,ALT)含量,同文献[4]。
1.2.5 胰腺组织病理学改变检查 常规制备大鼠胰腺组织石蜡切片、HE染色,在显微镜下观察各组大鼠的胰腺病理形态学变化。
1.2.6 ELISA法检测胰腺组织中炎症因子含量 按照ELISA试剂盒随附的说明书进行严格操作,检测胰腺组织中因子IL-1β、TNF-α、IL-6,同文献[4]。
1.2.7 RT-PCR法检测胰腺组织HMGB1、RAGE基因表达水平 使用TRIzol提取胰腺组织总RNA并测定其浓度以及OD260 nm/OD280 nm比值,同文献[4]。严格按照反转录试剂盒以及扩增试剂盒说明书加样并进行扩增。选取β-actin作为内参基因,得到各扩增反应的Ct值,采用2-ΔΔCt法计算目的基因的mRNA相对表达量。引物的合成由宝生物工程(大连)有限公司完成,引物的具体序列见表1。

表1 基因的引物序列
1.2.8 IHC法检测胰腺组织HMGB1、RAGE蛋白表达水平 取胰腺组织切片行常规免疫组化操作手法;并使用光学显微镜观察,分析计算各组的平均光密度(IOD)值。
1.2.9 Western blot法检测胰腺组织NF-κBp65、IκB蛋白磷酸化水平 同文献[4]提取胰腺组织蛋白提取液,进行聚丙烯酰胺凝胶电泳,转膜,封闭,孵育一抗,洗膜,孵育二抗,洗膜,最后采用ECL发光液化学发光,对图像进行数据分析。
1.3 统计学方法
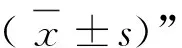
2 结 果
2.1 一般状况观察[4]
假手术组(A组)大鼠表现基本正常,模型组(B组)一般生活状况较差,各治疗组(C、D、E、F组)大鼠症状不同程度减轻,尤其以大黄牡丹汤高剂量组改善最明显。
2.2 大黄牡丹汤对各组大鼠血清生化学指标的影响[4]
如表2所示,与假手术组(A组)比较,模型组(B组)大鼠AMS、ALT、AST含量显著升高(P<0.05);与模型组(B组)比较,各治疗组(C、D、E、F组)大鼠AMS、ALT、AST均下降,其中尤以大黄牡丹汤高、中剂量组显著(P<0.05)。
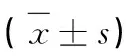
表2 大黄牡丹汤对各组大鼠血清生化学指标的影响
2.3 大黄牡丹汤对各组大鼠胰腺组织病理改变的影响
各组大鼠胰腺组织病理改变如图1。假手术组(A组)大鼠的胰腺组织结构未见异常;模型组(B组)大鼠的胰腺组织腺泡和小叶导管损伤严重,炎性充血水肿明显,基本不可见正常形态;各治疗组(C、D、E、F组)均不同程度可见胰腺组织腺泡和小叶导管损伤,炎性充血水肿等,但均较模型组(B组)不同程度减轻,尤以大黄牡丹汤高剂量组最显著。

A~F.A组~F组
2.4 大黄牡丹汤对各组大鼠胰腺组织中IL-1β、TNF-α、IL-6含量的影响
与假手术组(A组)比较,模型组(B组)大鼠IL-1β、TNF-α、IL-6含量显著升高(P<0.05);与模型组(B组)比较,各治疗组(C、D、E、F组)大鼠IL-1β、TNF-α、IL-6均下降(P<0.05或P>0.05),其中尤以大黄牡丹汤高剂量组最明显(P<0.05,图2)。
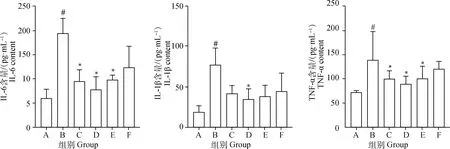
图2 大黄牡丹汤对炎症因子的影响
2.5 大黄牡丹汤对各组大鼠胰腺组织中HMGB1、RAGE基因表达水平的影响
如图3所示,与假手术组(A组)比较,模型组(B组)大鼠HMGB1、RAGE基因表达显著升高(P<0.05);与模型组(B组)比较,各治疗组(C、D、E、F组)大鼠HMGB1、RAGE基因表达均下降(P<0.05或P>0.05),其中尤以大黄牡丹汤高剂量组最明显(P<0.05)。

图3 大黄牡丹汤对HMGB1、RAGE基因表达的影响
2.6 大黄牡丹汤对各组大鼠胰腺组织HMGB1、RAGE蛋白表达水平的影响
如图4所示,光镜下可以明显观察到组织形态的改变,黄染颗粒为阳性染色,主要表达于胞核、胞质中;各组IOD值统计表明:与假手术组(A组)比较,模型组(B组)大鼠HMGB1、RAGE蛋白表达显著升高(P<0.05);与模型组(B组)比较,各治疗组(C、D、E、F组)大鼠HMGB1、RAGE蛋白表达均下降(P<0.05或P>0.05),其中尤以大黄牡丹汤高剂量组明显(P<0.05)。

a、b.对HMGB1蛋白表达的影响;c、d.对RAGE蛋白表达的影响
2.7 大黄牡丹汤对各组大鼠胰腺组织p-NF-κBp65、p-IκBα蛋白表达的影响
如图5、图6所示,与假手术组(A组)比较,模型组(B组)大鼠p-NF-κBp65、p-IκBα蛋白表达显著升高,组间差异有统计学意义(P<0.05);与模型组(B组)比较,各治疗组(C、D、E、F组)大鼠p-NF-κBp65、p-IκBα蛋白表达均下降(P<0.05或P>0.05),其中尤以大黄牡丹汤高剂量组最明显(P<0.05)。

图5 胰腺组织p-NF-κBp65、p-IκBα蛋白电泳图

图6 大黄牡丹汤对p-NF-κBp65、p-IκBα蛋白表达的影响
3 讨 论
牛磺胆酸钠的分子式是C26H44NNaO7S,是一种有细胞毒性的化学物质,能够通过诱导方式导致胰腺发生损伤,但该损伤具有剂量依赖的特点,研究人员通过注射不同浓度的牛磺胆酸钠溶液进行造模,得到相应病理损害程度的实验动物模型,经胰胆管逆行注射牛磺胆酸钠复制急性胰腺炎动物模型是目前国内使用较为广泛的实验方法[7-8]。本研究采用该法造模后,取模型组大鼠血清,经生化检测发现,大鼠AMS急剧升高,肝损伤严重(ALT、AST);取胰腺组织镜下观察,胰腺组织腺泡细胞大量坏死,小叶导管结构模糊,叶间隔明显增宽,可见大量充血、水肿以及炎性细胞浸润,均提示模型复制成功。
中药方剂大黄牡丹汤的功效是泻热破瘀、散结消肿。在此方中,大黄可以清泻湿热瘀结之毒;芒硝能够助大黄清热解毒,泻下通便;桃仁、丹皮有凉血散血、活血化瘀的作用;冬瓜仁有排脓散结,兼有利湿的功效;五味药配伍精当,共同发挥泻热破瘀、散结消肿的功效[4]。临床实践表明[9-10],大黄牡丹汤及加减治疗 AP 疗效显著,本课题组前期动物试验亦证实了这一点[4]。
大黄牡丹汤方中牡丹皮的药效活性成份主要包括芍药苷和丹皮酚[11],均具有显著的抗炎、抗氧化、镇痛等作用,Li等[12]使用溶血磷脂酰胆碱(LPC)处理人脐静脉内皮细胞(HUVEC),在应用芍药苷干预后能使细胞的存活率提高,降低了HMGB1及其受体RAGE的表达和释放,表明芍药苷通过抑制HMGB1-RAGE/NF-κB途径抑制LPC诱导的炎症因子的产生;钱哲等[13]发现,芍药苷可以通过调控HMGB1/NF-κB信号通路抑制炎症反应,显著降低组织中TNF-α、IL-1β、IL-6的含量;Qiu等[14]研究表明,丹皮酚通过抑制HMGB1/NF-κB信号通路及细胞因子TNF-α和IL-1β的产生,发挥镇痛作用;Liu等[15]研究发现,丹皮酚能够抑制HMGB1-NF-κB信号通路关键分子HMGB1、NF-κB以及下游炎症因子TNF-α表达。Ping等[16]在研究丹皮酚干预晚期氧化蛋白产物(advanced oxidation protein products,AOPP)导致的THP-1巨噬细胞的氧化应激损伤中,发现其可以显著降低RAGE的表达水平,下调促炎细胞因子(TNF-α、IL-1β、IL-6)的mRNA和蛋白质水平,表明丹皮酚具有抗炎和抗氧化活性的功效。大黄同样具有显著抗炎效果,巩博等[17]报道,在脓毒症大鼠模型中使用大黄能够抑制HMGB1、RAGE的蛋白表达水平,降低NF-κB的活化程度;大黄的活性物质主要包括蒽醌类大黄酸和大黄素[18],田新玮等[19]采用不完全氟氏佐剂及牛Ⅱ胶原乳化剂建立类风湿关节炎大鼠模型,在使用大黄素进行治疗后,发现血清中HMGB1蛋白表达,TNF-α、IL-1β、IL-6含量均显著减少,可通过降低炎症反应缓解类风湿关节炎症状;黄慧娜等[20]也通过细胞试验证明,大黄酸能有效抑制脂多糖(lipopolysaccharide,LPS)刺激下RAW264.7 细胞 HMGB1 的表达和释放;夏丽等[21]的研究发现,大黄素可以抑制RAW264.7 巨噬细胞源性泡沫细胞NF-κB、IL-1、TNF-α的表达。桃仁的具体成分尚不明晰,而其水煎液或提取物均表现出不同程度的抗炎作用,如吴飞飞和张邢炜[22]使用桃仁提取物干预冠心病(coronary heart disease,CHD)模型大鼠,发现心肌组织中NF-κB蛋白表达水平明显降低,血清中TNF-α、IL-6水平也明显下降,表明其可以阻断NF-κB/COX-2通路进而抑制炎症因子表达,减轻心肌损伤发挥保护作用;以敏等[23]使用桃仁提取物干预血瘀证大鼠模型,发现可以降低血管内皮细胞NF-κB的表达,抑制损伤性细胞因子的合成和表达,使组织细胞不易损伤,预防微循环障碍性损伤。冬瓜子的相关研究相对较少,但亦有关于其抗炎作用的报道,如姜文等[24]研究发现,使用冬瓜子干预肺纤维化大鼠模型,血清中TNF-α等炎性因子出现了明显的降低,提示其在抑炎作用方面具有显著效果。
高迁移族率蛋白B1(high mobility group protein,HMGB1)是一种高度保守的核蛋白,生理条件下其参与基因转录、DNA修复以及细胞自噬等多种生物学事件[25]。研究表明,发生损伤的腺泡细胞可以向细胞外分泌大量的HMGB1,而释放到细胞外的HMGB1可通过糖基化终产物受体刺激NF-κB信号通路的激活来介导大量促炎介质如TNF-α、IL-1β、IL-6、IL-8等的释放,进而级联式放大炎性反应[5-6]。RAGE是第一个被证明能与HMGB1结合的受体,研究发现,HMGB1通过RAGE介导进而调控免疫细胞和其他细胞的趋化、增殖等功能[26-28]。已经有临床研究证实,HMGB1的异常升高能够反映AP患者病情严重程度,同时其异常释放对AP患者肝功能以及预后关系密切[29]。此外,动物试验表明,在重症急性胰腺炎小鼠模型的胰腺组织中,HMGB1、NF-κB p65有显著升高,而药物干预后缓解重症急性胰腺炎小鼠胰腺损伤与降低HMGB1、NF-κB p65蛋白表达有关[30]。
本研究中,和假手术组进行比较,模型组大鼠胰腺组织中HMGB1、RAGE基因蛋白表达,下游蛋白NF-κBp65、IκBα磷酸化水平,炎性因子TNF-α、IL-1β、IL-6含量显著升高(P<0.05);和模型组进行比较,各治疗组大鼠胰腺组织中HMGB1、RAGE基因及蛋白表达,下游蛋白NF-κBp65、IκBα磷酸化水平,炎性因子TNF-α、IL-1β、IL-6含量不同程度降低,各组中尤其是大黄牡丹汤高剂量组的情况改善最为明显(P<0.05)。说明大剂量大黄牡丹汤有效抑制了HMGB1/RAGE/NF-κB信号通路的激活,进而调控炎性因子的分泌,减轻由此产生的级联式炎性放大反应,促进胰腺组织细胞的修复,进而发挥保护作用。
4 结 论
大黄牡丹汤能够显著缓解大鼠急性胰腺炎疾病进展,其机制与大黄牡丹汤能够抑制HMGB1/RAGE/NF-κB通路激活,进而阻断炎性级联反应有关。

