基于UHPLC-QTOF-MS代谢组学方法筛选奶牛不同妊娠状态时的候选生物标志物
罗 芳,陶金忠
(宁夏大学农学院 动物科学系,银川 750021)
受精后早期妊娠诊断是决定牛场经济效益高低的重要因素之一,人工授精后尽早识别未妊娠奶牛是减少因检测发情效率低下而导致妊娠间隔延长的最好方法。若不能尽早识别未妊娠奶牛,会导致下一次情期配种时间延长,从而加大产犊间隔,引起牧场繁殖力低下和育种成本升高等一系列问题[1]。早期妊娠诊断不仅影响牧场繁殖率,还会导致产奶量降低,有研究报道,奶牛空怀时间超过21 d(一个发情周期),每头奶牛的产奶量将会减少168~315 kg[2]。从授精当天到第17天是精卵结合到妊娠识别的一个阶段。奶牛妊娠建立是一个极其复杂的过程,要经历排卵、受精、胚泡形成、孕体生长、妊娠识别信号分泌以及胚胎和胎盘的发育等一系列复杂的反应[3]。授精后15~17 d也被认为是维持妊娠的关键时期,妊娠识别发生在配种后的15~17 d,而母体接纳孕体的时间最晚不超过17 d[4]。在妊娠早期,孕体与母体之间建立密切联系,孕体发育到囊胚期滋养外胚层开始分泌适当的抗黄体溶解信号(INF-τ)来阻断子宫内膜前列腺素(PGF2α)的产生,INF-τ会抑制黄体周期性溶解,保证孕酮正常分泌从而维持妊娠[5-6]。目前,生产上已经通过经直肠超声检测对奶牛进行早期妊娠诊断,或者人工授精后35 d内通过触诊子宫形态变化来判别妊娠状态[7]。如果奶牛没有妊娠且发情周期持续21 d,那么人工授精后的第27~29天相当于发情周期的第6~8天。发情周期第6~8天时第一个优势卵泡达到其最大直径[8],如果在第6~8天给予PGF2α处理,母牛将于40~48 h 后开始发情[9]。未妊娠奶牛可在人工授精后第27~29天使用PGF2a诱导黄体退化,并在检测到发情后进行重复的定时输精或者再受精。因此,早期准确的妊娠诊断可以减少奶牛空怀时间、缩短产犊间隔,进一步提高牧场经济效益。
代谢组学是目前常用的系统生物学技术之一,主要研究机体受扰动后相对分子质量小于1 000的内源性小分子代谢物的动态变化。近年来,代谢组学方法已被成功应用于奶牛疾病诊断和生理机制以及包括转基因动物在内的疾病动物模型的确证、药物筛选、药效及毒性评价、作用机制和临床评价等方面[10]。超高效液相色谱串联四极杆飞行时间质谱(UHPLC-QTOF/MS)具有UHPLC快速高效的色谱分离能力和QTOF的高分辨率、高灵敏度。目前,基于UHPLC-QTOF/MS的代谢组学技术已广泛应用于动物疾病标志物的筛选及药效毒性评价等多个领域。郭延生和陶金忠[11]应用LC-Q/TOF-MS代谢组学方法对人工授精当天和第17天的荷斯坦奶牛乳样进行研究,发现牛奶中的L-酪氨酸、N-乙酰基-L-酪氨酸、L-脯氨酸、四氢1-苯甲基-1, 2, 3, 4-四氢异喹啉、鸟苷和十七烷基肉碱有望成为妊娠识别期妊娠诊断标识物,可为深入研究奶牛早期妊娠识别机理提供新视角。Yang等[12]基于UHPLC-QTOF/MS代谢组学技术研究高谷物饮食与肉牛生长性能之间的关系,发现饲喂高玉米日粮能够增加瘤胃和血液中的脂多糖和有害代谢产物,这些差异代谢物及其相关代谢通路可能有助于探索饲喂高玉米日粮导致代谢性疾病的潜在生物标志物。
本研究基于UHPLC-QTOF/MS的代谢组学方法对奶牛人工授精后第17天的血浆代谢轮廓及代谢物变化进行研究,观察胚胎发育过程中不同时间点代谢物变化规律,寻找早期妊娠诊断的候选生物标识物,为提高母畜受胎率奠定基础。
1 材料与方法
1.1 仪器与试剂
Triple TOF 6600高分辨质谱仪(AB SCIEX),1290 UHPLC 超高压液相色谱仪(Agilent),Heraeus Fresco17低温高速离心机(Thermo Fisher Sci-entific),液相色谱柱(Waters ACQUITY UPLC BEH Amide,2.1*100 mm, 1.7 μm),BSA124S-CW天平(Sartorius),明澈 D24 UV纯水仪(Merck Millipore),YM-080S超声仪(深圳市方奥微电子有限公司),甲醇(CNW Technologies,67-56-1),乙腈(CNW Technologies,75-05-8),乙酸铵(CNW Technologies,631-61-8),氨水(Ammonium hydroxide),内标:L-2-氯苯丙氨酸(上海恒柏生物科技有限公司,103616-89-3)。
1.2 试验动物与分组
以宁夏某奶牛场体重为(550±50)kg,体况评分相近的经产(2~3胎次)健康荷斯坦奶牛为试验对象。同期发情后,在人工授精后第17天晨饲前对奶牛进行尾静脉采血,肝素抗凝后,3 000 r·min-1离心10 min,收集上层血浆,置于-80 ℃冰箱冷冻保存,以备后续分析。后期采用计步器对奶牛进行发情鉴定,观察记录授精28 d前奶牛的返情情况,并且在授精第32天时采用B超仪进一步进行早期妊娠诊断,根据诊断结果将奶牛分为妊娠组(A组,n=12)和未妊娠返情组(B组,n=24),将这两组样品进行代谢组学分析。
1.3 样本预处理
从-80 ℃冰箱中取出样本,在 4 ℃环境下缓慢解冻后,分别移取100 μL 样本至EP管中,加入400 μL 提取液(甲醇∶乙腈=1∶1(V/V),含内标2 μg·mL-1),涡旋混匀1 min;冰水浴超声10 min;然后在-40 ℃条件下静置60 min后在4 ℃,12 000 r·min-1离心15 min;取上清425 μL于EP管中,真空干燥后加入100 μL 50%乙腈复溶,涡旋30 s,冰 水浴超声10 min后在4 ℃,13 000 r·min-1条件下离心15 min;取70 μL上清液于进样瓶中上机检测;同时,分别取所有样品10 μL上清液混合成质量控制(quality control, QC)样品上机检测。
1.4 样本UHPLC-QTOF-MS分析
本研究整个分析过程样品盘温度始终为4 ℃,通过超高效液相色谱系统的液相色谱柱对目标化合物进行色谱分离,分离结束后使用Thermo Q Exactive Orbitrap 质谱仪进行一级、二级质谱数据采集。色谱分离时进样体积为2 μL,柱温为25 ℃,流动相流速为0.5 mL·min-1;液相色谱A相为水相,含25 mmol·L-1乙酸铵和25 mmol·L-1氨水;B相为乙腈,采用梯度洗脱。质谱参数如下:气体温度为250 ℃;气流为16 L·min-1;鞘气温度为350 ℃;鞘气流量为12 L·min-1;雾化器为20 psi;碎裂机为175 V;毛细管电压为3 000 V。
1.5 数据处理及统计分析
使用ProteoWizard软件将质谱原始数据转成mzXML格式,进一步采用XCMS 程序进行峰对齐、保留时间校正和峰面积提取。删除组内缺失值超过50%的离子峰面积数据,而缺失值未超过50%的离子峰面积数据按最小值的二分之一进行填充。然后使用SIMCA-P14.1软件对预处理后的数据进行多元统计分析,主要包括无监督的主成分分析(principal component analysis, PCA)和有监督的正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis, OPLS-DA)。PCA用于确定组内聚集和组间分离趋势,而OPLS-DA用于进一步确定组间差异。使用PCA和OPLS-DA模型反映A、B两组样品代谢轮廓的变化,经过7次循环交互验证得到模型解释率(R2Y)和模型预测率(Q2),当R2Y和Q2大于0.4,Q2intercept<0时,认为模型稳定可靠。然后采用T检验及差异倍数分析对VIP(variable importance in the projection)>1的代谢物进行统计分析,结果用P值表示,P<0.05说明差异显著。
1.6 差异代谢物的鉴定分析
差异代谢物的鉴定采用精确质量数匹配(<25 ppm)与二级谱图匹配相结合的方式,检索对比在线HMDB(http://www.hmdb.ca)、KEGG(http://www.genome.jp/kegg/)和 METLIN(http://metlin.scripps.edu/)数据库;然后使用牛代谢组学数据库(DMDB, http://www.cowmetdb.ca/)进行比对和校正。使用MetaboAnalyst 5.0(http://www.metaboanalyst.ca)和Origin8.0软件中的ROC曲线对已经鉴定的差异代谢物进行聚类分析和分类识别。
2 结 果
2.1 血浆样品代谢谱及数据分析
分别将QC样本在正、负离子检测模式下的总离子流图(TIC)进行谱图叠加比较,结果显示,在正、负离子模式下QC样品TIC图的保留时间和信号强度都基本重叠,说明在整个试验过程中仪器误差带来的变异很小,测得的数据质量可靠。
由PCA得分图(图1)可知,A和B两组样品之间没有呈明显的分离趋势,正负离子模式下AvsB组之间的模型解释率(R2X)分别为0.433和0.518。进一步使用有监督正交偏最小二乘法来评估A、B两组间的样本差异,正负离子模式下AvsB 组OPLS-DA得分图(图2)的R2Y和Q2参数分别为0.941、-0.064和0.936、-0.268;AvsB 组Q2<0.4,说明这两组构建的模型预测能力偏低,R2X和R2Y均>0.4,说明从人工授精后奶牛血浆代谢物发生了改变。为验证OPLS-DA模型是否存在过拟合,采用200次排序检验对OPLS-DA模型进行验证,正负离子模式下的Q2intercept分别为-0.192和-0.260,Q2intercept均<0,说明OPLS-DA 模型未过度拟合,OPLS-DA 模型可靠有效。

图1 正(a)、负(b)离子模式下PCA-X得分图

图2 正(a)、负(b)离子模式下OPLS-DA得分图
2.2 两组样品差异代谢物的筛选与鉴定结果
根据OPLS-DA模型得到的VIP值初步筛选出对两组有分类识别能力的代谢物,然后对VIP>1的代谢物进行单因素方差分析,再筛选出P<0.05、差异倍数(fold change, FC)>1.5或FC<0.67的差异代谢物,共筛选出18种满足条件的差异代谢物,见表1。然后使用MetaboAnalyst 5.0(http://www.metaboanalyst.ca)对这18种候选代谢物进行聚类分析,由图3可知,除个别样品外,A、B两组样品基本上呈分离趋势。进一步采用Origin8.0软件中的ROC曲线筛选出8种AUC>0.8的代谢物,每种代谢物的AUC值见表1。
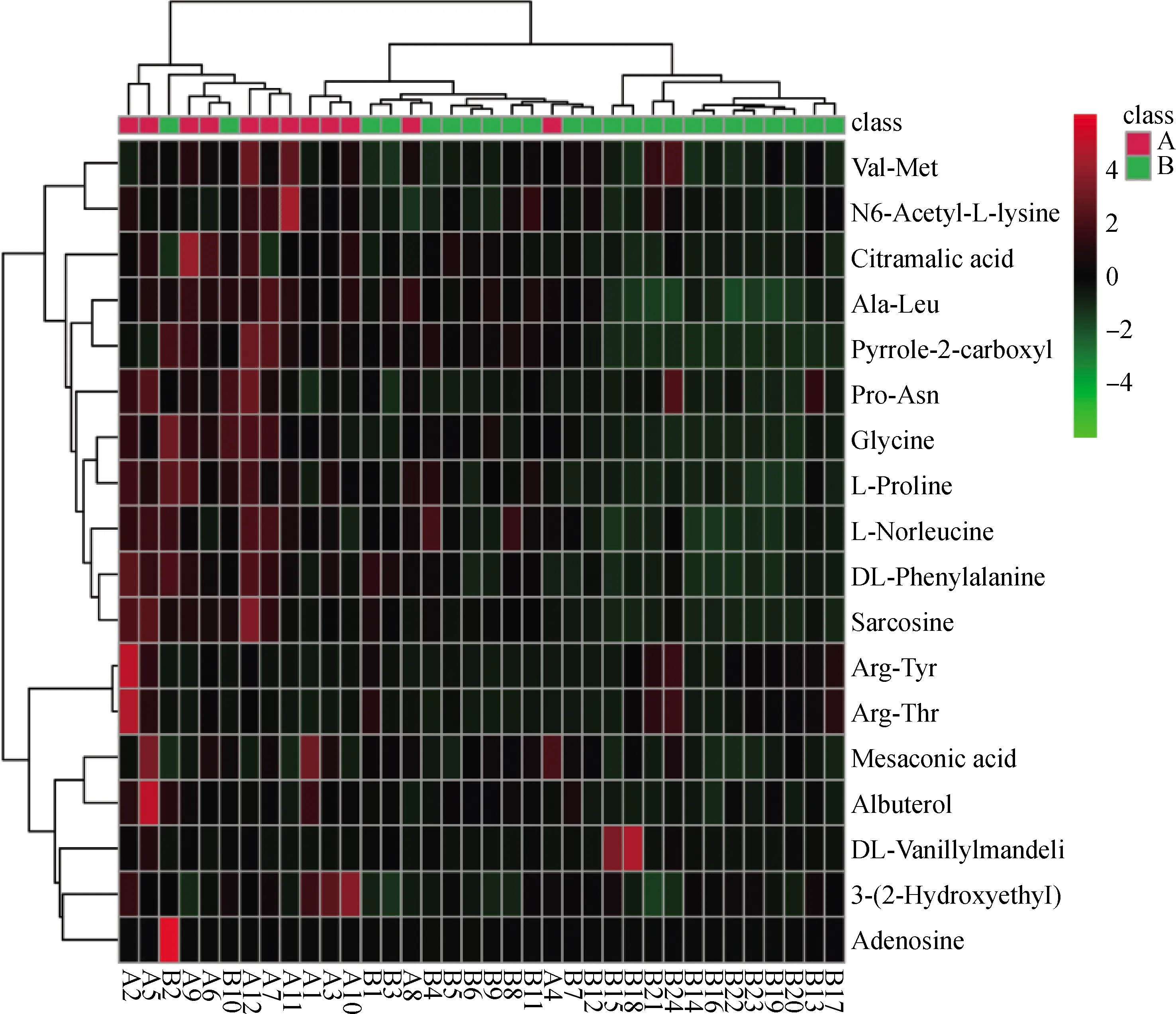
图3 人工授精后第17天A、B两组代谢物聚类分析热图

表1 已鉴定差异代谢物
3 讨 论
有研究报道,妊娠母牛的胚胎植入前组织液中均发现甘氨酸浓度升高,并显著高于其它氨基酸[13]。甘氨酸是妊娠期间DNA甲基化和蛋白质合成所必需的一碳来源[14]。随着妊娠时间增长,甘氨酸由母体不断向孕体供给,以满足胚胎细胞分裂和生长发育的需求[15-16]。此外,甘氨酸还是天然的渗透压调节剂,当细胞被渗透压胁迫时,甘氨酸能对细胞起到保护作用。维持细胞形态和功能,减轻渗透压的损伤,使细胞在不利的环境条件下仍然能够正常生长和增殖[17]。由于早期胚胎在输卵管内需要积累大量的甘氨酸来维持渗透压,因此甘氨酸对维持早期胚胎渗透压和胚胎体积正常有重要的调节作用,它能够避免渗透压变化导致的发育停滞现象,目前甘氨酸已是早期胚胎体外培养液中创造类似体内输卵管环境的重要成分之一[18-19]。因此,甘氨酸对早期胚胎发育至关重要,随着妊娠进行,胚胎对甘氨酸的需求量不断增加。本研究发现授精第17天血浆中妊娠组的甘氨酸含量显著高于未妊娠返情组,这可能是由于母体妊娠需要大量的甘氨酸来满足胚胎发育所致。
脯氨酸是合成蛋白质、精氨酸和多胺(精胺、亚精胺和腐胺)的功能性氨基酸之一。通过激活mTOR信号通路促进孕体蛋白质合成和胚胎干细胞分化[20]。脯氨酸是DNA合成、细胞增殖和分化的关键调控因子,参与妊娠猪和绵羊的胎盘发育[21]。脯氨酸在鸟氨酸脱羧酶、鸟氨酸转氨酶和脯氨酸氧化酶的作用下合成多胺[22],参与调节妊娠期间蛋白质的合成以及多胺和一氧化氮的水平[23]。有研究表明,胎盘中的多胺和一氧化氮水平在妊娠初期达到最高[24],而且胎盘发育与羊水中脯氨酸和多胺的浓度呈正相关,也就是说,脯氨酸和多胺水平越高,越有利于胎盘发育[25]。说明脯氨酸在胎盘生长发育中起重要作用。本研究也得到一样的结果,即第17天妊娠组脯氨酸的含量显著高于未妊娠返情组,说明妊娠早期需要大量的脯氨酸和多胺来促进胎盘形成和发育。因此,妊娠期间补充脯氨酸可以改善多胺的合成,促进胚胎发育和生长。
肌氨酸是一种天然存在的氨基酸化合物,在骨骼肌、大脑和睾丸中均有存在。它主要参与机体能量代谢,并且还可以作为妊娠期间的能量缓冲剂,保护胚胎大脑免受缺氧缺血的伤害[26]。妊娠期间母体处于一种高强度的代谢状态,母体需要充足的营养和氧气为胎盘发育提供良好的条件。肌氨酸通过肌酸转运蛋白主动转运到组织中,并且大部分在细胞内被磷酸化为磷酸肌酸,在能量需求高的组织中将二磷酸腺苷再生为三磷酸腺苷(ATP),维持ATP的可用性[27-28]。子宫血流量减少导致胎盘供血不足会严重影响胎盘内ATP的稳态,会诱发胚胎生长受限等一系列疾病[29]。肌氨酸和肌酸激酶之间的相互转化是无氧条件下产生ATP的方法[30]。胎盘的肌氨酸需求一直依靠母体供给直到妊娠晚期[31],妊娠后期给母体补充肌氨酸不但可以改善胚胎存活率,而且还能防止器官受损[32-33]。在妊娠期间外源性的补充肌氨酸能够保护胎儿大脑免受因缺氧缺血、兴奋性中毒或氧化应激等相关伤害,并且不会对胚胎或母体造成伤害[34]。因此,妊娠期间补充肌氨酸更有利于胎盘保持代谢稳态,确保胚胎健康发育。本研究发现,人工授精第17天的妊娠组肌氨酸含量显著高于未妊娠返情组,这可能与早期胚胎发育密切相关。
缬氨酸是支链氨基酸中运输效率最高的一种机体必需氨基酸,它在调节蛋白合成、细胞增殖和信号通路激活等方面发挥重要作用[35]。有研究报道,母猪从妊娠到分娩,机体对乳腺蛋白的需求逐渐增加[36]。缬氨酸可以经过转氨基作用和氧化脱羧脱氢后进入三羧酸循环提供能量,并为乳腺合成乳蛋白提供底物[37]。也可衍生成谷氨酸,被酰胺化或者转胺化生成谷氨酰胺,合成丙氨酸、天门冬氨酸、天冬酰胺、脯氨酸和多胺[38]。而谷氨酰胺和多胺是胎盘生长发育和血管形成的必需物质,它们不但是组织蛋白的基本成分,而且还能刺激DNA的合成,促进胎盘中的血管生长,进而改善胚胎存活与发育[39]。而本研究发现,授精后第17天妊娠组中缬氨酸-蛋氨酸的含量显著高于未妊娠返情组,这可能与早期胎盘血管形成和生长发育有关。
4 结 论
本试验运用UHPLC-QTOF-MS代谢组学方法对人工授精后第17天妊娠组和未妊娠返情组奶牛血浆代谢物及变化趋势进行研究。丙氨酸-亮氨酸、甘氨酸、脯氨酸、L-正亮氨酸、DL-苯丙氨酸、肌氨酸、吡咯-2-羧酸和缬氨酸-蛋氨酸8种代谢物有望成为妊娠早期识别奶牛妊娠状态的候选生物标志物。

