太行鸡FST基因克隆、序列特征及表达分析
张贝贝,李梦霄,马腾壑,2*,李雪男,魏佳荣,康国磊,王红娜,刘 超,王 斌,孙研研
(1.河北工程大学生命科学与食品工程学院,邯郸 056038;2.河北工程大学医学院,邯郸 056038;3.河北天凯食品有限责任公司,沙河 054100;4.中国农业科学院北京畜牧兽医研究所 农业部动物遗传育种与繁殖(家禽)重点实验室,北京 100193)
卵泡抑素(follistatin,FST)于1987年被Ueno 等[1]首次从卵巢卵泡液中发现,并证明其能抑制垂体前叶的卵泡刺激素分泌。FST以糖蛋白的形式广泛存在于血清和组织,被认为是转化生长因子β超家族成员的天然抑制剂,其存在形式为单体多肽,可产生分子量为31~42 ku的生物活性蛋白,包括肌肉生长抑素和激活素[2-4]。大量研究表明,FST在哺乳动物的组织和器官中广泛表达,如卵巢、皮肤和骨骼肌[5-6],FST是卵巢颗粒细胞的特异性基因之一,已被确定为小鼠早孕建立所必需的基因,可能在卵泡发生及黄体形成过程中起作用[7-10]。Qin等[11]通过对鸡卵泡发育过程的研究表明FOXL2与激活素A、GDF9或FST共同参与FSHRmRNA表达和颗粒细胞增殖的复杂机制。另外,Wasti等[12]发现,FST在蛋鸡子宫组织的腔和腺上皮中表达,且对蛋壳矿化产生影响。FST序列已经在绵羊、猪、马及鱼中被克隆,并利用表达载体研究了其功能。何新等[13]克隆了猪FSTcDNA,获得了完整的猪FSTcDNA编码序列,获得63 ku的蛋白表达载体,并表明其在大肠杆菌中以谷胱甘肽-S-转移酶(GST)融合蛋白的形式表达卵泡抑素蛋白。Pang等[14]克隆了鲢鱼的FST基因(HynFST),并进行了序列分析,发现HynFSTcDNA含有一个2 134 bp的ORF片段,编码349个氨基酸,HynFST在大多数发育阶段和各种组织中均有表达,并在卵巢表达水平最高。Yang等[15]克隆并分析了大黄鱼FST基因5′侧翼区的部分序列。Ni等[16]克隆了葡萄牙牡蛎FST的全长cDNA,共1 297 bp,编码241个氨基酸,证明FST可能通过自分泌信号在牡蛎卵巢发育中发挥重要作用。张宁等[17]从绵羊卵巢RNA中扩增出1 038 bp的FST全长cDNA序列,并通过SDS-PAGE和Western blotting检测到66 ku的FSTcDNA表达产物。另外,有研究人员从马卵巢cDNA文库中分离到编码马FST的cDNA克隆,表明FST在马不同组织中均有表达,且对维持妊娠有重要作用[18]。虽已证明FST在多种生物的不同组织器官中发挥作用,更是卵巢发育所必须的基因[19],然而,目前尚没有关于鸡FST基因序列信息和功能的研究报道。
太行鸡是河北省首个通过国家畜禽遗传资源委员会认定的地方品种,蛋肉品质优良,但产蛋量较低。本试验以太行鸡为研究对象,克隆FST基因序列,运用生物信息学软件预测基因功能,并在此基础上通过实时荧光定量PCR技术研究该基因在各个组织及不同发育阶段卵泡的表达水平,以期为进一步探究FST基因的调控功能、改善地方品种太行鸡的产蛋性能提供理论依据。
1 材料与方法
1.1 试验动物
试验动物选自河北天凯食品有限责任公司太行鸡保种基地,选用相同的饲粮水平和饲养条件下进行单笼饲养的43周龄麻羽太行母鸡。
1.2 试剂
PCR反应相关试剂、反转录试剂盒及荧光定量试剂盒均由江苏诺唯赞生物科技股份有限公司生产,pMD19-T Vector 由TaKaRa Bio公司生产,RNA提取试剂盒由北京艾德莱生物科技有限公司生产,氨苄青霉素由北京索莱宝科技有限公司生产,大肠杆菌DH5α感受态细胞由上海生工生物工程(上海)股份有限公司生产,质粒小提取试剂盒由天根生化科技(北京)有限公司生产。
1.3 方法
1.3.1 引物的设计合成 根据NCBI 网站原鸡(Gallusgallus)FST基因(NM_205200.1)的CDS序列,用Primer Primer 5.0软件设计编码区扩增引物。上游引物P1-F:5′-ATGTTAAATCAGAGGATCCACCC-3′;下游引物 P1-R:5′-ACCACTCTAGAATGGAAGATATAGGA-3′。引物由上海生工生物股份有限公司合成。荧光定量PCR引物P2-F: 5′-CTTATCCGAGCGAGTGTGCCATG-3′; P2-R: 5′-TCCTCTTCTTCCTCTGGGTCTTCG-3′,由苏州金唯智生物科技有限公司合成。
1.3.2 组织总RNA的提取及cDNA合成 选择5只健康的太行鸡(43周龄),颈静脉采血,在屠宰后快速采集心、肝、脾、肺、肾、肌肉、卵巢样品,参照郭晓莉[20]文中所述,分离卵巢中小白卵泡(small white follicles, SWF,直径<3 mm)、大白卵泡(large white follicles, LWF, 直径3~5 mm)、小黄卵泡(small yellow follicles, SYF, 直径6~8 mm)和大黄卵泡(large yellow follicles, LYF, 直径9~12 mm)及等级卵泡:F6、F5、F4、F3、F2和F1卵泡。将采集到的所有组织用液氮冷冻后,置于-80 ℃保存,备用。
采用RNA提取试剂盒提取所采集太行鸡组织的总RNA,提取完成后使用超微量分光光度计及凝胶电泳技术检测RNA的浓度及完整性,利用HiFi Script gDNA Removal cDNA Synthesis Kit(康为世纪,中国)将得到的总RNA进行反转录,合成cDNA 第一链。反转录总体系为 20 μL:RNA模板1 μL,10×gDNA Eraser Buffer 1 μL,gDNA Eraser 0.5 μL,DEPC-ddH2O 12.5 μL,5×Script RT Buffer 4 μL,HiFi Script(200 U·μL-1)0.5 μL,Primer Mix(10 μmol·L-1)0.5 μL。反应程序:42 ℃ 孵育15 min,85 ℃ 灭活5 min。将cDNA模板放到-20 ℃冰箱保存,备用。
1.3.3FST基因PCR扩增、克隆测序 以合成的 cDNA 第一链为模板,进行PCR扩增。反应体系为:cDNA模板1 μL,上、下游引物各0.5 μL,2×Taq Plus Master MixII 10 μL,ddH2O 8 μL。扩增反应程序为:94 ℃预变性 2 min;94 ℃变性30 s,61 ℃ 退火30 s,72 ℃延伸1 min,32个循环;最后72 ℃延伸10 min,4 ℃保存。扩增产物经过 1.0%琼脂糖凝胶电泳检测。
PCR产物直接与pMD19-T Vector载体4 ℃恒温连接过夜,利用热激法转至大肠杆菌 DH5α感受态细胞,铺板挑单克隆培养,根据菌液PCR产物大小验证载体连接情况,菌液送至生工生物工程(上海)股份有限公司测序。测序结果用SeqMan软件比对拼接,获得太行鸡FST基因完整的CDS序列。
1.3.4FST基因的生物信息学分析FST基因的电子翻译采用DNAstar软件的Editseq工具完成。利用NCBI中的ORF Finder程序寻找FST完整开放阅读框;将测序获得的太行鸡FST基因CDS区的氨基酸序列与日本鹌鹑(NP_001310120.1)、盔珠鸡(XP_021236409.1)、虎皮鹦鹉(XP_005152012.1)、猎隼(XP_005443976.1)、黑胸山蜂鸟(NXU70976.1)、大杜鹃(XP_009554129.1)、野鸽(XP_005500938.1)、几维鸟(XP_025918523.1)、白腰文鸟(XP_021409534.1)、金丝雀(XP_030093406.1)和白喉雀(XP_005490721.1)的FST基因序列进行同源性分析。利用在线软件(https://web.expasy.org/protparam/)对FST蛋白理化性质进行预测,利用Expasy-Protscale软件预测FST蛋白的亲疏水性,使用SignalP 5.0软件预测FST蛋白的信号肽,采用NetNGlyc 1.0 Server预测FST的N-糖基化位点和O-糖基化位点,用NetPhos 3.1 Server 软件预测太行鸡FST的磷酸化位点;运用在线分析软件TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测其跨膜区结构,利用在线服务器ExPASy中的PSORT Prediction程序进行亚细胞定位预测;利用NCBI CD的CD-Search工具对FST蛋白进行蛋白保守域预测;使用NPSA预测蛋白的二级结构;利用SWISS-MODEL(https://swissmodel.expasy.org/)平台预测蛋白质的三级结构。
1.3.5FST基因实时荧光定量PCR表达分析 以太行鸡心、肝、脾、肺、肾、卵巢和肌肉7种组织及不同时期卵泡的cDNA为模板,P2-F/R为引物,GAPDH为内参,采用SYBR Green I 染料法实时荧光定量PCR检测,对FST基因在不同组织及不同发育时期卵泡中的表达量进行分析。RT-qPCR反应总体系为20 μL:上、下游引物各0.5 μL,SYBR qPCR Mix 10 μL,ddH2O 8 μL,模板1 μL。PCR反应条件:95 ℃ 10 min;95 ℃ 10 s,60 ℃ 30 s,72 ℃ 32 s,共40个循环。每个样品重复3次。反应结束后,分析熔解曲线,检测引物特异性。
1.4 数据分析
通过2-△△Ct法[21]计算太行鸡不同组织中FST基因的相对表达量,以GAPDH为内参,分别以肝和卵巢组织中的表达量为对照,用SPSS 20.0软件中的一般线性模型分析不同组织及发育时期卵泡中基因的表达量差异,以P<0.05表示数据差异显著。
2 结 果
2.1 FST基因的克隆
以cDNA为模板PCR扩增FST基因,用1.0%琼脂糖凝胶电泳进行检测,结果见图1。扩增产物条带单一、清晰,片段大小与预期结果相符。将PCR产物克隆到pMD-19T载体,筛选阳性质粒,菌液PCR验证,得到片段大小与预期一致(图2),测序结果证实其编码区序列长度为1 032 bp,大小与预期一致。
图1 太行鸡FST基因PCR产物电泳结果
图2 pMD-19T-FST菌液PCR产物电泳结果
2.2 FST蛋白的生物信息学分析
2.2.1 FST同源性比对分析 序列分析发现,在104~1 135 bp处存在完整开放阅读框,长为1 032 bp,编码343个氨基酸。测序结果同NCBI发表的基因序列进行氨基酸同源性比对分析表明,太行鸡FST基因与原鸡基因(登录号:NP_990531.1)氨基酸序列同源性为100.0%,与日本鹌鹑FST的同源性为99.7%,与盔珠鸡同源性为99.4%,与虎皮鹦鹉和猎隼同源性为98.3%,与黑胸山蜂鸟和大杜鹃同源性为98.0%,野鸽和几维鸟同源性为97.7%,与白腰文鸟、金丝雀和白喉雀同源性为97.4%(图3)。

图3 不同物种间FST基因编码氨基酸同源性分析
2.2.2 基因系统进化树的构建 采用NJ(neighor-jioning)法,通过Mega7.0 软件构建FST蛋白的系统进化树,设定为Kimura2-parameter model,重复次数1 000次,结果如4图,太行鸡与原鸡、日本鹌鹑、盔珠鸡先聚在一起,再与几维鸟聚在一起,然后与大杜鹃聚在一起,再与野鸽聚在一起。表明太行鸡与原鸡、日本鹌鹑、盔珠鸡的亲缘关系最接近。

图4 太行鸡FST系统发育树分析
2.2.3 氨基酸序列理化性质分析 利用在线网站ExPASy(https://web.expasy.org/protparam/)分析太行鸡FST蛋白理化性质,蛋白的分子式为C1619H2567N459O520S44,蛋白的分子量为38.192 6 ku,共编码343个氨基酸,理论等电点为5.59,其中含量较高的氨基酸有Cys(C)(10.50%)、Glu(E)(8.50%)和Lys(K)(8.20%),含量较少的是His(H)(1.50%);带正电荷的残基总数(精氨酸+赖氨酸)(Arg + Lys)42个,带负电的残基总数(天冬氨酸+谷氨酸)(Asp + Glu)48个。半衰期为:在哺乳动物网织红细胞体外表达为30 h;在酵母体内表达为20 h以上;在大肠杆菌体内表达为10 h以上。其不稳定系数为42.76,证明其为不稳定蛋白。
2.2.4 蛋白疏水性和跨膜结构域分析 亲疏水性分析表明,FST蛋白的亲水性氨基酸多于疏水性氨基酸。预测FST蛋白的总平均亲水性(Grand average of hydropathicity,GRAVY)为-0.498,由于GRAVY值的范围为-2~2,正值表明此蛋白为疏水蛋白,负值表明为亲水蛋白,所以FST蛋白为亲水蛋白(图5)。

图5 太行鸡FST蛋白疏水性分析
运用在线分析软件 TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测其跨膜区结构,显示该蛋白无跨膜结构(图6)。
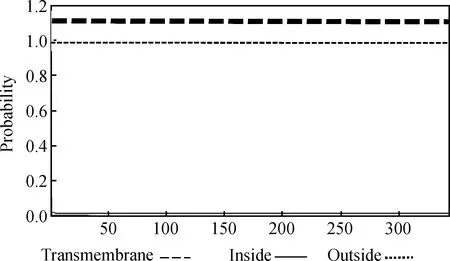
图6 太行鸡FST蛋白跨膜结构预测
2.2.5 蛋白质信号肽和糖基化位点分析 采用在线软件SignalP 5.0预测FST蛋白潜在的信号肽,其Sec信号肽(Sec/SPI)概率分值为0.995 5(图7),表明太行鸡FST蛋白存在Sec信号肽。

图7 太行鸡FST蛋白信号肽
FST蛋白N-糖基化位点和O-糖基化位点预测结果显示,第123和287位氨基酸处存在潜在的N-糖基化位点(图8)。潜力值分别为0.644 0、0.516 4,均大于阈值0.5。另外,在57、61、65、176、183、199、285、314、327处发现了O-糖基化位点。

图8 太行鸡FST蛋白N-糖基化位点
2.2.6 蛋白质磷酸化位点分析 FST蛋白存在46个潜在的磷酸位点,分别为第21个丝氨酸、15个苏氨酸和10个酪氨酸磷酸化位点,潜力值均大于0.5(图9)。

图9 太行鸡FST蛋白磷酸化位点
2.2.7 蛋白质亚细胞定位预测 利用在线服务器 PSORT WWW Server中的PSORT II Prediction程序进行亚细胞定位预测,K/NN预测结果显示,太行鸡FST蛋白主要定位于细胞核(52.2%),其他定位于线粒体(26.1%)、细胞质(4.3%)、液泡(4.3%)、细胞骨架(4.3%)和细胞外(包括细胞壁)(8.7%)。
2.2.8 蛋白质保守结构域预测 利用在线软件HMME R预测发现,太行鸡FST蛋白在93~116、166~189、243~267 位3处氨基酸片段间均存在1个 卵泡抑素-N-末端结构域样(FOLN 结构域),在116~163、190~238、268~315 位3处氨基酸片段间均存在1个Kazal型丝氨酸蛋白酶抑制剂结构域(KAZAL_FS 结构域),预测太行鸡FST蛋白与SNN、INHBA、MSTN、BMP4等蛋白质相互作用,结果如图10所示。

A.FST蛋白保守结构域示意图;B.预测FST蛋白互作网络图
2.2.9 蛋白质二级结构预测 使用在线软件NPS@:NetworkProteinSequenceAnalysis对太行鸡FST蛋白二级结构进行分析(图11),56个氨基酸参与α-螺旋,占比为16.33%;57个氨基酸参与氨基酸残基构成的延伸链,占比为16.62%;18个氨基酸参与β转角,占比为5.25%,212个氨基酸参与无规卷曲,占比为61.81%。由此说明,在太行鸡FST蛋白二级结构中,无规卷曲是主要的结构形式。

图11 太行鸡FST蛋白二级结构
2.2.10 蛋白质的三级结构预测 利用在线软件SWISS-MODEL的自动建模功能,对太行鸡FST蛋白三级结构进行预测,三维模型见图12。用于建立该模型的氨基酸残基范围为29~326位,该模型以5jhw.1(Crystal Structure of the GDF11:Follistatin288 complex)蛋白为模板,序列同源性为93.06%。

图12 太行鸡FST蛋白三级结构
2.3 太行鸡FST基因在不同组织和发育时期的表达
2.3.1FST基因在不同组织中的表达 如图13所示,FST基因在心、肝、脾、肺、肾、肌肉及卵巢中均有表达,且在各组织中的表达量存在显著差异(P<0.05)。FST在肝中表达最丰富,其次是脾、肺和肾,在心、卵巢和胸肌表达水平较低。统计分析表明,FST基因在肝与脾组织中表达量无显著差异(P>0.05),但显著高于卵巢、心、肺、肾和胸肌(P<0.05)。

相同字母表示无显著性差异(P>0.05),不同字母表示存在显著差异(P<0.05),下同
2.3.2FST基因在不同发育阶段卵泡中的表达FST基因在卵巢中的表达量较低,卵泡发育至大白卵泡(3~5 mm)过程中呈上升趋势,并达到峰值;之后呈现下降趋势,在小黄卵泡(6~8 mm)向大黄卵泡(9~12 mm)发育过程中表达量明显减少,并存在1.6倍差异(小黄卵泡平均差异倍数:22.03;大黄卵泡平均差异倍数:13.75)。在F5卵泡中小幅度升高后,在F4~F1发育过程中一直维持在相对较低的水平。统计分析表明,FST基因在大白卵泡中的表达量显著高于其它发育时期卵泡(P<0.05);另外,该基因在卵泡选择前的小黄卵泡中表达水平与F3~F1阶段存在显著差异(P<0.05)(图14)。

SWF.小白卵泡;LWF.大白卵泡;SYF.小黄卵泡;LYF.大黄卵泡。等级卵泡由小到大依次为F6~F1表示
3 讨 论
太行鸡是国家畜禽遗传资源委员会审定的第一个河北省地方家禽品种。其鸡蛋品质好,耐粗饲[22],但产蛋性能低,500天产蛋数为160~180枚,影响规模化养殖效益,故在育种中着重研究如何提高其产蛋性能具有重要理论和现实意义。本试验以太行鸡为研究对象,成功获得FST基因外显子克隆拼接后的完整CDS区序列,对该序列结构特征进行生物信息学分析,得到FST基因CDS区片段长度1 032 bp,编码343个氨基酸,该结果与Connolly等[23]在雏鸡中的研究结果相同,另外,刘贺贺等[24]在鸭中同样克隆出1 032 bpFST基因CDS区,但与其它物种该基因开放阅读框并不相同。通过构建系统发育树及同源性分析,表明太行鸡FST基因与日本鹌鹑和盔珠鸡的同源性较高(>99%),与野鸽等其他鸟类同源性在95%以内,说明该基因在鸟类中高度保守,可能发挥相似的功能。
Jiao等[25]和Luo等[26]通过免疫组织化学分析证实了猪的骨骼肌、脂肪组织、心肌、肝、脾、肺和肾中均有FST基因表达。这与本研究相似,本试验证明,FST基因在太行鸡各组织中均有表达,其中在肝、脾、肾中高表达。已有研究显示,FST可诱导完整的肝细胞增殖[27],FST体外和体内试验均显示,该基因可独立于其激活素发挥中和作用,通过中和活性氧和抑制氧化应激来保护TG诱导的细胞凋亡[28]。虽然本试验中FST基因在心和肌肉中的表达量不高,但大量研究显示,该基因在心及肌肉组织中发挥着重要作用,Van Den Berg等[29]指出,FST在发育中瓣膜上覆盖的心内膜高度定位表达,表明其在瓣膜形成中发挥作用。此外,FST在肌肉发生过程中发挥重要作用[30]。过表达FST的转基因虹鳟鱼表现出肌肉发达的现象[31],更有研究指出,FST有可能成为促进农业动物骨骼肌生长和治疗人类骨骼肌萎缩性疾病的潜在药物[32],但是本研究中FST在肌肉中的表达量不高,这可能是由于物种间的差异,也可能是由于所选时期不是肌肉发育高峰期造成的。
虽然FST基因在太行鸡卵巢组织中表达量较低,但其在卵巢中发挥的重要作用不容忽视。目前的研究表明,在成年卵巢中,垂体FSH通过与其受体(FSHR)相互作用是卵泡发育、颗粒细胞增殖和分化所必需的[33-34]。Xu等[35]对牦牛在非繁殖季节卵巢组织中FST的表达分析显示,其表达量显著降低(P<0.05);Li等[36]研究了FST在促进猪早期胚胎发育中的作用,发现不同FST亚型产生效果并不相同,FST-300可以促进初始卵裂时间并提高胚泡形成率,而FST-315可以提高胚泡质量。FST是卵泡发育中不同阶段卵泡分化的关键介质之一;可通过调节FSH的分泌和啮齿动物性腺的活动、雄激素的产生和妊娠,在生殖过程中发挥作用[37]。鉴于FST基因在卵泡发育过程中的重要作用,本研究对太行鸡不同发育时期卵泡中FST的表达进行研究,结果显示,在大白卵泡(LWF)中表达量最高,且在卵泡选择前后的小黄卵泡、大黄卵泡中表达量有1.6倍的差异。Qin等[38]在马岗鹅中的研究提到,血液中抑制素和卵泡抑素的持续存在可能会抑制马岗鹅产蛋后新的SYF重新进入排卵前的LYF发育。此外,在产卵过程中,一些大量存在于血液循环中的激素,由于抑制素和FST抵消了激活素从而促进小卵泡发育[39]。Moros-Nicols等[40]研究显示,FST在猪小卵泡(<3 mm)的卵母细胞和周围卵丘细胞(CCS)的转录丰度高于中等卵泡(3~6 mm)CCS;但Costermans等[41]提出,FST在不同大小直径卵泡的CCS中转录丰度无显著差异。Owens等[42]发现,FST在人小窦卵泡颗粒细胞(GC)表达量显著高于大的黄素化卵泡GC;Xia等[43]研究发现,在布氏母羊黄体晚期卵泡液和卵巢血中FST浓度升高,表明FST对现有功能黄体的黄体溶解和新卵泡队列的发育具有双重作用。有趣的是,在雌激素激活的牛卵泡颗粒细胞大卵泡中,FST基因互作网络上MSTN的mRNA在颗粒细胞(GC)中的表达最低,而GCFST在这一阶段的表达最高[44]。本研究显示,太行鸡FST在3~5 mm卵泡中表达量最高,且在F3~F1这一时期卵泡中稳定表达,与Qin等[11]在鸡上的研究结果基本一致,他们的研究显示,鸡FSTmRNA在4~8 mm和9~12 mm卵泡中表达水平最高。但是,Lovell等[39]在蛋鸡上的研究显示,在4~5 mm卵泡的G层未检测到FST,而在5~6 mm 的卵泡中可检测到FST,G层FST含量在小幅升高后下降,并一直维持在这一相对较低的水平至F1。通过免疫组织化学方法研究FST在大鼠组织中的定位发现,FST的表达强度随着卵泡的发育而变化,FST的表达在排卵前卵泡的发育过程中起重要作用,但在排卵后它的表达会降低,从而形成黄体[45]。本研究得到的结果与前人结果部分一致,验证了FST基因在太行鸡不同发育时期卵泡中的表达差异,推测该基因在太行鸡产蛋过程中发挥着重要作用,进一步证明该基因对提高太行鸡产蛋量有调控作用,是研究太行鸡繁殖性能的重要候选基因之一。
4 结 论
太行鸡FST基因CDS序列全长1 032 bp,共编码343个氨基酸,该基因在禽类中高度保守。FST基因在心、肝、脾、肺、肾、肌肉、卵巢等组织中均有表达,且在肝中表达量最高。卵泡选择过程中FST表达存在1.6倍差异,表明该基因是鸡产蛋量的重要候选基因,对繁殖性能的选育提高有积极作用。

