奶牛分娩前后瘤胃代谢物变化规律及其代谢通路研究
张瑞雪,刘 欣,徐晓锋,张 博,唐玉林,任 曼,郭延生
(宁夏大学农学院,银川 750021)
围产期是奶牛生产周期中一个重要的过渡期,从妊娠晚期到泌乳初期,奶牛在生理、营养和代谢等方面经历了巨大的变化。奶牛分娩前胎儿体积增大,能量需求急剧增加,而此时瘤胃空间被严重压缩,分娩激素水平快速升高[1],导致干物质采食量急剧下降,易出现能量负平衡。而产后泌乳启动,会进一步加剧能量负平衡,脂肪大量动员,导致代谢性和炎症性疾病频发[2]。瘤胃及其微生物在反刍动物的消化代谢中占据极其重要的地位,瘤胃微生物发酵产生乙酸、丙酸和丁酸等挥发性脂肪酸为机体供能。动物体内约90%的葡萄糖是由糖异生供给的,其中50%~60%的葡萄糖是由丙酸经过肝糖异生作用生成的,因此,瘤胃代谢水平与能量负平衡密切相关。有研究指出,在分娩前后监测反刍时间是预测奶牛泌乳早期疾病的有效方法[3]。可见,研究分娩前后瘤胃代谢物的变化规律对揭示围产期奶牛的生理状态扰动、产后营养调控和疾病的预防具有十分重要的意义。目前,国内外学者采用代谢组学技术对奶牛分娩前后血液代谢物的变化进行了较为详细的研究[4-6],如 Kenéz等[5]发现,围产期奶牛血液代谢轮廓发生了明显变化,分娩前第10天甘油磷脂类和鞘脂类代谢物含量较产前40 d明显降低,而分娩后第3天这两类物质含量较产后21 d也明显降低。Luo等[6]发现,奶牛分娩后血液中32种代谢物较产前21 d显著升高,35种代谢物显著降低,上升的代谢物与脂质代谢和能量代谢有关,下降的代谢物与氨基酸代谢有关。但目前关于奶牛分娩前后瘤胃代谢物的变化尚未见相关报道,因此,本试验采用超高效液相色谱串联质谱(UPLC-MS/MS)代谢组学技术和代谢通路分析方法,研究奶牛分娩前后瘤胃小分子物质的代谢轮廓和通路的变化规律,旨在进一步揭示奶牛分娩前后的代谢状态,为围产期营养奶牛的调控和疾病预防提供一定的参考依据。
1 材料与方法
1.1 试验材料
1.1.1 试验仪器与试剂 超高效液相色谱(UPLC Shim-pack UFLC SHIMADZU CBM30A,日本岛津)、色谱柱(Waters ACQUITY UPLC HSS T3 C18 1.8 μm,2.1 mm*100 mm,美国)、离心机(Centrifuge 5424 R Eppendorf,德国)、LC-MS/MS质谱仪(6500 QTRAP UPLC SCIEX,美国)、串联质谱(Tandem mass spectrometry,MS/MS,美国)。
甲醇(Merck,德国)、乙醇(Merck,德国)、甲腈(Merck,德国)、冰甲醇(Merck,德国)、标准品(BioBioPha/Sigma-Aldrich,美国)。
1.1.2 试验动物的选择、分组与采样 在宁夏某大型集约化养殖场,选取产前7~10 d、胎次2~3次、体况评分3.2~3.5、体重(600±20)kg的健康待产荷斯坦奶牛10头,统一用TMR混合日粮饲喂(见表1),干物质采食量为(9.8±0.6)kg·d-1。分别于分娩前7~10 d(B组)晨饲前和分娩后当天未进饲前(D组)收集瘤胃液,方法是将带有金属过滤装置的采集器一端插入瘤胃,用50 mL注射器将瘤胃液吸出,弃掉第一管瘤胃液,第二管瘤胃液作为待测样品(采样前用温水充分冲洗采样器,以最大限度地减少唾液污染)。收集到的瘤胃液经4层粗棉布过滤后注入到15 mL 螺旋离心管,在4 ℃,12 000 r·min-1下离心15 min,然后取上清液于1.5 mL离心管,-80 ℃保存。产前7~10 d瘤胃液分别标记为B1、B2……B10,分娩当天瘤胃液分别标记为D1、D2……D10。
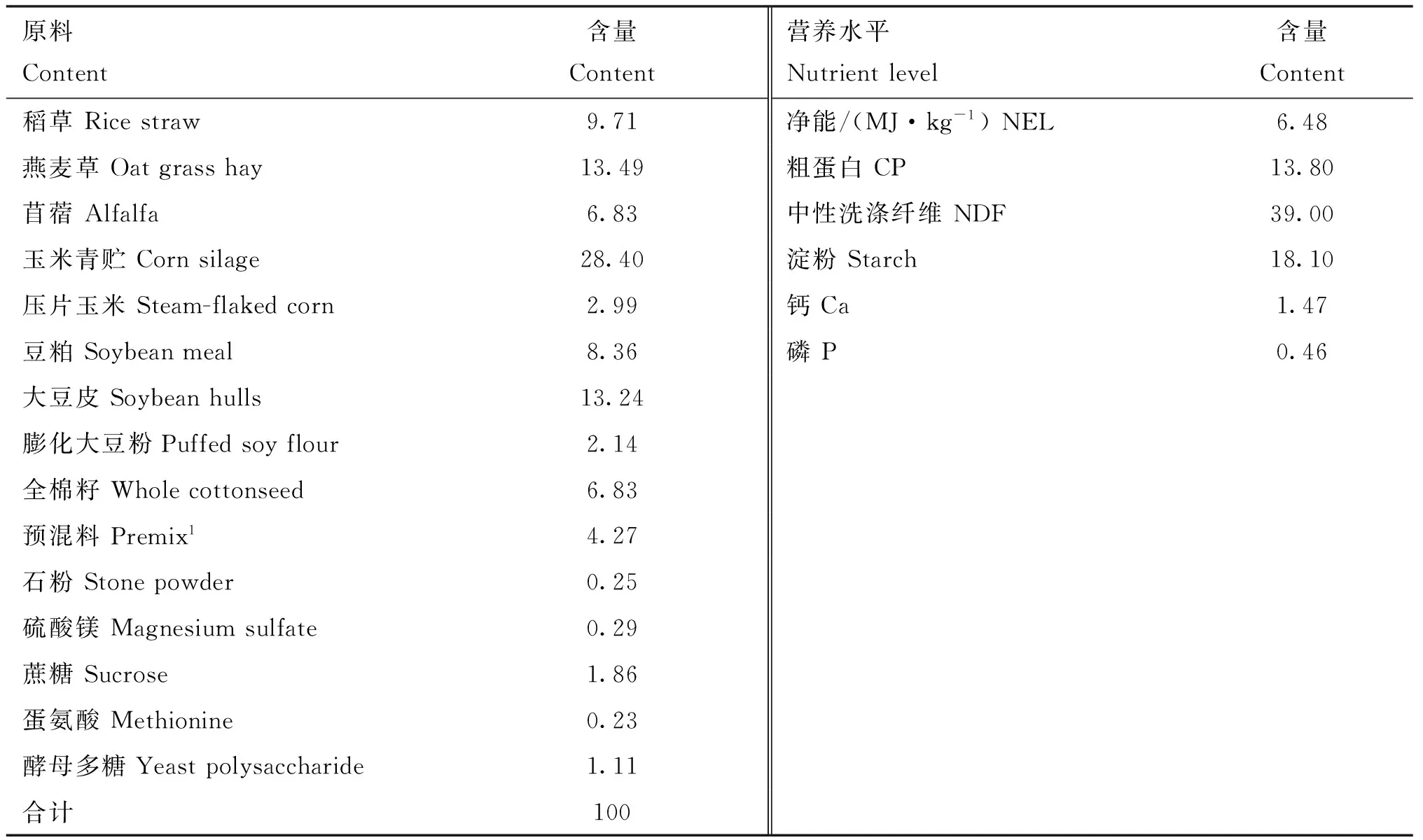
表1 奶牛产前TMR日粮配方表
1.2 试验方法
1.2.1 瘤胃液预处理 瘤胃液冰上解冻,涡旋10 s后取50 μL于EP管中,加入150 μL含1 μg·mL-1的2-氯苯丙氨酸(内标)的冰甲醇涡旋3 min,4 ℃条件下12 000 r·min-1离心10 min,吸取上清液到另一个新的EP管中,4 ℃条件下12 000 r·min-1再离心5 min,吸取上清液到进样瓶内衬管中,用UPLC-MS/MS分析。
1.2.2 UPLC-MS/MS检测条件 Waters ACQUITY UPLC HSS T3 C18色谱柱(1.8 μm, 2.1 mm*100 mm);A流动相为超纯水(0.04%的乙酸),B流动相为乙腈(0.04%的乙酸);采用梯度洗脱:0 min A/B腈(95:5(V/V)),11.0 min为5:95(V/V),12.0 min为5:95(V/V),12.1 min为95:5(V/V),14.0 min为95:5(V/V);
电喷雾离子源温度:500 ℃,离子源气体I:55 psi、气体II:60 psi,质谱电压正负极分别为:5 500 V和4 500 V,气帘气:25 psi,碰撞诱导电离参数设置为高,根据优化的碰撞能和去簇电压对每个离子进行扫描检测[7]。
1.2.3 瘤胃代谢物的定性与定量 根据保留时间RT(retention time)、子母离子对信息及二级谱数据对瘤胃代谢物进行定性分析,利用三重四极杆质谱的多反应监测模式(multiple reaction monitoring, MRM)进行定量分析[8],在获得样本液质数据后,用MultiQuant软件对所有代谢物的提取离子色谱峰分别进行峰下面积积分,并对其中同一代谢物在不同标本中的色谱峰进行积分校正,每个色谱峰的峰面积(Area)代表对应物质的相对含量。
1.2.4 数据统计与分析 采用MateboAnanlyst 5.0在线软件对UPLC-MS/MS原始数据预处理后,导入Excel建立包含代谢物编号、积分数值和代谢物名称等信息的二维数据矩阵,采用无监督模式的主成分分析(principal component analysis, PCA)考察分娩前后瘤胃代谢轮廓的变化,采用有监督模式的正交偏最小二乘判别分析(partial least squares-discriminant analysis, OPLS-DA),获得变量重要性投影(variable importance in projection, VIP)值,该值表示对应代谢物组间差异在模型中各组样本分类判别中的影响强度,大于或等于1表明代谢物在分类判别中有显著影响,选取VIP≥1的代谢物,同时结合单变量分析的差异倍数值(Fold change, FC),进一步筛选FC≥2或FC≤0.5且P<0.05 的代谢物,视为分娩前后瘤胃差异代谢物。然后采用MateboAnanlyst 5.0在线软件对差异代谢物进行通路分析。
2 结 果
2.1 奶牛分娩前后瘤胃代谢物的定性与定量分析
采用UPLC-MS/MS建立了奶牛瘤胃液MRM代谢物检测多峰图(图1),根据RT、子母离子对信息及二级谱数据从奶牛瘤胃液中鉴定出了557个代谢物,其中有机酸及其衍生物112个,氨基酸及其代谢物87个,核苷酸及其代谢物53个,碳水化合物及其代谢物36个,脂肪酸33个,磷脂11个,脂质5个,脂肪酰17个,辅酶和维生素18个,氧化脂质13个。对每个鉴定出的代谢物进行了色谱峰的积分和校正工作,每个色谱峰的峰面积代表对应物质的相对含量。
不同颜色的色谱峰代表检测到的不同代谢物,横坐标为代谢物检测的保留时间
2.2 奶牛分娩前后瘤胃代谢轮廓变化
采用PCA考察奶牛分娩前与分娩后瘤胃代谢轮廓的变化,如图2A所示,奶牛分娩前与分娩后瘤胃样品分别位于各自95%的可置信区间内,说明试验牛的体况、胎次和生理状态具有较好的一致性;与分娩前(B组)相比,分娩后(D组)奶牛瘤胃代谢轮廓发生了较大变化,说明奶牛分娩前与分娩后瘤胃内代谢物存在明显差异。
2.3 差异代谢物的筛选结果
为了进一步筛选两组瘤胃液的差异代谢物,采用有监督模式的正交偏最小二乘判别分析法(OPLS-DA)对两组瘤胃液进行建模,OPLS-DA模型得分图(图2B)显示,能够明显区分B组和D组。OPLS-DA模型评价参数Q2≥0.4和R2Y≤1时,模型被确定为稳定和可靠。本试验OPLS-DA模型验证图中R2X为0.281,R2Y为0.981,Q2为0.84,R2Y和Q2的P值均小于0.005(图3),说明所建的OPLS-DA模型对分娩前与分娩后奶牛瘤胃液具有良好的预测能力,且能明显区分两组瘤胃液。从该模型中选取VIP≥1的代谢物,视为两组瘤胃液的候选差异代谢物。然后选择单变量方差分析中的P<0.05,FC≥2或FC≤0.5的代谢物作为最终差异代谢物。结果显示,奶牛分娩后瘤胃液中34种差异代谢物相对含量明显低于分娩前,23种明显高于分娩前。代谢物的名称、VIP、FC、P值和变化趋势详见图4、表2和表3。
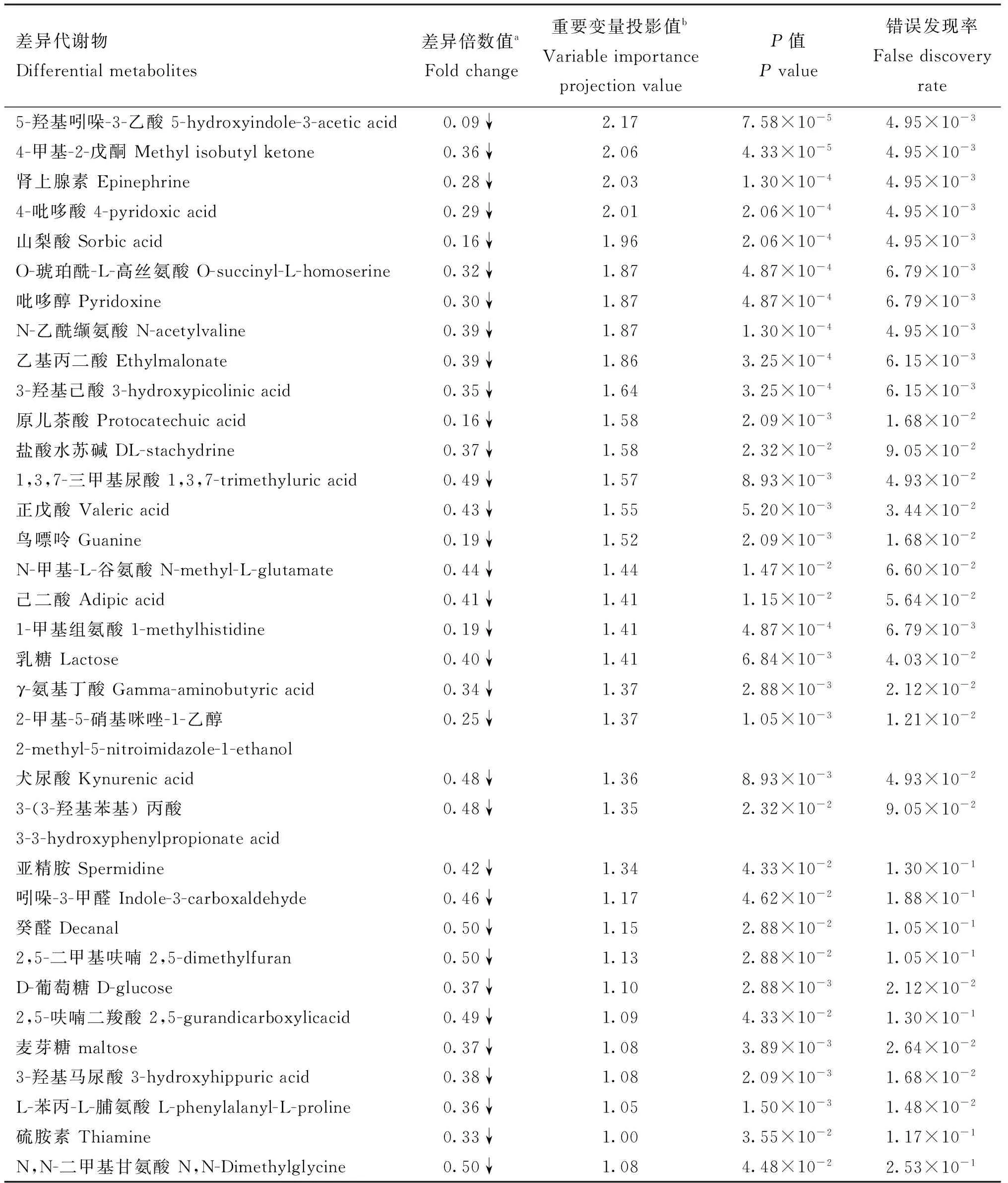
表2 奶牛分娩后表达下调的代谢物及相关参数
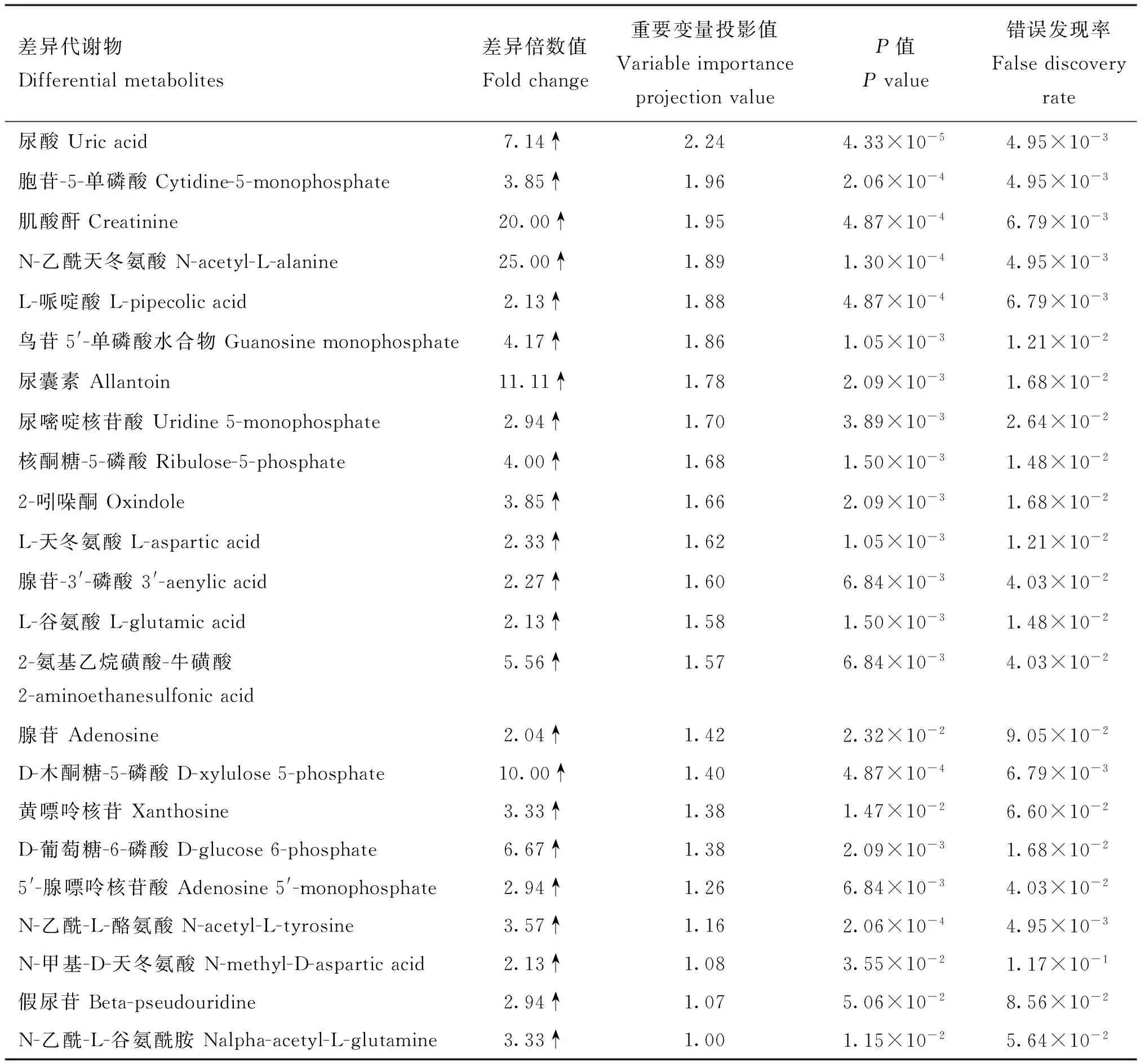
表3 奶牛分娩后表达上调的代谢物及相关参数
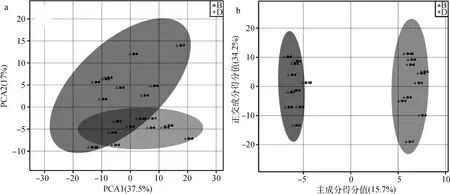
图2 分娩前(B组)对分娩后(D组)奶牛瘤胃液代谢物PCA 2D图(a)和OPLS-DA得分图(b)
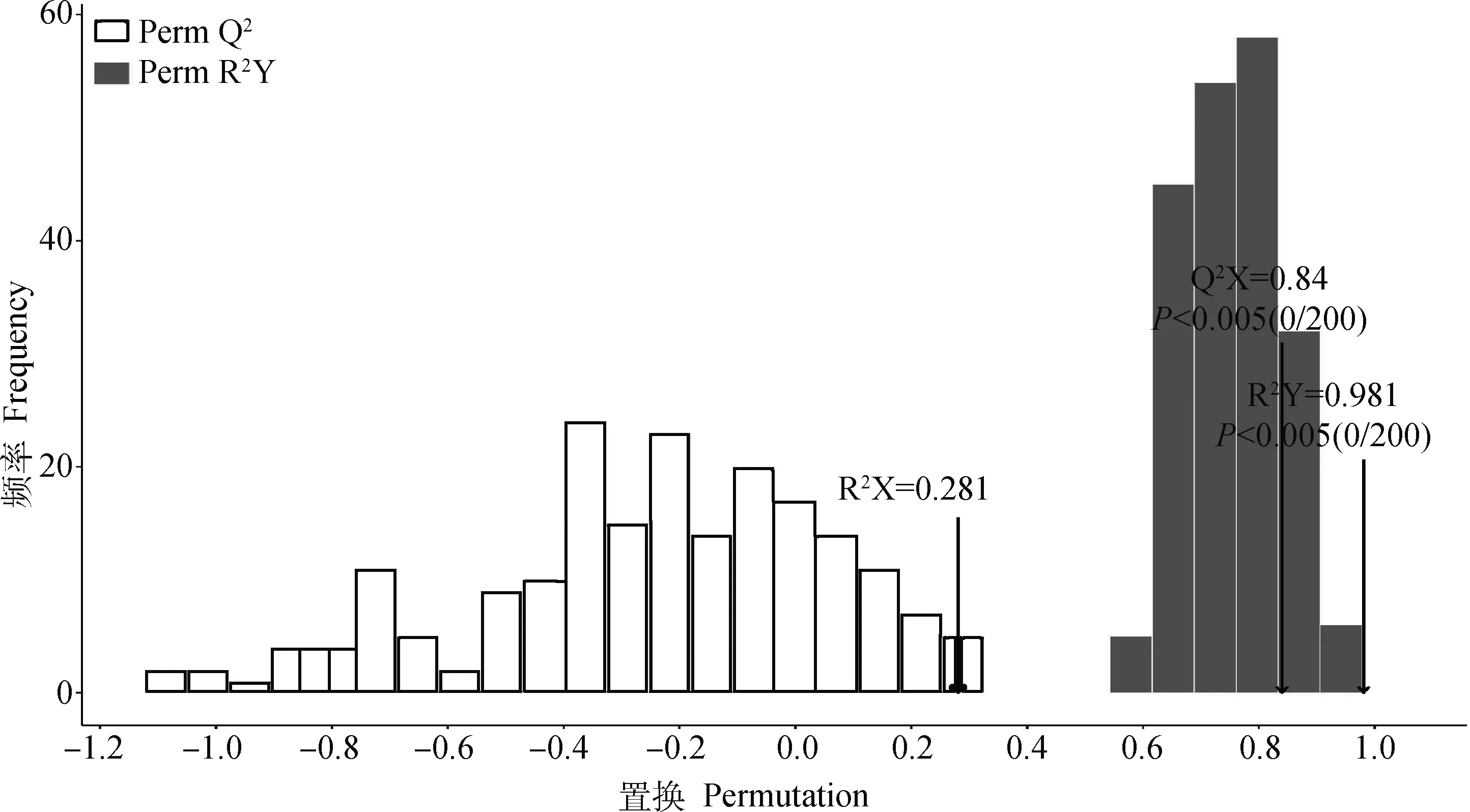
横坐标表示模型准确率,纵坐标是模型分类效果出现的频数,即本模型对数据进行200次随机排列组合试验
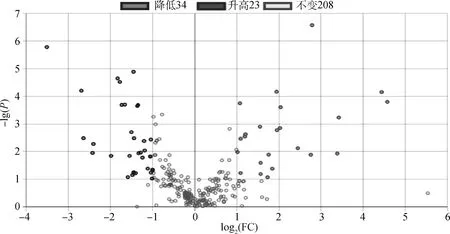
图中每一个点表示一种代谢物,横坐标表示某代谢物在两样品中FC的对数值,纵坐标表示P值的负对数值。横坐标绝对值越大,说明代谢物在两样品间的表达量倍数差异越大;纵坐标值越大,表明差异表达越显著,筛选得到的差异表达代谢物越可靠。图中绿色的点代表差异代谢物表达下调,红色的点代表上调,黑色的点代表差异不显著的代谢物
2.4 差异代谢物通路分析及验证
采用MateboAnanlyst 5.0在线软件对57个差异代谢物进行通路分析,结果显示,奶牛分娩前后有9个代谢通路发生了显著变化,包括牛磺酸和亚牛磺酸代谢、精氨酸和脯氨酸代谢、D-谷氨酰胺和D-谷氨酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢、精氨酸生物合成、淀粉和蔗糖代谢、半乳糖代谢、嘌呤代谢和维生素B6代谢(图5)。57个差异代谢物中仅有12个代谢物参与了这9个主要代谢通路(图6)。对上述12个代谢物进行聚类分析验证,结果如图7所示,这12个瘤胃差异代谢物能明显将样品聚类为B组和D组,说明筛选出的差异代谢物能够很好地区分奶牛分娩前与分娩后瘤胃液。
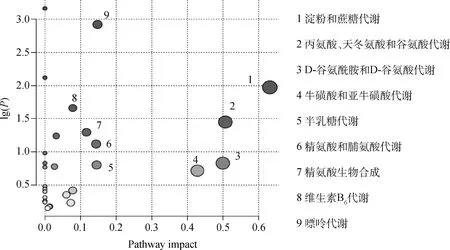
圆圈代表代谢途径。较深的圆圈表示相应路径中的代谢物发生了显著变化,而圆圈的大小表示路径影响得分
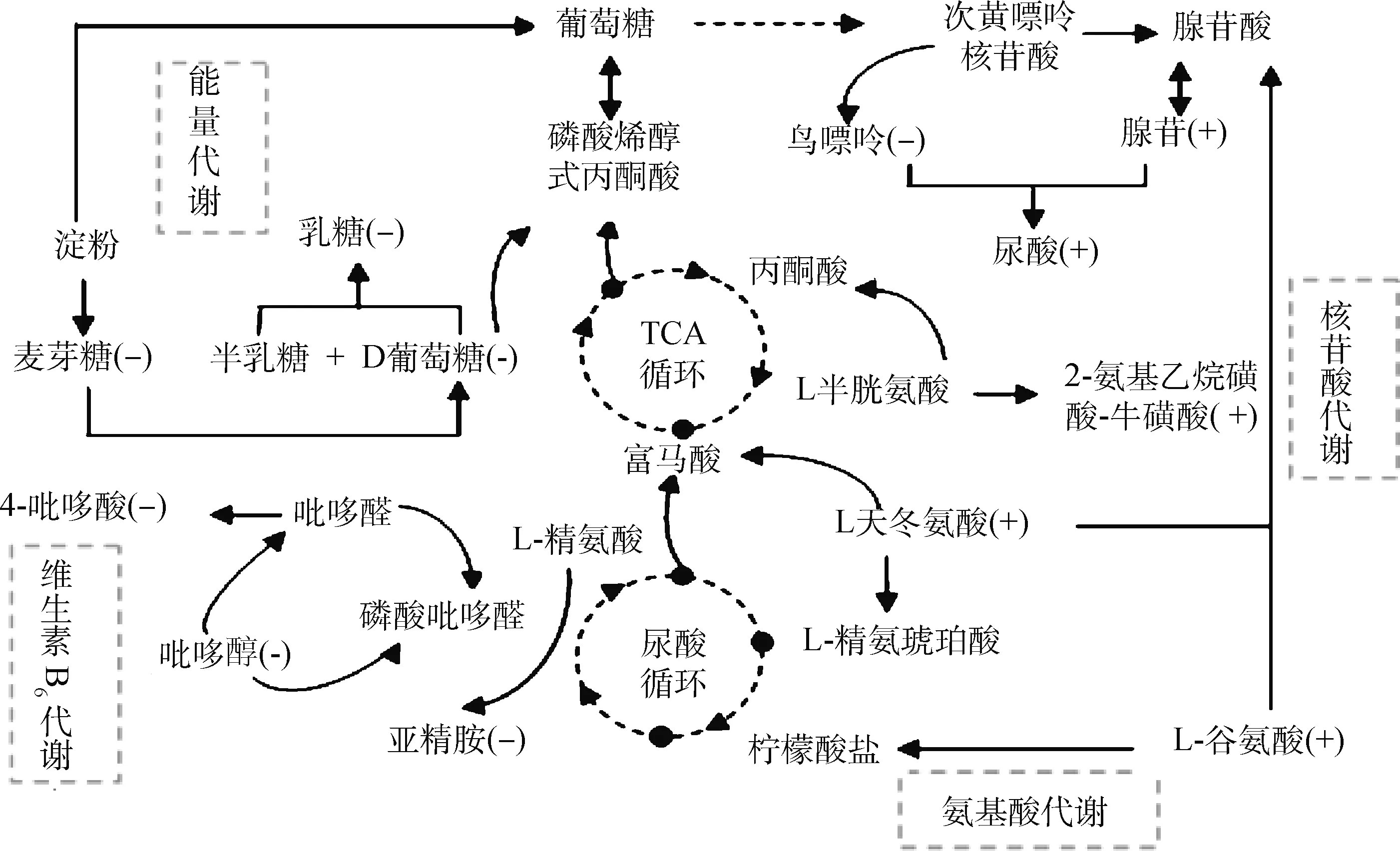
(+)表示分娩过程中代谢物浓度升高;(-)表示分娩过程中代谢物浓度降低
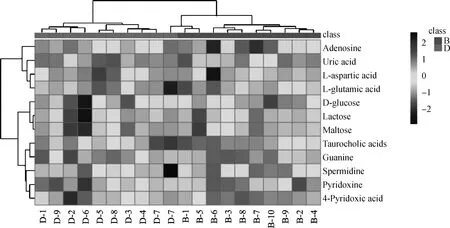
图7 奶牛分娩前后瘤胃12个差异代谢物聚类热图
3 讨 论
瘤胃微生物菌群是一种微生物共生联合体,主要包括细菌、真菌、原虫和噬菌体等几大类[9],这些微生物能发酵碳水化合物饲料、合成B族维生素、将非蛋白氮合成机体所需的菌体蛋白质和发酵饲料纤维产生挥发性脂肪酸(VFA)为机体供能[10-11]。众多研究表明,日粮结构对瘤胃微生物菌群组成和数量具有显著影响,如高粗饲日粮条件下瘤胃中的优势种群为栖瘤胃普雷沃氏菌和丁酸弧菌,而饲喂高精料下,嗜淀粉瘤胃杆菌、乳酸杆菌、链球菌、反刍兽新月单胞菌和消化链球菌为优势种群[12]。瘤胃微生物组成和数量的差异可影响饲料消化率,因此,瘤胃内代谢物的含量变化可以间接反映瘤胃微生物组成和数量的相关情况。奶牛从产犊前10 d开始,干物质进食量从10 kg·d-1左右降低到产犊时的6 kg·d-1左右[13],其瘤胃微生物组成和数量也必定发生巨大改变。因此,本试验选择相同TMR日粮饲喂条件下的待产奶牛10头,分析产前7~10 d瘤胃液和分娩后未进食前瘤胃液代谢物的变化规律,旨在探讨分娩因素对瘤胃微生物消化代谢饲料的影响。
奶牛围产期受应激、神经内分泌和激素变化等因素的影响,瘤胃内环境发生改变,导致奶牛瘤胃机能减弱,瘤胃微生物蛋白(microbial crude protein, MCP)合成量减少[14-15]。鸟嘌呤、腺嘌呤和次黄嘌呤是瘤胃微生物菌体蛋白合成的前体[16],L-谷氨酸可经过核苷酸代谢途径生成腺苷酸和腺苷,而天冬氨酸是嘌呤、嘧啶碱基的合成前体。本研究显示,奶牛分娩过程中瘤胃内L-天冬氨酸、L-谷氨酸、腺苷和尿酸含量显著升高,这提示MCP合成量在分娩过程中减少,其主要原因可能是奶牛在分娩过程中受应激、神经内分泌和激素等一系列变化的影响,瘤胃微生物数量减少,以致MCP合成量降低。研究发现,瘤胃中拟杆菌门是奶牛围产前期瘤胃内的优势菌门,且其丰度与嘌呤代谢呈显著正相关[17-18]。在嘌呤分解代谢中,鸟嘌呤和腺苷等在酶的作用下,几乎全部氧化为尿酸。因此,奶牛分娩过程中瘤胃内尿酸含量明显升高可能与拟杆菌门丰度增加相关。但鸟嘌呤的变化与L-谷氨酸、腺苷和尿酸不一致,其机制有待进一步研究。
目前,关于牛磺酸在瘤胃内的变化尚未见到相关文献报道,牛磺酸是一种具有多种生理活性和功能的含硫氨基酸,其生产方法有微生物发酵法、天然提取法和化学合成法[19-20],Joo等[21-22]研究发现,通过体外生物工程法可以利用谷氨酸棒杆菌和枯草芽孢杆菌产生牛磺酸。本试验在奶牛瘤胃液中鉴定出了牛磺酸中间产物2-氨基乙烷磺酸-牛磺酸,而且在分娩过程中逐渐升高,提示奶牛分娩过程中与牛磺酸代谢相关的瘤胃微生物数量可能增加,但目前参与牛磺酸代谢的具体瘤胃微生物尚不明确,有待进一步研究。牛磺酸对胎儿神经系统的发育起到关键性的作用[23],本研究发现,奶牛分娩过程中瘤胃牛磺酸含量显著升高,推测其可能原因是分娩过程中与牛磺酸代谢相关的瘤胃微生物数量应答性增加,以满足妊娠末期胎儿大脑发育。
蛋白质在蛋白酶的作用下可分解成氨基酸,后者经过脱羧作用可形成组胺、色胺、精胺和亚精胺等生物胺。有研究表明,生物胺的形成与微生物有密切关系,微生物在大量繁殖时可以形成蛋白酶[24],从而分解饲料或食品中的蛋白质。微生物分解蛋白的能力因种类而异,真菌较细菌容易分解蛋白质,细菌中变形杆菌、嗜淀粉拟杆菌、栖瘤胃拟杆菌和牛链球菌等具有分解蛋白质的能力[25-26]。本试验结果显示,奶牛分娩过程中瘤胃内亚精胺含量明显降低,这提示奶牛分娩前参与饲料蛋白质分解的微生物如真菌和细菌中的变形杆菌、嗜淀粉拟杆菌、栖瘤胃拟杆菌和牛链球菌等数量在分娩过程中逐渐减少。
瘤胃微生物具有合成维生素B族和K的能力[27-28],因此,瘤胃中维生素B族含量的变化在一定程度上可以反映瘤胃微生物的活性。有研究表明,奶牛瘤胃中维生素B6的合成与瘤胃纤维降解菌(白色瘤胃球菌、黄色瘤胃球菌、产琥珀酸丝状杆菌和溶纤维丁酸弧菌)的活性密切相关[29]。VB6又称吡哆素,包括吡哆醇、吡哆醛及吡哆胺。本研究发现,奶牛分娩过程中瘤胃内吡哆醇和4-吡哆酸含量减少,这也间接表明奶牛分娩过程中与VB6合成相关的瘤胃微生物纤维降解菌(白色瘤胃球菌、黄色瘤胃球菌、产琥珀酸丝状杆菌和溶纤维丁酸弧菌)的活性明显下降。VB6与多种代谢反应密切相关,尤其是氨基酸代谢和蛋白质代谢[30],在氨基酸代谢中作为转氨酶的辅酶主要参与转氨基作用[31],在蛋白质代谢中主要参与抗氧化反应[32]。除此之外,VB6还促进抗体蛋白的合成,提高机体免疫应答[33]。因此,奶牛分娩后适量添加VB6对提高氨基酸和蛋白质代谢、增强机体免疫应答具有一定促进作用。
淀粉是瘤胃微生物的重要能源和碳源,瘤胃中部分细菌、原虫和真菌具有吞噬和分解饲料淀粉的能力,如原虫中几乎所有的内毛虫和双毛虫、细菌中的嗜淀粉瘤胃杆菌、牛链球菌、溶淀粉琥珀酸单胞菌、双歧杆菌和反刍兽新月单胞菌等和真菌中的大多数厌氧菌[34-35]。这些瘤胃微生物能产生α-淀粉酶,将淀粉水解为麦芽糖[36],进而通过蔗糖和淀粉代谢和半乳糖代谢途径生成葡萄糖和乳糖。另据报道,原虫可限制细菌对淀粉的快速发酵,当原虫数量不足时淀粉会被细菌发酵成乳酸,瘤胃pH急剧下降,导致瘤胃对纤维素消化能力下降或引起酸中毒[37]。因此,瘤胃中可溶性糖含量的高低可以间接反映瘤胃微生物的组成与数量。本试验结果发现,奶牛分娩过程中瘤胃内麦芽糖、葡萄糖和乳糖含量显著低于分娩前,表明奶牛分娩过程中能发酵淀粉的微生物原虫、嗜淀粉瘤胃杆菌、牛链球菌、溶淀粉琥珀酸单胞菌、双歧杆菌、反刍兽新月单胞菌和厌氧菌的数量逐渐减少。
奶牛分娩前后血液激素水平会发生较大扰动,部分激素会通过唾液进入瘤胃。本试验通过代谢组学技术,发现奶牛分娩前后瘤胃内肾上腺素水平发生了明显变化,分娩后明显低于分娩前。分娩等应激因素可以刺激肾上腺素能系统和肾上腺-促肾上腺皮质轴,导致反刍动物饲料摄入量减少、瘤胃收缩功能和产奶性能下降[38]。因此,分娩前后瘤胃内肾上腺素的变化可能与分娩应激有关,分娩应激刺激肾上腺素能系统和肾上腺-促肾上腺皮质轴释放大量肾上腺素进入血液,又经过唾液进入瘤胃。肾上腺素除影响采食量和瘤胃蠕动外,还对瘤胃微生物区系的组成与数量产生一定影响。有研究报道,在饲料中添加β-肾上腺素能激动剂能影响瘤胃微生物在门水平的丰度,其中纤维杆菌门的丰度明显升高[39]。因此,分娩过程中瘤胃内肾上腺素浓度的下降可能会导致纤维杆菌门的丰度降低,使纤维素分解能力下降,VFA减少,加之采食量和瘤胃蠕动机能下降,极易诱发产后能量负平衡。另据报道,肾上腺素可以促进瘤胃上皮细胞通过β2-肾上腺素受体吸收瘤胃内葡萄糖,从而降低瘤胃内葡萄糖的水平,减缓或防止瘤胃酸中毒的发生[40]。但本试验结果显示,奶牛分娩过程中瘤胃内肾上腺素和葡萄糖的浓度均呈减少趋势,这与肾上腺素能刺激瘤胃上皮细胞吸收葡萄糖理论不一致。瘤胃内葡萄糖浓度的变化取决于其生成和吸收这两个因素的影响,因此,本研究中奶牛分娩过程中瘤胃内葡萄糖浓度降低可能主要与参与淀粉发酵的微生物数量严重减少有关。
4 结 论
本试验采用UPLC-MS/MS代谢组学技术和MetaboAnanlyst 5.0中的通路分析方法研究了奶牛分娩前后瘤胃代谢物及其代谢通路的变化规律,确定了57种差异代谢物,奶牛分娩后有34种差异代谢物含量降低,23种升高,导致牛磺酸和亚牛磺酸代谢、精氨酸和脯氨酸代谢、D-谷氨酰胺和D-谷氨酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢、精氨酸生物合成、淀粉和蔗糖代谢、半乳糖代谢、嘌呤代谢和维生素B6代谢发生显著改变。说明奶牛分娩过程中与氨基酸、糖、核苷酸和维生素相关的瘤胃微生物菌群组成发生了应答性改变。

