子宫颈胃型腺癌18例临床分析*
邢 艳 邹 运 吴玉梅
(首都医科大学附属北京妇产医院 北京妇幼保健院妇瘤科,北京 100006)
2018年国际宫颈腺癌标准与分类(International Endocervical Adenocarcinoma Criteria and Classification,IECC)[1]中,根据人乳头瘤病毒(human papilloma virus,HPV)感染状态,分为HPV相关性腺癌及非HPV相关性腺癌,后者根据其独特的组织形态学及分子基因组学进一步划分为胃型、透明细胞型、中肾型和子宫内膜样腺癌,其中子宫颈胃型腺癌(gastric-type endocervical adenocarcinoma,G-EAC)是最常见的类型[2]。由于G-EAC具有高度恶性、侵袭性强的特点,多数病人发现即为晚期,往往预后较差。目前文献多为个案报道,国内最大宗报道为18例[3],且以病理分析为主。本研究回顾性分析我科2016年5月~2021年4月18例G-EAC资料,为其诊断、治疗及预后提供更多参考。
1 临床资料与方法
1.1 一般资料
本组18例,平均年龄51.5岁(35~65岁)。均否认肿瘤家族史。
首发症状:阴道排液8例,接触性出血或异常阴道出血5例,腹痛1例,无症状4例(3例TCT、HPV异常,1例体检发现卵巢肿物就诊)。
妇科检查:16例宫颈局部肥大增粗、质硬(包含1例因卵巢肿物就诊患者,双附件区可及囊实性肿物);1例未婚无性生活(因阴道排液就诊),1例肿瘤侵及阴道,宫颈无法暴露。
实验室检查:11例行TCT检查,提示腺癌1例,非典型腺细胞(AGC)4例,低度鳞状上皮内病变(LSIL)1例,非典型鳞状细胞-不能明确意义(ASC-US)3例,正常2例。10例行HPV检测,结果均为阴性。17例行肿瘤标记物检查,包括CA19-9、CA125、癌胚抗原(CEA)及鳞状细胞癌抗原(SCCA),10例CA19-9升高,40.98~>700 U/ml(正常值0~39 U/ml),其中6例>10倍正常值;CA125升高5例,37.1~59.9 U/ml(正常值0~35 U/ml);CEA升高3例,4.96~7.84 ng/ml(正常值0~4.7 ng/ml);SCCA升高1例,4.04 ng/ml(正常值0~3 ng/ml)。
影像学检查:12例行盆腔超声检查,7例提示宫颈增大伴多发囊性无回声。15例行全腹+盆腔增强CT检查,10例见宫颈占位或肿块,提示恶性肿瘤。14例行盆腔增强MRI检查,均见宫颈占位或信号异常,提示恶性肿瘤。
1.2 方法
1.2.1 诊断方法 根据2018年国际妇产科联合会(International Federation of Gynecology and Obstetrics,FIGO)宫颈癌新分期标准[4],临床分期由2名副主任及以上职称的医师进行妇科检查,结合影像检查包括胸部CT、盆腔增强MRI/盆腹腔增强CT等确定临床分期,病理诊断采用宫颈活组织检查或宫颈锥切术明确。手术患者根据术后病理明确分期。
G-EAC的病理诊断[5]:G-EAC是一组形态学异质性极大的肿瘤,其形态学大多表现为小而立方的细胞或扁平细胞构成的腺体,乳头状生长的腺体,腺体中可夹杂杯状细胞,以及出现浓稠嗜酸性或泡沫状胞质。免疫组化中:CK7呈阳性表达,HIK1083和MUC6大多阳性表达,p53突变在G-EAC中约50%。因胃型黏液为中性黏液,正常宫颈腺上皮胞质内为碱性黏液,因此PAS/阿辛蓝染色也是诊断G-EAC的有效方法。本组典型镜下表现见图1、2。
16例行阴道镜检查+宫颈活检,其中10例诊断G-EAC,2例可疑癌,行宫颈冷刀锥切术诊断G-EAC,4例诊断腺癌,行根治性手术后病理诊断G-EAC;1例未婚无性生活的53岁患者行宫腔镜分段诊刮病理诊断原位腺癌,行筋膜外全子宫切除术后病理提示G-EAC;1例卵巢囊肿剥除术中冰冻病理提示卵巢黏液腺癌,行全子宫+双附件+大网膜切除术后诊断G-EAC。
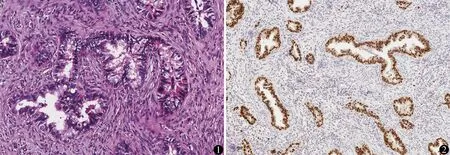
图1 肿瘤细胞胞浆嗜酸性或淡染泡沫状,细胞核异型性显著(HE染色 ×200)图2 肿瘤细胞p53呈突变型表达,阳性定位细胞核(免疫组化染色SP法 ×100)
1.2.2 治疗方法 根据2021年美国国立综合癌症网络(national comprehensive cancer network,NCCN)指南[6],ⅠB2~ⅡA2期选择根治性手术,包括广泛全子宫切除+双附件切除+盆腔淋巴结切除+腹主动脉旁淋巴结切除,根据术后病理进一步病理分期,有高危因素者补充放化疗和(或)全身化疗,临床评估为局部晚期宫颈癌者可新辅助化疗(neoadjuvant chemotherapy,NACT)后行根治性手术;ⅡB期及以上采用根治性同步放化疗,盆腔外照射40~50 Gy,阴道近距离照射30~40 Gy,使肿瘤A点剂量达80~85 Gy,同步铂类增敏化疗;对于盆腔淋巴结,可采用手术分期或影像学分期,影像学分期根据CT、MRI或PET/CT等,手术分期行盆腔淋巴结切除±双附件切除术,根据术后病理行根治性放化疗。
1.2.3 疗效评价 初始治疗结束后进行疗效评价,其中手术治疗者在完成术后补充治疗后进行疗效评价,根治性放化疗者在治疗结束后进行疗效评价。完全缓解(complete response,CR)[7]:肿瘤完全消失;肿瘤未控[8]:以肿瘤根治为目的治疗后,局部癌灶未完全消失,治疗中及每次随诊观察时,仍发现残存癌灶。
1.2.4 治疗后随访 治疗后2年内每3个月随访一次,第3~5年每6个月一次,5年后每年一次。
2 结果
2.1 治疗和随访结果
18例诊治结果见表1。Ⅰ期3例,Ⅱ期4例,Ⅲ期8例,Ⅳ期3例。初始治疗行根治性手术10例(其中4例联合NACT),筋膜外全子宫切除1例,全子宫+双附件+大网膜切除1例,分期手术1例;根治性同步放化疗5例。1例失访,其他17例随访至2021年7月,随访时间4~39个月(平均14个月),5例死亡(均为肿瘤相关)。①10例根治性手术±术后放化疗,其中7例初始治疗达CR,随访4~39个月,中位数11个月,1例死亡(初治达CR后CA19-9降至正常,随访7个月CA19-9上升至3982 U/ml,结合CT检查诊断复发,17个月死亡),6例生存;3例肿瘤未控,随访4、20、22个月,均生存,其中例14 NACT+根治性手术+全身化疗后发现腹壁转移灶,考虑肿瘤未控,全身化疗加贝伐珠单抗治疗5个周期,贝伐珠单抗单药维持治疗4个周期,疾病达CR。②5例根治性同步放化疗,1例失访,4例肿瘤未控,其中2例随访5、6个月死亡,2例行姑息性手术+全身化疗,1例随访7个月死亡,1例随访28个月生存。③3例行非根治性手术,2例CR,随访7、22个月,生存;1例未控,随访11个月死亡。
2.2 术后病理特点
初治行根治性和非根治性手术13例的病理显示,宫颈深肌层浸润(浸润>2/3管壁)11例,阴道穹隆受侵6例,脉管癌栓6例,病理切缘阳性2例,宫旁组织浸润2例。卵巢转移6例,盆腔淋巴结转移6例,腹主动脉旁淋巴结转移1例,大网膜转移2例,腹膜转移1例。
3 讨论
G-EAC临床症状缺乏特异性,宫颈局部大多无肉眼可见病灶,多数诊断时已为晚期,是导致肿瘤预后差的原因之一。本组18例G-EAC平均发病年龄51.5岁,以阴道排液、异常阴道出血为主要临床表现,22%(4/18)无症状,16例宫颈局部肥大增粗、质硬,无肉眼可见病灶。Radomska等[9]报道5例G-EAC平均发病年龄61.6岁(43~87岁),较HPV相关性腺癌的发病年龄(19例,平均44.6岁,26~62岁)推迟了约17岁,其常见临床症状与本研究一致,且与HPV相关性腺癌无明显差异。细胞学检查是宫颈癌筛查的重要手段。本组82%(9/11)TCT检查异常,进而通过组织病理学明确诊断。G-EAC为非HPV相关性腺癌,本组100%(10/10)HPV阴性。文献报道的TCT异常率通常低于本研究,Schwock等[10]报道14例G-EAC的17份液基细胞学检测,10份(59%)异常,7份未检测出病变的标本再次复核,其中6份存在AGC,异常率提高至94%(16/17)。镜下对比HPV相关性腺癌,蜂窝状腺细胞、核增大(大于中性粒细胞)、细胞质呈“泡沫状”是G-EAC最常见的特征,细胞质中黄色黏蛋白、核内假包涵体和杯状/潘氏样细胞是G-EAC独特的特征[10,11]。由于G-EAC的临床症状缺乏特异性,组织分化好,与正常腺体难以区分,导致G-EAC的漏诊率较高,李新敏等[3]报道漏诊率可达34%,当G-EAC累及子宫内膜或卵巢时,常与原发性卵巢癌及子宫内膜癌难以区分[12]。本组16例行宫颈活检,仅10例明确诊断G-EAC,1例卵巢肿瘤误诊为原发性卵巢黏液腺癌,因此,G-EAC的诊断需要经验丰富的病理医师。本研究中,超声、CT及MRI均在G-EAC的辅助诊断方面有一定作用,多以宫颈囊性或多囊性改变为特点,尤其10例行MRI均提示宫颈恶性肿瘤可能。Ohya等[13]的研究显示,MRI显示病变位于宫颈较高的位置,病灶周围被相对较大的囊性肿物包围,即“宇宙模式”,则高度提示G-EAC可能。因此,对于不明原因的阴道排液及异常阴道出血,应充分结合细胞学和MRI检查[14],尤其是细胞学中黄色黏蛋白,是有效的早期检测和术前辅助诊断G-EAC的方法。
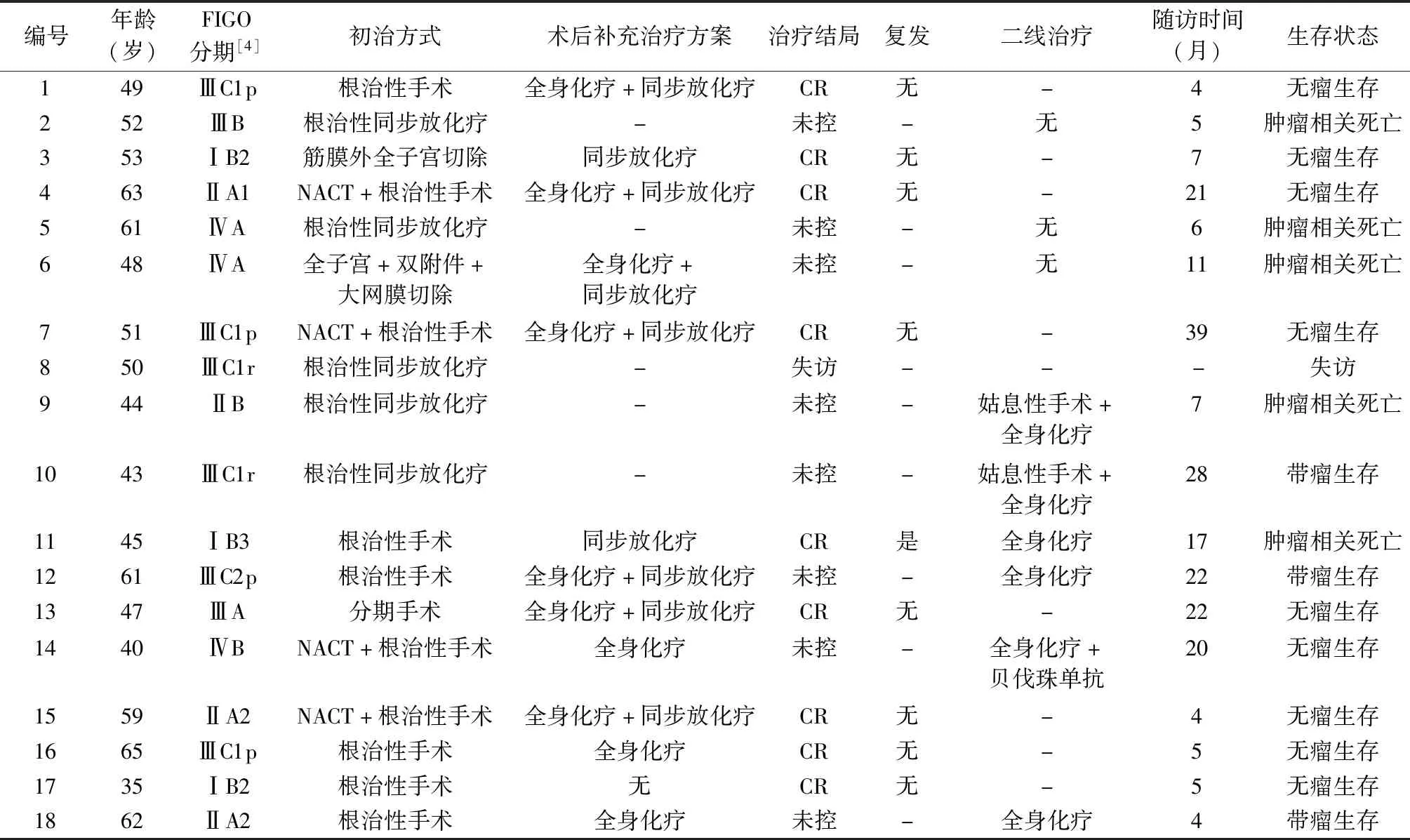
表1 18例G-EAC治疗方案及随访结果
本研究中,CA19-9在G-EAC的诊断中显示出价值,59%(10/17)CA19-9升高,其中6例高于正常值10倍,1例初治达CR后降至正常,复发时上升至3982 U/ml。CA125及CEA仅5例、3例升高。CA19-9是消化道肿瘤相关糖蛋白类抗原,常在胰腺癌、胃癌和结直肠癌、妇科肿瘤等中表达上调。易启华等[15]的研究显示,CA19-9水平升高,预测宫颈腺癌患者宫旁浸润及淋巴结转移的敏感性、特异性、准确率分别为45.45%(5/11)、79.52%(132/166)、77.40%(137/177)及52.94%(18/34)、85.31%(122/143)、79.10%(140/177)。因此,CA19-9可能成为G-EAC特异性的肿瘤标记物,并对其预后有预测价值,但仍需大样本研究进一步证实。
大多数G-EAC患者发现即为晚期,且多合并远处转移,预后差。本研究中,83%(15/18)诊断Ⅱ~Ⅳ期,初始手术中85%(11/13)宫颈深肌层浸润,46%(6/13)阴道穹隆受侵,46%(6/13)脉管癌栓,46%(6/13)盆腔淋巴结转移,46%(6/13)卵巢转移。Karamurzin等[16]的研究纳入3家医疗结构40例G-EAC,晚期(FIGO Ⅱ~Ⅳ)占59%,50%有淋巴结转移,35%卵巢受累,20%合并腹部转移。本组17例随访4~39个月,1例CR后8个月复发,29%(5/17)死亡。诸多研究也证实G-EAC的不良预后,对比HPV相关性腺癌,G-EAC中位生存时间为22个月vs.118个月[17],5年无病生存率为30% vs. 74%[18],5年无进展生存率38.5% vs. 75.0%[6],尤其是Ⅱ期及以上患者复发时间明显缩短(HR=4.19,P=0.011)[19]。G-EAC患者的不良预后,不仅与诊断困难、肿瘤期别晚有关,更与肿瘤对放化疗不敏感有关。本研究中,初始治疗的有效率很低,47%(8/17)治疗后肿瘤未控,包括随访的4例初始治疗为根治性同步放化疗的全部患者。已有研究证实,G-EAC患者较普通型宫颈腺癌更具化疗抵抗[18],故目前大多数学者认为根治性手术是治疗的首选,且不建议进行保留生育功能的手术[6]。本组1例治疗后肿瘤未控,后续化疗加贝伐珠单抗治疗5个周期并贝伐珠单抗维持治疗4个周期,疾病达CR,显示靶向治疗在G-EAC中的应用前景。随着二代测序技术的广泛应用,多项研究探讨G-EAC的分子基础,常见的突变类型包括TP53、BRCA2、MSH2、MSH6[20]以及KRAS、ERBB2/ERBB3[21]。HER2扩增在G-EAC中的发生率为14.7%(5/34)[22],HER2抑制剂可能成为G-EAC潜在的治疗靶点。探索更多针对分子病理特征的靶向治疗方法,可能有望改善G-EAC的预后。
综上所述,G-EAC恶性程度高,预后差,CA19-9可能作为其肿瘤标记物。大多G-EAC诊断即为晚期,常合并卵巢、盆腔淋巴结转移,传统治疗效果欠佳,尤其是根治性同步放化疗,手术应是首选,且G-EAC易合并腹膜、大网膜及卵巢转移,手术范围是否应常规切除大网膜、双侧附件等仍需进一步探讨,G-EAC的靶向治疗也是需要未来积极探索的领域。

