主动脉窦瘤破裂入左心房并感染性心内膜炎1例并文献复习
陈明祥,蒋其龙,何 拯,唐文帅,李志平,张为民,李福平
(重庆医科大学附属第三医院心血管外科,重庆 401120)
主动脉窦瘤(sinus of valsalva aneurysm,SVA)属于罕见的心脏疾病,发病率约为0.09%。该病大多起源于右冠窦,其次是无冠窦,而起源于左冠窦的情况非常罕见[1]。SVA破裂最常破入右心室,其次是右心房,破入左心室、肺动脉及其他部位较少见[2],SVA破裂可能与感染性心内膜炎有关。SVA破裂常合并主动脉瓣关闭不全,但鲜有合并主动脉瓣狭窄的病例报道。现报道1例SVA破裂入左心房合并主动脉瓣重度狭窄及感染性心内膜炎的病例,以期对该病的临床诊断和治疗提供参考。
1 资料与方法
1.1 临床资料
患者,男,64岁,因“发热伴活动后气促20 d”于2021年2月17日收入重庆医科大学附属第三医院。查体示胸骨右缘第2肋间可闻及4/6级收缩期吹风样杂音,可触及细震颤。心电图示窦性心动过速,左心室高电压。彩色超声心动图示主动脉瓣回声明显增强,瓣叶及瓣根部可见钙化、主动脉瓣口射血峰值流速为480 cm/s,最大压差为92 mmHg,平均压差为49 mmHg,反流束瘤颈宽2.5 mm,面积2.0 cm2,提示主动脉瓣钙化、主动脉瓣狭窄伴关闭不全;左冠瓣及无冠瓣心室面可见数个强回声附着,其中最大为8.0 mm×3.0 mm,提示主动脉瓣赘生物形成;主动脉瓣环根部近主动脉窦部见一瘘管样结构与左心房相通,内径约6.7 mm,可见收缩期为主的花色血流,面积约5.3 cm2,提示主动脉左冠窦瘤破裂入左心房;二尖瓣中度反流,反流束瘤颈宽约5.5 mm,面积7.2 mm2。冠状动脉CTA示左前降支远段心肌桥—壁冠状动脉,管腔狭窄约25%,主动脉瓣钙化,主动脉瓣环根部与左心房前壁间可见异常血流,宽度5.6~7.9 mm,考虑主动脉瓣根部—左房瘘可能,升主动脉边缘大块钙化灶(图1)。胸部CT平扫示双侧胸腔少量积液,头部、全腹部、盆腔未见明显异常。血液分析示白细胞11.84×109/L,血红蛋白82 g/L。肝功能示白蛋白28.3 g/L。血培养阴性。
1.2 方法
术前经积极抗感染、强心、利尿等对症支持治疗,患者心功能仍进行性恶化,遂急诊手术。采用传统正中开胸,切开心包见心包粘连,升主动脉近端膨大,游离升主动脉时探及升主动脉两侧壁钙化斑块形成,仅近头臂干动脉处无钙化斑,遂选择右侧股动脉插入主动脉灌注管,经上、下腔静脉插入静脉插管建立体外循环,采用吸附型体外循环技术减少围术期炎症反应,吸附柱为HA380(健帆生物科技集团股份有限公司,中国珠海)。阻断升主动脉并作纵切口,直视下分别经左、右冠状动脉开口顺行灌注含血St.Thomas液(血液∶St.Thomas溶液=4∶1,温度4~8 ℃)以保护心肌,首次灌注量为20~30 mL/kg,灌注压为80~120 mmHg;随后每20~30 min顺行输注10~20 mL/kg含血St.Thomas液,直到主动脉开放。术中有停跳不完全的情况给予冰屑降温辅助停跳;待心脏停跳后,切开右心房并经卵圆窝切开房间隔,探查见主动脉瓣呈三叶,瓣膜明显钙化,交界挛缩,心室侧多处赘生物形成,最大约8.0 mm×4.0 mm,左冠窦可见一大小约8.0 mm×5.0 mm的破口经左心房前壁破入左心房,二尖瓣后瓣瓣膜轻度增厚,前瓣可见3.0 mm×1.0 mm的破口,瓣口轻度关闭不全。切除主动脉瓣,清除赘生物,破口采取经主动脉侧涤纶补片修补,二尖瓣破口采取4-0 prolen线带垫片修补,主动脉瓣间断褥式缝合并植入19号主动脉瓣机械瓣(19AGFN-756),见图2。
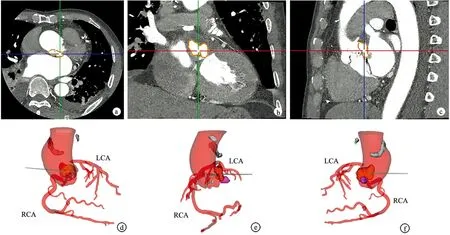
a~c:轴位、冠状位、矢状位左冠窦瘤;d~f:正面、侧面、后面升主动脉及其周围钙化病灶、主动脉瓣钙化病灶、冠状动脉、SVA及其破口三维重建结果 LCA:左冠状动脉;RCA:右冠状动脉;箭头所指为三维重建的SVA及其破口
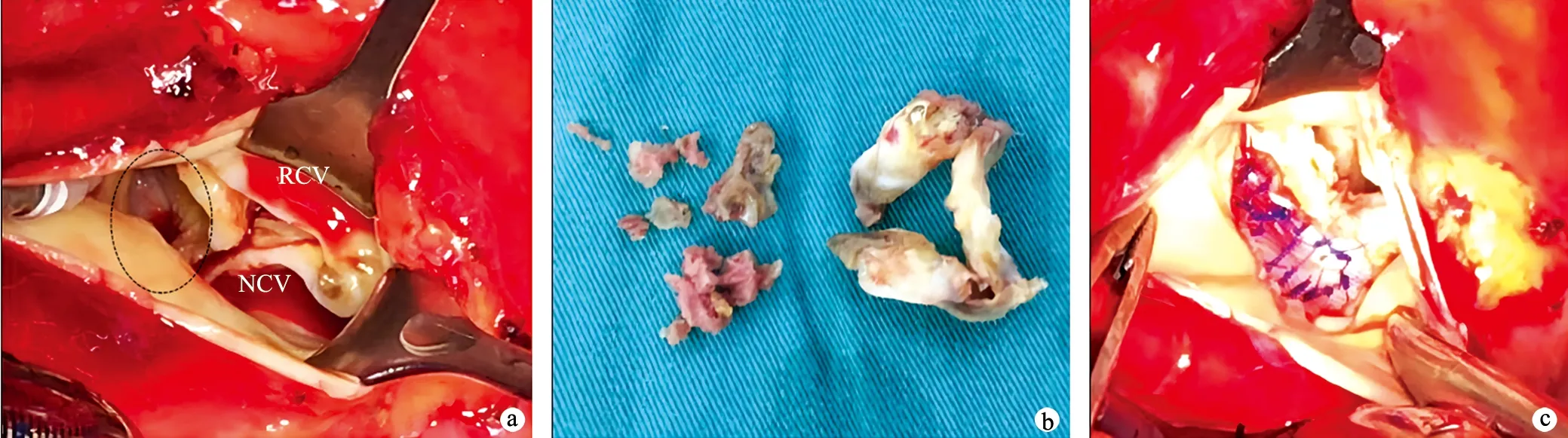
a:术中可见左冠窦瘤膨出(虚线圈),并可见一大小约8.0 mm×5.0 mm的破口破入左心房;b:术中切除的主动脉瓣(右)及赘生物(左);c:涤纶补片修补SVA及其破口 RCV:右冠瓣;NCV:无冠瓣
2 结果
本研究中患者手术时间为475 min,阻断时间为202 min。术后18 h患者脱离呼吸机并拔除气管插管,术后72 h转出监护室。术后7 d复查彩色超声心动图,主动脉瓣机械瓣未见异常,抗感染治疗6周后患者痊愈出院。
3 讨论
SVA可以是先天形成,也可以是后天发展形成。先天性SVA的临床表现通常不明显,无症状者可在心脏影像学检查过程中偶然检测到[3],也可能因影响邻近结构或心内分流而出现不同程度的呼吸困难、胸骨后痛和腹痛等相关症状[4]。SVA破裂最常破入右心室,其次是右心房,破裂入左心室、肺动脉或其他部位者少见,约1.9%[2]。本例患者SVA起源于左冠窦,并破裂入左心房,为临床罕见。
目前认为,SVA的形成可能与结缔组织疾病导致的主动脉中膜内正常弹性组织缺失有关,而许多感染性疾病,如细菌性心内膜炎、梅毒和肺结核等,也容易导致其形成。一项梅奥医学中心的研究发现,6%的SVA患者最初表现为感染性心内膜炎,并可能同时是SVA的并发症[5]。本例SVA患者病初表现为感染性心内膜炎,可能是基于SVA的并发症;但本例患者同时合并因主动脉瓣严重钙化导致的主动脉瓣重度狭窄并关闭不全,这也可能导致并发感染性心内膜炎。
SVA破裂可导致心内异常分流,其临床结果取决于破口的大小、位置和破裂的速度。小的、渐进的穿孔可在血流动力学代偿下无急性心力衰竭的表现;但大的、急性高流量的穿孔血流动力学无法代偿,可导致急性心力衰竭[6]。除了破口的位置和大小,破裂的速度也是SVA临床结果的主要决定因素[3]。本例患者合并主动脉瓣重度狭窄并关闭不全,基础心功能差,SVA破入左心房、破口大,且合并感染性心内膜炎,导致破裂速度快;又因其合并二尖瓣穿孔,导致血流动力学严重紊乱,左心负荷急剧加重,最终导致急性心力衰竭,术前虽经积极营养心肌、强心、利尿等药物治疗,心功能仍持续性恶化。
许多影像学方法都可以用于诊断SVA,经胸彩色超声心动图是一种有效的无创检查工具,可检出多达75%的SVA[7],其对于评估SVA的大小、形状、位置、破裂入腔室以及是否有其他心脏畸形有重要作用,同时也有助于手术方案的制定及疗效评估[8-9]。CT对SVA也具有较高的诊断能力,尤其对于破裂的SVA,不仅可以评估SVA的大小、形状、位置、破裂入腔室,还可以评估与手术操作相关区域的病变情况,尤其在钙化病变的诊断过程中,其诊断效果优于超声心动图,可通过三维重建方式获得形象、直观的解剖情况,有助于制定手术策略。本例患者术前通过超声心动图、CT的充分评估,并通过CT三维重建对病变情况进行了详细的分析,从而制定了手术策略。磁共振成像对SVA也具有较高的诊断能力,但目前国内应用较少。此外,主动脉造影被认为是评估主动脉窦动脉瘤破裂的金标准,可以用来确定破口的形态、大小和位置。本例患者因术前心功能差而未行主动脉造影检查。
所有伴有SVA破裂的患者都建议进行紧急手术干预,心力衰竭不应该是手术的绝对禁忌证[10-11]。SVA手术治疗的原则应是清除赘生物、修补窦瘤、治疗合并病变、修复或置换受损瓣膜。对于窦瘤破入左心房者,罗新锦等[2]主张单纯主动脉切口即可暴露充分,可于主动脉窦内补片修补破口、加固窦壁。围术期的治疗包括缓解心衰症状,如有心律失常、心内膜炎则均需予以相应治疗。本例患者术前准备过程中因心功能持续性恶化,故急诊行手术治疗,术中经主动脉切口顺利修复破口,预后良好。本例患者因合并升主动脉周围钙化性病变,术中探查也得到证实,故未采取常规升主动脉插入主动脉灌注管的方式进行体外循环,而是采用股动脉插管,避免了在钙化部位阻断主动脉可能导致的主动脉夹层、破裂等严重并发症。

