子宫内膜癌组织中ALDH1、ER、PR表达及临床意义
邱 爽 刘永利 葛 艳 高立永 张 蓓
1.徐州医科大学附属徐州市立医院(221000);2.江苏省徐州市中心医院
子宫内膜癌(EC)是一种恶性程度高的女性生殖道肿瘤,在围绝经期和绝经后女性较为多见[1-2],其发生机制目前尚未明确,相关研究表明子宫内膜癌的发生与内源性及外源性雌激素长期刺激关系密切[3-4]。多项研究表明[5],乙醛脱氢酶1(ALDH1)作为肿瘤干细胞的标志物之一,可预测多种类型癌症生存预后。本文就雌激素受体(ER)、孕激素受体(PR)及ALDH1在子宫内膜病变组织中表达特征进行分析,探究诊断子宫内膜癌价值,为临床治疗及预后提高参考。
1 材料与方法
1.1 一般资料
本研究在徐州医科大学附属徐州市立医院和徐州市中心医院进行,收集2018年12月-2020年6月因子宫内膜疾病收治入院患者共计104例,根据常规病理诊断:正常增殖期子宫内膜18例(A组),子宫内膜不典型增生20例(B组),子宫内膜癌66例(C组)。患者年龄(53.3±5.9)岁(31~75岁)。国际妇产科联盟FIGO分期为Ⅰ期41例、Ⅱ期18例、Ⅲ期7例;组织分化类型为高分化21例、中分化27例、低分化18例;浸润深度为无子宫肌层浸润10例、浸润浅肌层者40例,深肌层或浆膜浸润16例;无淋巴结转移40例,有淋巴结转移26例。所有患者术前血常规、血凝分析、肝肾功能、心电图均正常。
1.2 免疫组化实验
1.2.1试剂免疫组化抗体ER(Servibio GB11843)、PR(Servibio GB11262)、ALDH1(abcam ab134188);兔二步法检测试剂盒(中杉金桥)、DAB显色试剂盒(中杉金桥)。
1.2.2方法子宫内膜组织用10%甲醛固定24h后使用石蜡包埋,以4μm切片行免疫组织化学染色。取4μm切片在65℃恒温烤箱中烘烤过夜,放二甲苯中依次脱蜡,将脱蜡后切片在100%、90%、80%、70%酒精中进行梯度水化各2min,蒸馏水中冲洗;将切片放入柠檬酸钠-EDTA修复液中煮沸、修复;冷却后用磷酸缓冲液(PBS)清洗切片,把切片放入湿盒中滴加FBS封闭1h,封闭完成后清洗切片,滴加按比例稀释的一抗,包括ALDH1、ER和PR 3个抗体,4℃孵育过夜;PBS冲洗3次后,滴加按比例稀释的二抗,室温放置2h,PBS冲洗3次,滴加按比例稀释的DAB显色试剂至切片显色,显微镜下观察后放入PBS终止显色;苏木素染核后用树胶封片,光学显微镜下采集图像。
1.2.3结果判定ER、PR在细胞核内出现棕黄色颗粒为阳性,ALDH1在细胞质内出现棕黄色颗粒为阳性。观察切片,并进行染色评分,按照染色深度分为4级:无染色0分、弱染色1分,中度染色2分,强染色3分。根据染色细胞百分比:未见0分,≤25% 1分,25%~50% 2分,≥50% 3分。将染色深度和染色密度分数相加得到总分,总分≤2分为阴性,>2分为阳性。
1.3 统计学分析
2 结果
2.1 不同子宫内膜组织中ER、PR、ALDH1表达
ALDH1在A组和B组中表达率均很低,在C组表达率较高(P<0.05)。ER、PR在A组、B组、C组中的阳性表达率逐渐下降(P<0.05)。见表1。
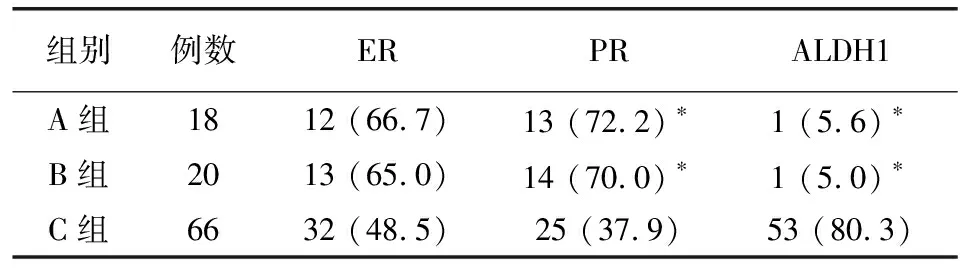
表1 各组内膜组织中ER、PR、 ALDH1表达阳性情况比较[例(%)]
2.2 子宫内膜癌组织中ER、PR、ALDH1表达
随着病理分期越晚、分化程度越差、肌层浸润越深者,子宫内膜癌组织中ER、PR表达越低,ALDH1表达越高 (P<0.05)。但ER、PR、ALDH1与患者淋巴结是否转移、是否肥胖、是否绝经均未见差异(P>0.05),见表2。
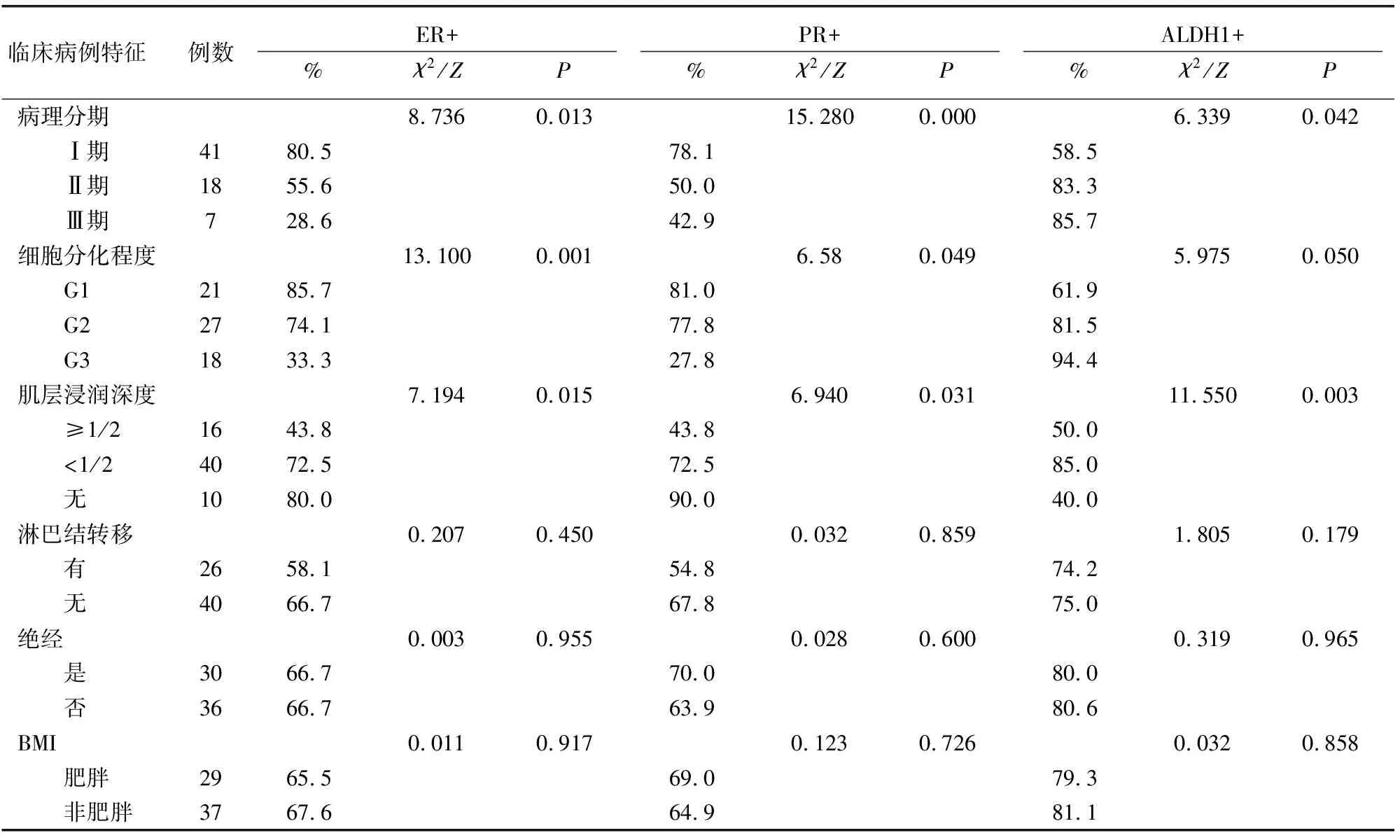
表2 子宫内膜癌组织中ER、PR、ALDH1阳性表达与临床病理特征关系(%)
2.3 子宫内膜癌中ER、PR、ALDH1相关性
Person相关分析显示,子宫内膜癌组织中ALDH1的表达与ER(γ=-0.61)及PR(γ=-0.57)表达存在负相关, ER与PR表达存在正相关(γ=0.99)(均P<0.05)。
2.4 ER、PR、ALDH1对子宫内膜癌的诊断价值
ROC曲线分析显示,ALDH1诊断子宫内膜癌有一定准确性,ER、PR诊断准确性较低。以ROC曲线靠左上方约登指数的最大切点作为最佳临界值,该点诊断敏感度、特异度见表3。
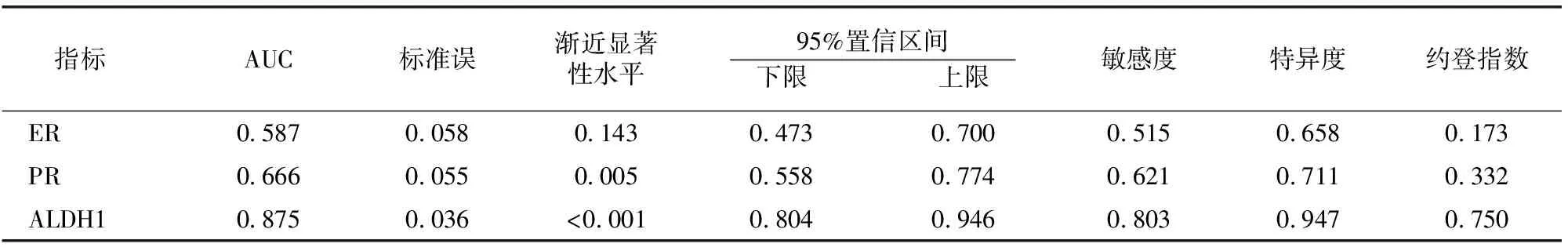
表3 各指标对子宫内膜癌的诊断价值
3 讨论
由于子宫内膜癌目前已经成为严重影响女性健康的三大肿瘤之一,所以有越来越多的研究人员将研究集中于一些分子标志物与子宫内膜癌的发生发展及预后的关系,为子宫内膜癌的诊断、治疗以及判断预后提供新思路[6-10]。子宫内膜癌的发病研究中,目前一致认为与患者雌、孕激素密切相关[10]。在子宫内膜的周期性变化中,雌激素和孕激素的周期性变化是最主要原因。本研究,子宫内膜癌组织中ER、PR阳性率低于正常子宫内膜组织表达,且阳性表达率与肌层浸润深度、病理分期及细胞分化程度呈负相关。与徐珂等[11]研究结论相同。有学者发现ER、PR在子宫内膜组织中阳性是良好预后的表现,其表达率与5年生存率呈正相关[12]。这些研究能够帮助人们认识子宫内膜癌的发病机制,指导后续治疗药物选择及预测患者结局[13]。本文行ROC曲线分析显示,ER、PR诊断子宫内膜癌的价值一般,推测可能与本研究选用抗体、样本数及样本区域局限性有关。
ALDH1对多种器官的正常发育和同源性非常重要,同时在胚胎形成过程中至关重要;是肝脏中一种重要的解毒酶,也表达在肾脏以及造血原细胞中,在干细胞的正常分化中发挥关键作用[14]。多个学者对ALDH1蛋白的表达及位置进行研究后发现,其表达水平与视黄醛表达有密切联系。视黄醛也称维生素A醛,其合成初期 ALDH1蛋白发挥一定作用,而视黄酸在维持机体正常发育和稳态同时抑制细胞生长,对肿瘤细胞凋亡有促进作用,所以ALDH1可能通过视黄醛参与肿瘤的发生发展[15]。本研究子宫内膜癌组织中ALDH1的阳性率高于正常的宫内膜组织,与周彤等[16]研究结果一致;且子宫内膜不典型增生组织中ALDH1表达低于子宫内膜癌组织。行ROC曲线分析显示,ALDH1诊断子宫内膜癌的敏感度、特异度均尚可,提示可将ALDH1作为一种简便、无创的子宫内膜癌早期诊断标志物。本研究发现,正常子宫内膜组织和不典型增生组织中ALDH1的阳性表达率差异不大,可能与实验选用抗体、实验样本数和实验样本区域局限性有关。
最近研究发现在子宫内膜癌的病程中雌激素含量会随着肿瘤的发展而发生变化,敲除ALDH1基因后抑制了肿瘤细胞增长[17-20]。在肿瘤的发生发展过程中ALDH1含量随之增高,从而抑制细胞凋亡。本研究证实ER、PR与ALDH1表达呈负相关,推测在子宫内膜癌中ALDH1与ER、PR的平衡关系会对子宫内膜癌的发生发展及病程、预后等产生影响,但3者在凋亡通路上如何相互制衡、相互作用尚需在细胞水平上进行研究才有可能得到明确的答案。
综上所述,子宫内膜癌组织中ALDH1的阳性率异常升高,且随着病理分期、深浅肌层浸润及细胞分化程度增加而升高,ALDH1有望成为一种肿瘤干细胞标志物预测子宫内膜癌预后。ALDH1和ER、PR可能成为评估子宫内膜癌早期诊断、术前病理分期、靶向治疗方案制定以及预后的有效指标。

