孕早中期血清铁蛋白、血红蛋白、糖化血红蛋白预测GDM价值
张亿林 李香兰
苏州明基医院(215000)
妊娠期糖尿病(GDM)可增加不良妊娠结局发生风险[1]。早期确诊并积极控制血糖是改善母婴结局关键。但大部分GDM孕妇患病早期无特异性症状,甚至部分空腹血糖(FPG)处于正常范围,仅参照PFG诊断GDM漏诊率较高[2]。而口服葡萄糖耐量试验(OGTT)过程繁琐[3]。且轻型糖尿病及隐性糖尿病者孕24~28周行OGTT筛查可能导致诊断滞后,此时高血糖已对胎儿产生负面影响,治疗时机延误[4]。糖化血红蛋白(HbA1c)可反映糖尿病患者近1~2个月血糖控制情况[5]。血红蛋白(Hb)被用于评估产妇生理及贫血状况[6]。Hb异常改变与早产、感染及产后出血等不良结局有关[7];妊娠早期高水平Hb可预测GDM发病风险[8]。铁蛋白(SF)反映铁储存水平。机体铁过载可损伤组织器官[9]。妊娠期间孕妇体内微量元素代谢异常,尤其铁元素蓄积与血糖异常、胰岛素分泌功能改变有关[10]。有学者[11]认为铁作为强促氧化剂可能影响机体糖代谢,危害母婴健康。但对HbA1c、Hb、SF预测GDM发生风险的价值尚未完全明确。本研究通过对孕早、中期孕妇血HbA1c、Hb、SF进行检测并比较GDM发生差异,探究与血糖关系,为GDM防治提供依据。
1 对象与方法
1.1 研究对象
回顾性收集2017年6月-2019年6月本院孕早中期(孕12~16周)产前检查单胎妊娠孕妇300例临床资料。入选标准:在本院规律产前检查且正常分娩,从早孕期随访至分娩结束;单胎妊娠;妊娠24~28周完成75 g OGTT试验,GDM孕妇满足FPG≥5.0 mmol/L、服糖后1 h血糖≥10.0 mmol/L、服糖后2h血糖≥8.5 mmol/L中任一要求[12];临床资料完整。排除标准:妊娠期肝内胆汁淤积症、妊娠期高血压疾病、妊娠剧吐;双胎或多胎妊娠;急性感染;药物性糖尿病;肝源性糖尿病;孕前有糖尿病病史;心肝肾肺功能不全;全身恶性肿瘤;合并血液系统疾病;代谢或营养障碍;吸烟;合并血液系统疾病;临床资料不全。按是否发生GDM分为GDM组(n=58)与非GDM组(n=242)。本研究经本院伦理委员会审批,患者均签署知情同意书。
1.2 临床资料采集
采集所有孕妇一般资料,包括人口学资料、身体质量指数(BMI)、孕产史、OGTT,孕早中期Hb、HbA1c、SF检测结果,妊娠结局等。
1.3 Hb、HbA1c、SF检测
妊娠12~16周时采集空腹外周静脉血,采用电阻抗法测定Hb水平,离子交换高液相色谱法测定HbA1c水平,双抗体夹心酶联免疫吸附试验法测定SF水平,试剂盒购自美国Bio-Rad公司。
1.4 OGTT试验
禁食8 h以上。葡萄糖氧化酶法测定FPG、1 h血糖、2 h血糖水平,应用日本Hitachi公司7600型全自动生化分析仪检测。
1.5 统计学方法

2 结果
2.1 一般资料
GDM组与非GDM组孕妇年龄、BMI、筛查孕周、孕次、产次等比较无差异(P>0.05)。见表1。

表1 两组孕妇一般资料比较
2.2 OGTT试验结果
GDM组FPG、1h血糖、2h血糖及HbA1c均高于非GDM组(P<0.05)。见表2。
2.3 妊娠结局
早产、胎膜早破、羊水过多、巨大儿等不良妊娠结局发生率GDM组高于非GDM组(P<0.05)。见表3。
2.4 孕早中期Hb、HbA1c、SF水平
GDM组孕早中期Hb、HbA1c、SF水平均高于非GDM组(P<0.05)。见表4。
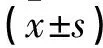
表2 两组孕妇OGTT试验结果比较
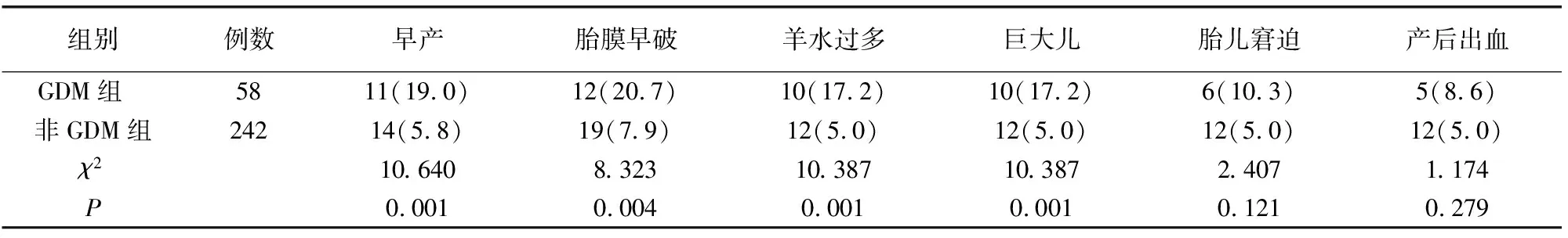
表3 两组妊娠结局比较)例(%)]
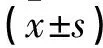
表4 两组孕早中期Hb、HbA1c、SF水平比较
2.5 孕早中期Hb、HbA1c、SF预测GDM发生的ROC曲线分析
孕早中期SF预测GDM发生效能最高,其次为HbA1c,Hb预测效能最低。见表5。
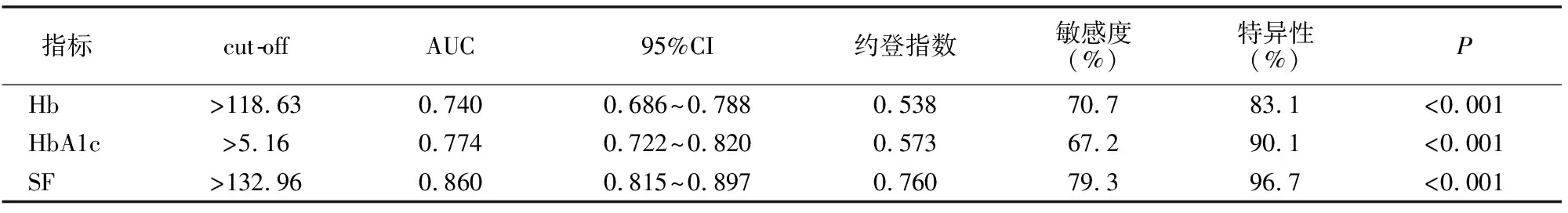
表5 孕早中期Hb、HbA1c、SF预测GDM发生的ROC曲线分析
2.6 GDM孕妇孕早中期Hb、HbA1c、SF与FPG相关性
GDM孕妇孕早中期Hb、HbA1c、SF水平均与FPG水平呈正相关(r=0.223、0.431、0.521,P均<0.05)。
3 讨论
目前多认为GDM发病与胰岛素抵抗有关,胰岛素不足或缺乏对体内微量元素平衡造成影响,加之孕期各类营养元素需求增多,尤其铁元素增高,孕妇普遍存在铁缺乏现象[13]。SF可反映机体铁负荷情况[14]。以往对孕期缺铁的报道多围绕对母婴不良结局影响展开,证实孕妇铁缺乏可导致不良结局[15-16],但高浓度SF对孕妇的影响尚缺乏关注。最新报道认为,妊娠期高浓度SF者发生糖耐量异常风险增大[17]。本研究发现,孕早中期GDM孕妇血清SF水平高于非GDM孕妇, SF预测GDM发生综合效能较高,提示SF异常增高可能与GDM发生有关。机制可能为:妊娠期间机体铁存储过多,导致SF浓度上升,过量铁元素沉积于胰岛细胞内催化生物氧化反应,大量氧自由基释放,引起过氧化应激反应,诱导胰岛β细胞凋亡,导致胰岛素分泌减少,造成胰岛素抵抗,引起血糖调节异常增加GDM风险。此外,妊娠期间机体自身处于低炎症水平状态,血清SF水平上升可能增加炎症反应水平,炎症环境下SF应激性上升,进一步影响胰岛素合成及分泌,造成胰岛素抵抗,诱导GDM发病[18]。本研究还发现,SF>132.96 μg/L时预测GDM敏感度、特异性较好,提示孕早中期SF对预测GDM诊断价值较高。建议对怀疑高危GDM产妇行唐氏综合征筛查时在孕早中期阶段开展SF筛查,以尽早筛出GDM高危人群;对SF异常增高孕妇适当提前行OGTT试验时间,尽早确诊GDM,并给予积极防控处理。
Hb为承担红细胞内运输氧功能的特殊蛋白质,孕期筛查时多用于评估孕妇生理及贫血情况[19]。以往认为低水平Hb与妊娠期贫血有关,是引起早产、产后出血等不良结局的重要原因[20]。近年来Hb与GDM的关系日益引起关注。越来越多证据显示,高水平Hb与机体铁过载有关,可能增加氧化应激反应,导致GDM发病[21-22]。本研究发现,GDM孕妇孕早中期血Hb水平较非GDM孕妇高,且Hb>118.63 g/L时预测GDM的敏感度、特异性较高,预测GDM价值尚可,与王扬等[23]结论相似。机制可能为:高Hb水平通常提示机体铁过载,铁离子具有强氧化特点,其过载可能引起氧自由基释放增多,影响骨骼肌及肝脏内胰岛素信号转导,引起胰岛β细胞氧化应激反应,损害胰岛β细胞功能,降低胰岛素敏感性,导致GDM发病。推测高Hb可能通过影响血液铁存储造成GDM发生。
HbA1c浓度与红细胞寿命及该时期内血糖波动情况紧密相关,可反映较早6~8周内平均血糖水平,已被纳入糖尿病诊断“金标准”[24]。妊娠早期机体红细胞周转速度加快,红细胞寿命缩短,FPG下降,葡萄糖糖化时间缩短,胎儿从母体获取葡萄糖增多,母体肾血流量、肾小球滤过率增加,但肾小管重吸收率无明显改变,受母体雌孕激素影响,可能造成孕早期HbA1c、FPG出现生理性降低[25]。但孕早中期,GDM孕妇母体抗胰岛素物质蓄积,血糖水平上调,引起HbA1c增高[26]。本研究发现,GDM孕妇孕早中期HbA1c水平高于非GDM孕妇,与胡智颖等[27]研究结果一致,提示HbA1c与GDM发病有关; HbA1c临界值为5.16%,此时预测GDM敏感度、特异性尚可, HbA1c对早期GDM诊断有一定价值,整体效能与Hb接近,但综合效能低于SF。考虑可能与HbA1c合成速度缓慢,短时间内血糖上升对HbA1c无较大影响有关,导致孕早中期HbA1c变化不及SF明显。本研究还发现,GDM孕妇孕早中期Hb、HbA1c、SF均与FPG呈正相关,但SF相关度最高,提示SF对GDM孕期血糖变化更为敏感,支撑高云鹤等[28]结论。本研究GDM孕妇早产、胎膜早破、羊水过多、巨大儿等不良妊娠结局发生率高于非GDM孕妇。与Li等[29]研究结果相似,提示GDM孕妇有更高的不良妊娠结局发生风险。
综上,GDM孕妇孕早中期Hb、HbA1c、SF水平高于非GDM孕妇,易出现妊娠不良结局;SF预测GDM综合效能较高。提示临床,对高GDM风险孕妇须尽早监测血Hb、HbA1c及SF水平,提早行OGTT筛查,尽早针对性干预以预防GDM,改善妊娠不良结局。

