自噬的检测方法及其在相关疾病中的研究进展*
窦婷婷,金 玲,池宇欣,赵云利
(蚌埠医学院公共卫生学院,安徽 蚌埠 233000)
自噬是真核细胞特有的“自食”现象,也是细胞进行自我保护的代谢途径[1],在多细胞生物遇到危险时可进行应激与防御调控。自噬发生时,胞内需降解的细胞器、蛋白质和部分胞质被膜包裹形成自噬体,而后与溶酶体等结合形成自噬溶酶体并对包裹内容物进行降解与回收,实现物质与细胞器的更新,维持胞内物质与能量供给的平衡[2]。自噬在维持细胞内稳态方面发挥着重要功能:在正常生理条件下,细胞通过较低水平的自噬持续维持细胞内稳态;而在细胞遇到能量供应短缺、缺氧、雷帕霉素等因素的刺激时,启动自噬可以使细胞缓解代谢压力,维持内环境稳定[3]。适度的自噬对维持细胞物质与能量的平衡是有益的,但过度的自我消化则会对细胞产生伤害,因此,自噬的调节有助于维持细胞的正常生理功能。为进一步加深对自噬及其检测方法的认识,本文从自噬的基本过程、自噬的检测方法及自噬的生物学功能等几个方面对自噬进行综述。
1 自噬的基本过程
根据自噬发生时底物进入溶酶体的途径和特点,可以将自噬分为巨自噬、微自噬以及分子伴侣介导的自噬三种类型。其中巨自噬的特征最明显,研究的也最为广泛与深入。
巨自噬是细胞质中的自噬底物被含有双层膜结构的自噬体包裹隔离,进而将自噬底物运送至溶酶体进行降解的过程。巨自噬是一个动态的过程,包括底物的识别、自噬体的形成、自噬体与溶酶体的融合以及自噬溶酶体的降解四个不同的步骤[4],见图1。
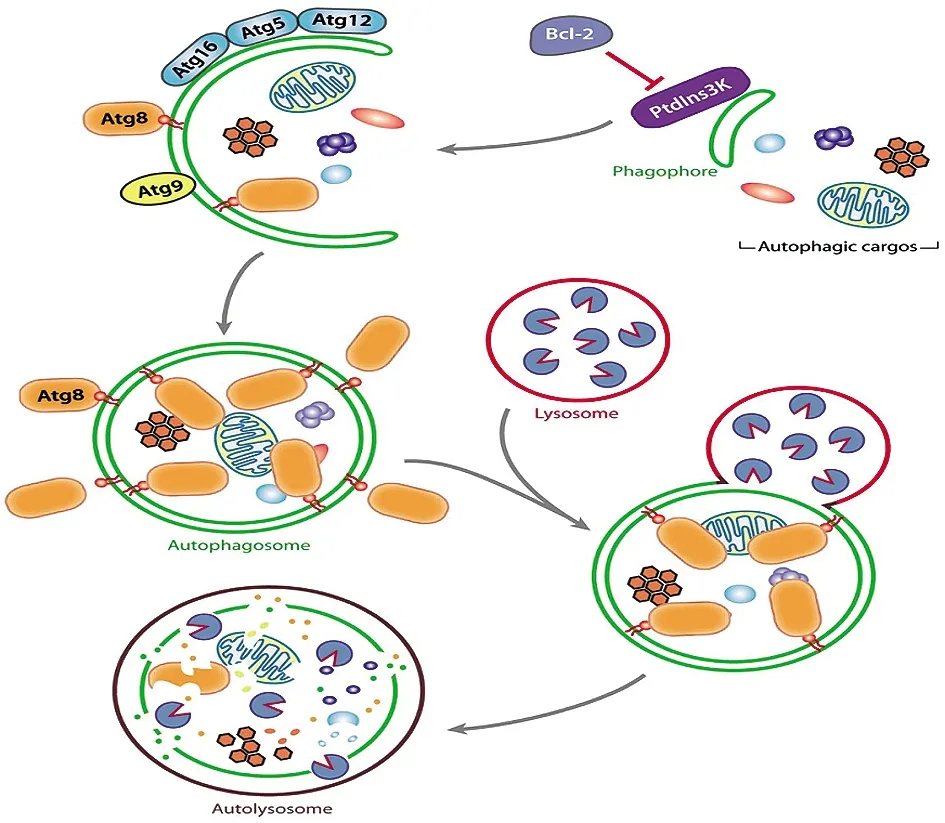
图1 巨自噬的基本过程[4]
1.1底物的识别 自噬的底物可以是衰老损伤的细胞器和折叠合成错误的蛋白质,也可以是外来侵入细胞的细菌和病毒。化学刺激或细胞成分的损伤与改变,如化学污染物、受损的线粒体和错误折叠的蛋白质等,都可被受体蛋白识别成为自噬底物。
1.2自噬体的形成 自噬体初始形成需要Ⅲ类磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)复合物来刺激吞噬膜的形成,且PI3K复合物能够与自噬相关蛋白(autophagy-related,Atg)联合将两个相关联的泛素样结合系统Atg12-Atg5-Atg16和Atg8-PE(磷脂酰乙醇胺,phosphatidyl ethanolamine,PE)结合到吞噬泡中,促使吞噬泡膜进一步延伸、弯曲至吞噬泡能够将自噬底物完全包裹并形成球状的自噬小体[5]。
1.3自噬体与溶酶体的融合 自噬体形成后,在微管蛋白的作用下,逐渐向溶酶体靠近,接着自噬体中的外层膜与溶酶体膜相融合,形成自噬溶酶体。其中,有些自噬体会先与核内体结合形成自噬内涵体[6],然后再与溶酶体结合。这一融合过程依赖于溶酶体膜蛋白(Lysosomal-associated membrane protein 2,LAMP-2)和N-乙基马来酰亚胺敏感因子附着蛋白受体(SolubleN-ethylmaleimide-sensitive factor attachment protein receptor,SNARE)蛋白等多种因子的联合作用[7]。
1.4自噬溶酶体的降解 大部分的Atg蛋白会与融合体分离,自噬溶酶体及自噬内涵体内的膜结构及所包裹的底物在溶酶体腔的酸性环境下经蛋白酶A、B及脂肪酶Atg15等作用降解释放进入再循环系统[8]。
2 自噬的检测方法
2.1形态学检测—透射电子显微镜(transmission electron microscope,TEM)检测 透射电镜下观察吞噬泡是目前最为直接和经典的自噬检测方法,通过TEM可以观察处于不同阶段的自噬体以及计数其数量从而判断自噬的发生水平[9]。在透射电镜下可以观察到新月状或杯状的吞噬泡、具有双层或多层膜包裹的液泡状自噬小体,但具体观察受实验者对于镜下自噬体结构的准确判断、观察样品的制备过程等的影响,因此会存在一些主观上的偏差,通常与其他检测方法结合使用。
2.2自噬相关蛋白-微管相关蛋白轻链3表达水平的检测 微管相关蛋白轻链3(microtubule-associated protein light chain,LC3)是自噬体双层膜上的标志性蛋白[10],其中水溶性的LC3-Ⅰ在经过泛素化作用后能与PE结合转化为脂溶性的LC3-Ⅱ。LC3-Ⅱ特异性定位于自噬体内膜和自噬溶酶体膜上,在自噬体与溶酶体结合后LC3-Ⅱ才逐渐分离降解。因此,可使用LC3-Ⅱ的表达量或者LC3-Ⅱ与LC3-Ⅰ的比值来检测自噬水平。
2.2.1绿色荧光蛋白(green fluorescent protein,GFP)-LC3单荧光质粒检测法 正常生理状态下,GFP-LC3结合蛋白分布于细胞质中,自噬发生时,GFP-LC3结合蛋白移位到自噬体内膜上表达出绿色荧光斑点[11],一个自噬体就表现为一个斑点,因而通过GFP-LC3单荧光质粒计数就可以评估自噬程度的高低。
2.2.2红色荧光蛋白(red fluorescent protein,RFP)-GFP-LC3串联荧光蛋白标签法 由于GFP荧光蛋白对酸敏感,在自噬小体与溶酶体结合后GFP荧光会淬灭从而给检测带来难度[12],而RFP相对稳定,因此可以采用RFP-GFP-LC3串联荧光蛋白检测自噬,即带有双标荧光信号的RFP-GFP-LC3-Ⅱ串联蛋白成功在细胞表达时,通过观察不同颜色的荧光信号强度的变化就可以判断出该细胞的自噬水平。
2.2.3GFP-LC3-RFP-LC3△G检测法 在Atg4的作用下,GFP-LC3-RFP-LC3△G串联荧光标签蛋白可被分割成GFP-LC3和RFP-LC3△G两个部分。其中GFP-LC3可在自噬过程中降解,而RFP-LC3△G不能与PE结合,故不作为自噬的降解底物[13]。因此,可通过测量GFP/RFP信号的比值可以反映自噬活性,这一方法在酵母的自噬检测中应用较多。
2.2.4Western blot检测法 Western blot检测LC3-Ⅱ蛋白表达水平是目前最为广泛的检测自噬流的方法。通常认为在Western blot实验中检测到LC3-Ⅱ的增多是LC3-Ⅰ向LC3-Ⅱ转化增多,代表了自噬流的活化;LC3-Ⅱ减少则代表自噬受到抑制[14]。
2.3自噬降解底物检测
2.3.1p62结合LC3-Ⅱ蛋白翻转实验法 p62是选择性自噬最重要的受体蛋白,能够连接待降解的泛素化底物与LC3-Ⅱ蛋白[15]。p62结合泛素化底物蛋白进入自噬小体,并与溶酶体结合形成自噬溶酶体,而后在溶酶体腔内的酸性水解酶作用下降解。当自噬流活化时,LC3-Ⅰ向LC3-Ⅱ转化,LC3-Ⅱ增多,p62水平下降,但自噬流受到抑制时p62含量上升,因此监测p62蛋白的水平就可以反映出自噬水平。
2.3.2长寿命蛋白(longevity protein Sir2)检测法 长寿命蛋白是可以被自噬降解的一类蛋白。真核细胞生物既可以通过蛋白酶体系统对短寿命蛋白进行降解,也可通过自噬对长寿命蛋白和受损细胞器进行降解。对长寿蛋白进行同位素标记,通过自噬降解蛋白产物的三氯乙酸-放射性同位素定量,进而反映自噬水平[16]。
2.4自噬诱导剂的应用
2.4.1雷帕霉素 哺乳动物雷帕霉素靶点(mammalian target of rapamycin,mTOR)是自噬的重要调控因子,可通过抑制自噬复合物ULK-ATG13-FIP200形成,从而抑制自噬过程的激活[17]。mTOR与不同蛋白结合可形成mTORC1及mTORC2两种复合物。另外,雷帕霉素还可以剂量依赖的方式激活Beclin-1基因表达,来增加自噬泡的形成。
2.4.23-甲基腺嘌呤(3-Methyladenine,3-MA) 研究证明3-MA选择性的作用于3型PI3K,主要是通过抑制Beclin-1-Ptdlns 3KC3复合物的形成来抑制细胞质内可溶性LC3-Ⅰ向可以与自噬体膜结合的LC3-Ⅱ形式转化,从而抑制自噬体的形成来完成对自噬的阻断[18]。
2.4.3二甲双胍 二甲双胍可通过不同的作用机制影响自噬的进展,主要作用与抑制mTORC1有关。mTORC1参与腺苷酸活化蛋白激酶(AMP-activated kinase,AMPK)的活化,AMPK通过激活Vps34复合物并磷酸化Beclin-1来诱导自噬[19]。当细胞能量水平受限时,AMPK可直接磷酸化酵母ATG1的同源物(unc-51 like autophagy activating kinase 1,ULK1),再磷酸化Beclin-1抑制mTORC1复合物来促进自噬。
3 自噬在相关疾病中的研究进展
细胞自噬的功能主要有两个方面:一是细胞的自我存活机制,当细胞处于胁迫状态下时,可通过自噬将胞质中部分底物进行降解形成小分子物质如氨基酸,核苷酸等,为细胞的存活和发展提供物质基础;另一方面,自噬可以清除细胞内折叠错误或变性的蛋白质,衰老损伤的细胞器等,维持细胞内稳态[20]。
3.1细胞自噬与肿瘤的发生
3.1.1自噬与肿瘤的发生 自噬在肿瘤的发生中起到了促进和抑制的双重作用。在肿瘤细胞生长前期,自噬通过降解肿瘤细胞内的受损细胞器或其他物质,可为肿瘤细胞的持续分裂增殖提供大量的营养物质,减少肿瘤细胞的凋亡和坏死而使其持续存在。研究表明,经c-myc诱导的鼠淋巴瘤中,使用自噬抑制剂(如氯喹)抑制细胞自噬活性时,由p53或DNA烷化剂诱导的肿瘤细胞死亡的有效性将增强,继而使肿瘤细胞消亡[21]。另一方面自噬可以抑制细胞癌变,如Fu等[22]发现持续的应激或自噬过度活化时,Beclin-1蛋白通过增强细胞自噬活性来抑制肿瘤的发生:Beclin-1基因敲除的小鼠,自噬活性降低,发生肺癌/肝癌或淋巴瘤的概率增加。依维莫司是一种雷帕霉素类似物,它可以通过阻止mTORC1的磷酸化来抑制PI3K/Akt/mTOR信号通路。
3.1.2自噬与肿瘤的发展 自噬既能抑制早期肿瘤的发生又能促进肿瘤的发展,其功能的发挥不仅取决于遗传因素,还与肿瘤的发展阶段以及肿瘤的类型等因素有关。正常情况下,自噬会对代谢应激损伤以及基因组的异常突变等起到一定的限制作用,从而抑制肿瘤的发生。研究表明,自噬相关ATG蛋白(如Beclin1)功能的丧失会增加肿瘤的发生风险[23]。自噬作用的转变发生在原发性肿瘤形成后:自噬在应对各种不良应激时会为肿瘤细胞提供存活和快速增殖提供物质和能量支持,从而促进部分肿瘤的晚期增长。Liang等[24]发现,在乳腺癌的上皮组织中Beclin1呈现低表达,而在正常细胞中表达明显升高;人乳腺癌MCF-7细胞株在稳定转染Beclin1后,其成瘤性明显降低,并且提高了肿瘤细胞的自噬程度。在癌细胞系中敲低或者删除必需自噬基因的表达可以降低其存活率和肿瘤发生,从而确立自噬在促进肿瘤发生发展的功能重要性。
3.2细胞自噬与神经退行性疾病 研究表明,自噬异常与神经退行性疾病之间密切相关。大多数神经退行性疾病是以进行性神经系统功能障碍为特征,主要是由于神经细胞内发生了蛋白的错误折叠或聚集而导致神经元进行性地损伤/变性和死亡,继而影响机体运动功能的异常及学习功能的障碍。神经退行性疾病的产生常伴有细胞自噬水平的下降,而激活的自噬可以通过清除神经元细胞中的异常蛋白从而阻碍与减缓神经退行性疾病的发生[25]。但过度激活的自噬通路又会导致胞内聚集大量的自噬体和自噬溶酶体,使神经元发生退化、变性甚至死亡。这类疾病主要包括帕金森病和阿尔茨海默病(Alzheimer's disease,AD)。
淀粉样蛋白-β(amyloid-β,Aβ)是由淀粉样前体蛋白(amyloid precursor protein,APP)经过β、γ分泌酶两次剪切而形成[26],其所致的神经炎性斑是AD的主要病理学改变。一些研究表明上调自噬作用会降低Aβ的表达水平,但在自噬体中也可以产生Aβ。研究表明AD神经元中堆积的自噬小体中含有早老蛋白-1(Presenilin-1,PS1)和APP,而其中的PS1是APP剪切形成Aβ所需的γ-分泌酶复合物的组成成分。敲除APP转基因小鼠中的ATG7基因,出现Aβ分泌的减少,这一现象与自噬仅仅降解了Aβ相违背[27]。因此,自噬在AD中的作用一直存在争议,这可能是因为自噬在疾病的不同阶段有着不同的作用,或者与自噬对淀粉样蛋白生命周期不同步骤的影响有关。
3.3细胞自噬与免疫应答 自噬可维持细胞内稳定,还可以保护细胞免受外来病原体的入侵。自噬最初被认为是一种原始防御系统,可抵御入侵的微生物,同时也在多种先天和适应性免疫途径中发挥作用。自噬可以结合入侵到细胞内的细菌和病毒形成自噬小体或者自噬内涵体,并将其转送至溶酶体进行降解。此外,自噬还可以将外来病原体的核酸转运至胞内相关感受器上引发机体自身的免疫反应。涉及自噬的主要免疫功能包括微生物降解/炎症控制/淋巴细胞稳态和免疫介质的分泌。自噬在先天免疫中可通过抑制炎症体的激活来抑制炎症,通过清除蛋白质聚集体、降解异常的线粒体和直接消除炎症体成分[28]。
3.3.1对病原体的反应 GROL[29]等的研究表明自噬可清除病原体,自噬能够定向的将待降解的病原体运送到溶酶体,如经CD400刺激作用可使自噬蛋白Beclin1的表达量增加,并且能够增强LC3的脂化作用。另一方面,有研究表明,病原体也会逃避自噬:小鼠在感染结核分枝杆菌后,自噬体中强毒株菌株可通过晚期核内标志物RAB7进行补充,形成中间区的两亲体,而没有被结核杆菌感染的细胞中的自噬体将会继续成熟为自溶体。此外,病原体还可以利用自噬来增强自身复制:无包膜的病毒产生自噬时,通过激活AMPK依赖型信号传导,干扰自噬膜的运输途径,可转运到病毒复制位点。
3.3.2免疫应答过程中的自噬调控 固有免疫与自噬研究表明,自噬可参与TLR、NLR、RLR信号通路等先天性免疫应答。RIG-1样受体(RLRs)可识别胞质中的病毒dsRNA,通过NF-κB途径,诱导产生大量干扰素及炎性细胞因子。Atg5和Atg12复合体可与RLR结合,从而抑制经该通路活化抗病毒时干扰素的产生[30];当复合物所必需的Atg7缺失时也会促进通路中干扰素的表达。适应性免疫与自噬,细胞自噬相关蛋白在与B细胞和T细胞的许多生理功能方面发挥重要作用。部分自噬相关蛋白,如Beclin1和Atg3,对T细胞的存活、发展及稳态起到重要作用。自噬能够维持内质网及线粒体的稳态,并能控制ROS的含量及功能,这都会直接影响T细胞的生存[31]。T细胞的活化选择性的诱导自噬降解细胞中折叠错误的蛋白质及功能紊乱的细胞器等,为T细胞的活化提供了能量基础。研究表明,Atg7敲除的Th细胞,经活化后不再分泌IL-2且增值能力大幅降低,这可能与自噬缺陷所导致的能量代谢缺陷有关。
3.4细胞自噬与细胞的分化和衰老 利用酵母菌/线虫和小鼠等进行的遗传研究表明,在限制热量/胰岛功能丧失和其他保守的长寿模式中,ATG基因是延长寿命所必需的[32]。系统性自噬诱导对小鼠具有抗衰老作用,自噬能力增强的基因工程小鼠寿命延长且改善了健康状况,例如胰岛素敏感性增加以及与年龄相关的自发性肿瘤发生率的降低。自噬可以通过改善细胞器质量控制体内平衡/增强胰岛素敏感性和促进基因组稳定性来防止衰老。ATG基因可能具有促进寿命的自噬独立效应,例如,它们在分泌和胞吐中的作用可能有助于组织间效应。
在线虫/小鼠和哺乳动物的一系列组织中,自噬基因表达和溶酶体功能会随着年龄的增长而下降,导致自噬能力的年龄相关性下降[33]。这种与年龄相关的衰退可能有助于老年相关疾病的发展,如神经退行性疾病和癌症。自噬作用会随着细胞的老化而减弱,同时,下降的自噬也会进一步加速细胞的衰老。在秀丽线虫的研究中发现,自噬相关基因Atg1和Atg6/Beclin1沉默的秀丽线虫寿命显著缩短,表明自噬的降低会促进衰老的进程。
3.5自噬与环境应激 有实验研究表明,一些环境化学物质,如重金属和颗粒物等,会对自噬过程起干扰作用[34]。细胞自噬在某些情况下能帮助细胞抵抗不良的环境应激,但不同的环境化学物质对自噬途径产生不同的影响,可能取决于其暴露的剂量、时间及作用的细胞类型等。如机体受到毒金属镉的刺激时,参与细胞能量生成途径的蛋白质会遭到破坏并引发活性氧(reactive oxygen species,ROS)的生成,而ROS的增加和mTOR系统的抑制会激活自噬。此外,镉暴露还可降低Atg5和LC3的表达,长期暴露还可干扰自噬体的融合[35]。
4 展望
自噬作用的意义是多方面的,它与细胞凋亡、细胞坏死一样,都是十分重要的生物学现象,参与细胞生物的生长、发育等多个过程,与人类多种疾病的发生发展存在着密切的关系。深入对自噬相关过程及机制的研究不仅会使我们对自噬这一现象有更深的认识,也将会为我们认识自噬相关疾病的发生发展提供依据。

