胃癌组织中Notch1与BPHL基因融合产物的表达及意义*
郑家雷,莫缓缓,方 向,胡 婷,周阳阳,苏 方
(1.蚌埠医学院第一附属医院肿瘤内科,安徽 蚌埠 233003;2.中国科技大学附属第一医院老年消化科)
胃癌是常见的消化道恶性肿瘤之一,发病率居全球肿瘤第四位,死亡率位居第三位[1]。我国胃癌发病率和死亡率在所有恶性肿瘤中均高居第二位[2]。随着手术、化疗、放疗、靶向及免疫治疗的综合治疗理念的普及和推广,一定程度上延长了患者的生存期和提高了生活质量,但根本上未改变胃癌高死亡率[1]。现阶段胃癌的治疗已经进入精准治疗阶段,如针对HER-2基因。胃癌HER-2基因的检测已经作为晚期胃癌临床治疗方案选择的依据。Notch异二聚体是高度保守的跨膜蛋白质,参与许多细胞进程包括干细胞维持、凋亡、增殖和分化等[3]。1991年Ellisen LW首次从人急性T淋巴细胞白血病中鉴定出来Notch1,提示Notch信号通路可能与肿瘤相关[4]。Yao等研究显示胃癌发生、发展的过程中Notch信号通路发挥着重要作用[5]。我们在临床工作中,通过对胃癌疑难病例的研究,在1例患者胃癌组织中检测到Notch1基因第34外显子断裂与BPHL基因第4内含子发生融合,丰度约为2.0 %,促使我们探索Notch1-BPHL融合基因在胃癌中表达水平及其基因突变的意义。
1 对象与方法
1.1对象 选取2018年5月至10月我院肿瘤外科50例初治、手术治疗且术后病理证实为胃癌患者的术后石蜡标本为研究对象。其中男性35例,占70.0 %,年龄23~72岁,中位年龄50岁;女15例,占30.0 %,年龄30~75岁,中位年龄52岁。病变局限于黏膜及肌层19例(占38.0 %),病变侵及浆膜层及临近组织31例(占62.0 %)。淋巴结阳性转移22例(占44.0 %),淋巴结无转移28例(56.0 %)。高、中分化程度20例(40.0 %),低、未分化30例(占60.0 %)。纳入标准:(1)年龄18~75岁。(2)蚌埠及周边地区常住人口。(3)既往无胃相关手术史。(4)术前未行靶向、化疗及放疗史。(5)临床及病理资料完整。(6)无自身免疫系统疾病和其他系统重大疾病。排除标准:(1)病理为贲门-食管结合部肿瘤。(2)合并其他恶性肿瘤。(3)临床或病理资料不完整者。
1.2方法 (1)Notch1-BPHL融合基因引物的设计:以Notch1和BPHL基因的cDNA全序列为依据,考虑到采用PCR拼接两个基因片段及最终试验目的,确定选择用于拼接的cDNA片段Notch1基因第1-34外显子部分与BPHL基因第5-7外显子部分。Oligo 6.0分析软件进行引物设计,Primer Premier 5.0软件设计PCR引物,引物在NCBI网站进行BLAST比对。最终确定碱基顺序:5'-3' GATGACCTGGGCAAGTCCG,3'-5'CAGCAGCATATGTCATTGTAGGAAGTCTTCTGC。(2)Trizol试剂提取标本组织中总RNA(3)琼脂糖凝胶电泳检查评价总RNA的完整性。(4)RT-PCR技术扩增目的基因。(5)凝胶电泳鉴定、紫外线灯下切胶。(6)DNA胶回收目的基因,ARMS基因检测法测序。
1.3统计学分析 应用SPSS 17.0统计软件进行分析。计数资料用[n(%)]表示,应用χ2检验比较。以P<0.05为差异有统计学意义。
2 结果
2.1Notch1与BPHL基因融合产物与胃癌临床病理关系 6例胃癌组织中检测到Notch1与BPHL基因融合产物,阳性率12.0 %,癌旁组织和正常胃黏膜未检测到融合基因产物;性别间Notch1与BPHL基因融合产物检出阳性率比较差异无统计学意义(P>0.05);是否淋巴结转移组间Notch1与BPHL基因融合产物检测阳性率比较差异有统计学意义(P<0.05);不同分化程度组间Notch1与BPHL基因融合产物检测阳性率比较差异有统计学意义(P<0.05);不同浸润深度组间Notch1与BPHL基因融合产物检测阳性率比较差异有统计学意义(P<0.05),见表1。Notch1与BPHL基因融合产物在正常黏膜、胃癌组织、转移淋巴结检测结果见图1、图2、图3。

图1 正常胃黏膜无Notch1与BPHL基因融合产物

图2 胃癌组织Notch1与BPHL基因融合产物
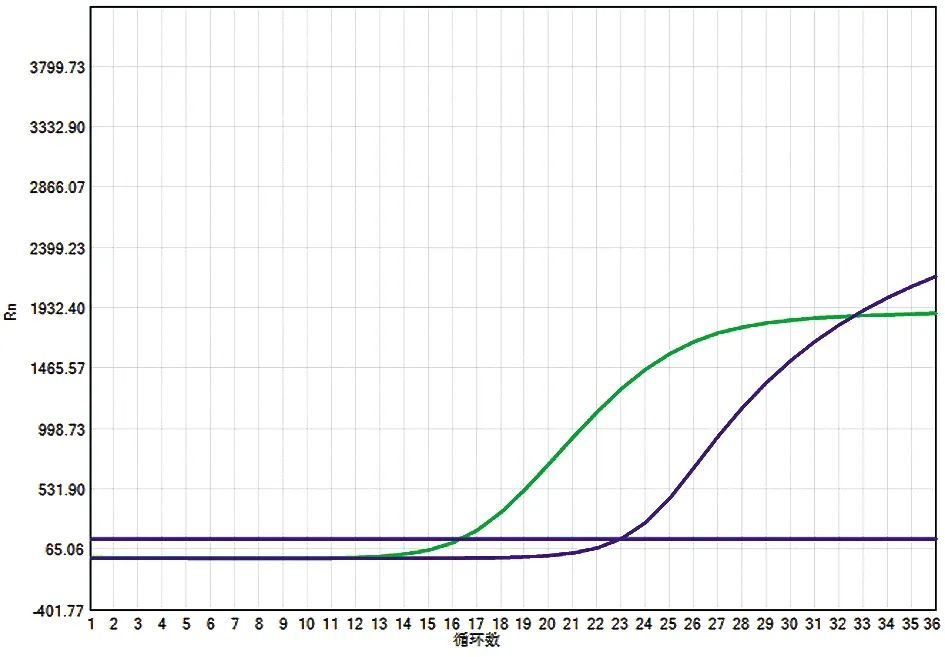
图3 转移的淋巴结组织中Notch1与BPHL基因融合产物
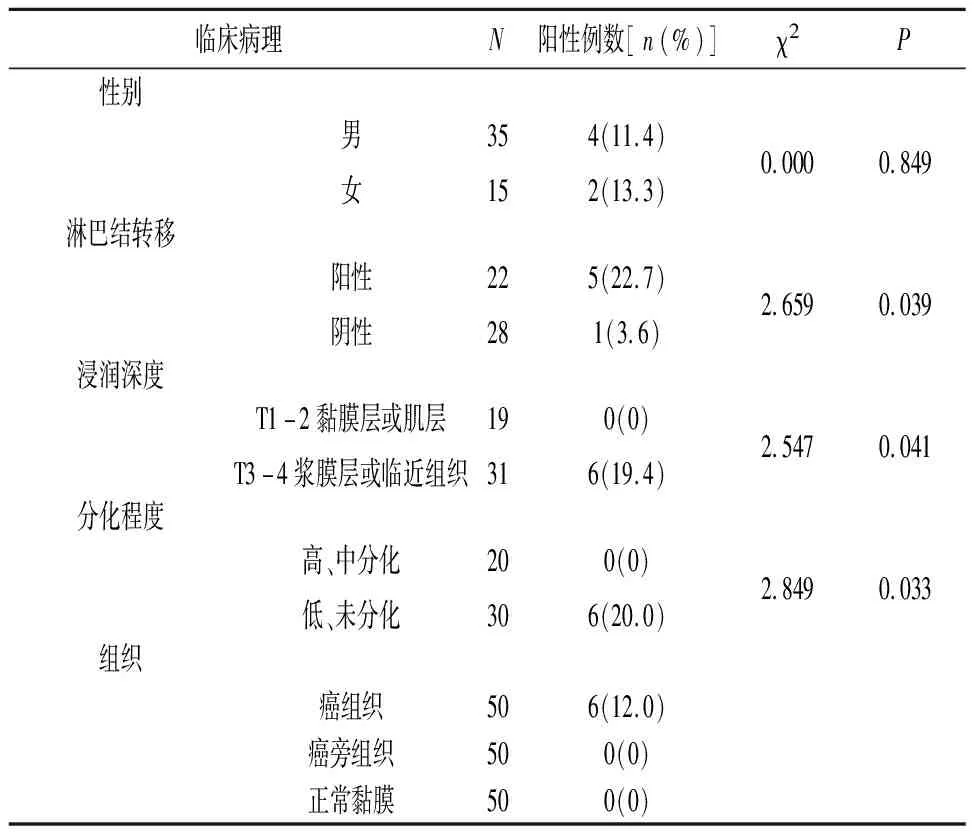
表1 Notch1与BPHL基因融合产物与胃癌临床病理关系
3 讨论
自1991年Ellisen LW等首次从人急性T淋巴细胞白血病中鉴定出来Notch1,通过t(7;9)(q34;q3403)使9号染色体的Notch1基因断裂,Notch1胞外区丢失,从而胞内区获得活性而表现出致癌作用,提示Notch信号通路可能与急性T淋巴细胞白血病相关[4]。随后研究表明,Notch通路对结直肠癌、乳腺癌等具有促进肿瘤进展的作用,而对于甲状腺癌、非小细胞肺癌等部分肿瘤起到抑癌作用[6]。更有研究结果显示,Notch1在同一种肿瘤的不同发展阶段或不同病理类型中作用不同,不但可表现为致癌作用,还可表现为抑癌作用[7-10]。另有部分研究表明,宫颈癌发生早期阶段Notch1为促癌作用, 晚期则为抑癌作用[11]。同样在胃癌的诸多研究中提示Notch信号通路在胃癌的发生、发展中发挥重要作用,但存在争议和分歧。有研究显示Notch1在胃癌组织中表达比正常组织明显升高,且与肿瘤的浸润、分化程度及大小显著相关[12-13]。另有研究提示Notch1在胃癌中表达下调,起抑癌作用,是预后良好的独立因素[14]。因此,目前胃癌发生、发展的过程中Notch信号通路的作用和机制没有得到明确阐明。人联苯样水解酶(BPHL)基因编码丝氨酸蛋白酶家族水解酶,水解活化核苷类似物的氨基酸酯前体药物(抗病毒药物)为无环鸟苷,可能在解毒过程中起作用[15]。目前也还没有发现关于BPHL与胃癌之间关系的相关研究。本研究结果表明Notch1与BPHL基因融合产物在胃癌组织、转移淋巴结表达率较癌旁组织及正常胃黏膜明显增加,低分化及未分化的胃癌组织中Notch1与BPHL基因融合产物表达较高、中分化的上调,在癌组织浸润较深的T3、T4病例中检测率明显高于T1、T2。以上结果提示胃癌组织中Notch1与BPHL基因融合产物高表达可能参与胃癌的浸润及转移。研究结论与国内周宁、黄博的研究结果显示胃癌组织中高表达Notch1受体,与患者的肿瘤预后、TNM分期、分化程度密切相关有异曲同工之处[16-17]。结合临床中对疑难胃癌病理基因二代测序检测到Notch1基因第34外显子断裂与BPHL基因第4内含子断裂发生融合,丰度约2.0 %。该融合产物可能为Notch1第1-34部分与BPHL第5-7外显子氨基酸结合;其中Notch1蛋白与正常蛋白相比,缺失第2 075-2 555位氨基酸,尚未曾见报道于肿瘤中,因此具体突变意义不能明确;若融合产物对Notch1蛋白功能产生影响,可能通过改变其参与的信号通路参与肿瘤发生、发展。
综上所述,本研究通过RT-PCR及ARMS基因检测Notch1与BPHL基因融合产物在胃癌组织、癌旁组织、转移淋巴结及正常黏膜中的表达,结果显示低分化、未分化、T3及T4的胃癌组织、转移淋巴结中融合基因表达上调,提示Notch1与BPHL基因融合产物可能参与胃癌的浸润及转移,对胃癌的诊断和治疗具有一定应用价值,但标本量较少,且Notch1与BPHL基因融合产物介导的下游通路、机制尚不明确,有待进一步扩大样本量及更多的研究进一步检测及验证,为胃癌的治疗提供新的靶点。

