中药中多炔类化学成分药理研究进展*
徐念智,李 兵
(广西中医药大学药学院,广西 南宁 530200)
多炔类化合物具有不饱和三键和烯的结构[1],广泛存在于自然界的陆生和海洋生物中,具有植物分类学意义[2-3]。按照官能团位置可将中药多炔类化学成分分为聚乙炔类、多炔苷类、炔醇类[4]、1,3-二炔类[5]和4,6-二炔类[6]。其化学性质、构型、来源和生物活性都相当丰富。研究表明中药中多炔类化合物具有抗肿瘤、抗抑郁、抗炎、调节血脂、营养等多方面药理作用[7-9]。此类化合物主要来源于五加科、菊科、伞形科、桔梗科等科属,是中药产生药理作用的重要物质基础,可作为基原鉴定的依据,是开发新药的来源。笔者总结了中药中多炔类化合物的药理作用研究进展,旨在为本类化合物的作用机制、构效、临床应用和相关药材质量控制提供参考。
1 药理作用
中药多炔类化学成分药理作用广泛。如人参炔醇类具有抗肿瘤、神经细胞保护、调节血脂、改善痤疮、负性肌力的作用;胡萝卜中的炔醇具有抗肿瘤、抗炎作用;柴胡炔醇具有抗抑郁、保肝和神经毒性作用;党参炔苷能增加雌二醇分泌和抗尿酸;此外,一些成分在体外表现出抗炎、细胞毒性、调节血脂的作用。
1.1 抗肿瘤中药多炔类化学成分对乳腺癌、胰腺癌、肺癌、肝癌和肠癌等多种肿瘤细胞均有抑制效果,具有多机制、多靶点、剂量依赖和协同作用的特点。近年来,关于中药多炔类化学成分抗肿瘤研究主要针对人参和胡萝卜中的相关化学成分。
1.1.1 人参炔醇类化学成分的抗肿瘤作用 五加科人参Panax ginseng C.A.Mey.中的炔醇类一直是研究热点,具有多机制、多靶点、剂量依赖和协同作用的抗肿瘤特点,其中人参环氧炔醇抗癌作用最强,与其环氧结构有关[10]。其抗肿瘤机制包括周期阻滞、促进凋亡、抑制转移等,人参炔醇(panaxynol,PNN)、人参环氧炔醇(panaxydol,PND)和人参炔三醇(panaxytriol,PXT)的结构和名称见图1。人参炔醇能诱导M2型巨噬细胞向M1型转化,重塑巨噬细胞表型和功能,从而抑制4T1乳腺癌细胞增殖、迁移、侵袭,减弱肿瘤细胞趋化[11]。人参炔醇和吉西他滨联用能抑制胰腺癌PANC-1细胞Ki-67和Bcl-2蛋白表达,降低肿瘤细胞干性、抑制其增殖,促进其凋亡[12]。人参炔醇通过与热休克蛋白90(heat shock protei,Hsp90)N端和C端ATP结合的方式,致其客户蛋白(client proteins)不稳定,从而清除肿瘤干细胞(cancer stem-like cells,CSCs)和非CSCs,进而消除非小细胞肺癌(non-small cell lung cancer,NSCLC)[13]。人参环氧炔醇能通过调节G1介导的蛋白表达,增强G1期NSCLC细胞内的游离钙离子[Ca2+]i水平,减弱NSCLC周期进程[14]。高浓度人参炔三醇(80 μmol/L)能通过组成性雄烷受体(constitutive androstane receptor,CAR)调控人肝癌HepG2细胞色素P3A4(cytochrome P3A4,CYP3A4)表达,作用中的CAR和孕烷X受体(pregnane X receptor,PXR)存在交互对话作用,调控后CAR能抑制PXR-CYP3A4通路[15-16]。人参炔三醇能通过核受体PXR介导人肝癌HepG2细胞中CYP3A4上调,干预24h后能上调PXR和CYP3A4的mRNA和蛋白表达[17-18]。
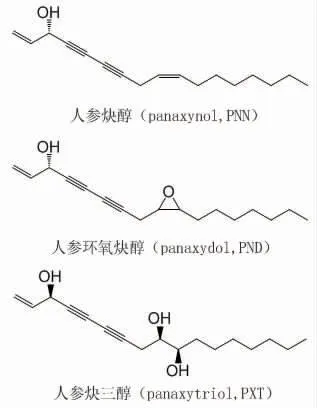
图1 人参炔醇、人参环氧炔醇和人参炔三醇结构和名称
1.1.2 镰叶芹醇和镰叶芹二醇的抗肿瘤作用 伞形科植物胡萝卜Daucus carota L.var.sativa Hoffm首载于《绍兴本草》,既是中药,也是常见蔬菜[19]。其含有的镰叶芹醇(falcarinol,FaOH)即人参炔醇,还含有镰叶芹二醇(falcarindiol,FaDOH),镰叶芹二醇的结构和名称见图2。镰叶芹醇和镰叶芹二醇联用对防治肠癌有积极作用,机制与调节菌群和改变炎症介质分泌有关。将镰叶芹醇和镰叶芹二醇添加进饲料中,可以使偶氮甲烷(azoxymethane,AOM)诱导的肠癌模型大鼠在18周后,小的异常隐窝病灶(aberrant crypt foci,ACF)减少34%,大的异常隐窝病灶减少57%,3 mm以上的肿瘤数量减少83%[20]。作用机制包括使肠癌模型大鼠肠道菌群,尤其是低含量类群的组成发生显著变化,下调NF-κB及其下游炎症标志物TNFα、IL-6,尤其是COX-2的量[21-22]。
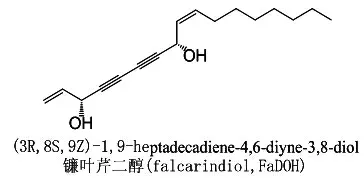
图2 镰叶芹二醇结构和名称
1.2 神经保护作用神经保护作用包括柴胡炔醇类化学成分的抗抑郁作用和人参炔醇类化学成分的神经保护作用。柴胡为伞形科北柴胡Bupleurum chinense DC或狭叶柴胡Bupleurum scorzonerifolium Willd的根。柴胡炔醇类集中于柴胡乙醇提取物的石油醚部位,是该部位的主要活性成分。
1.2.1 柴胡炔醇类的抗抑郁和神经毒性 柴胡的甲醇和水的提取物均有抗抑郁作用[23-25]。研究表明,逍遥散的20个入血成分中有9个来源于柴胡的化合物,经过筛选确认柴胡炔醇类为抗抑郁活性成分[26]。柴胡炔醇类化合物RB-5、RB-6、RB-7和RB-8在体外抑制去甲肾上腺素(noradrenaline,NE)再摄取作用与阳性药地西帕明相当,其中RB-6和RB-8为新化合物,结构和名称见图3[8]。张中晓[27]从分子水平和转录水平等揭示了柴胡石油醚部位可能存在的多种抗抑郁机制[27]。柴胡石油醚部位可能通过降低参与昼夜节律的生物钟基因Npas2和Rorc过度表达,从而抑制由促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)和皮质酮(corticosterone,CORT)过度分泌引起的情绪紊乱;并可能回调参与胆汁分泌与升高合成的基因Cyp7b1、Nceh1和Kcnn2而发挥作用;还能降低神经活性配体-受体相互作用中的蛋白质编码基因Prlr表达,通过多途径协同作用于慢性温和不可预知应激抑郁(chronic unpredictable mild stress,CUMS)模型大鼠发挥抗抑郁作用,柴胡毒素能抑制GABA受体,导致海马体内神经细胞因过度放电死亡,继而引起TH1/TH2免疫失衡、炎症反应和色氨酸代谢紊乱,半数致死量为3 mg/kg[27]。
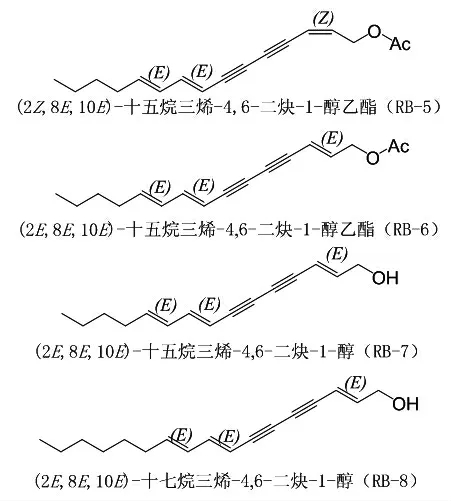
图3 化合物RB-5、RB-6、RB-7和RB-8的结构和名称
1.2.2 人参炔醇类的神经系统保护作用 人参有促进神经细胞生长,抑制乙酰胆碱酯酶活性的作用,或可运用于治疗人神经系统退行性疾病。人参环氧炔醇能通过cAMP-Epac1-Rap1-MEK-ERK-CREB途径,模拟神经生长因子(nerve growth factor,NGF)作用,促进PC12细胞轴突生长,是一种天然的Epac1受体激动剂[28]。研究表明属于人参炔醇类的2-1、2-2、2-3和2-4能竞争性抑制乙酰胆碱酯酶(acetyl cholinesterase,AchE)活性,其IC50分别为273、500、132和160 μmol/L,化合物结构和名称见图4[29]。
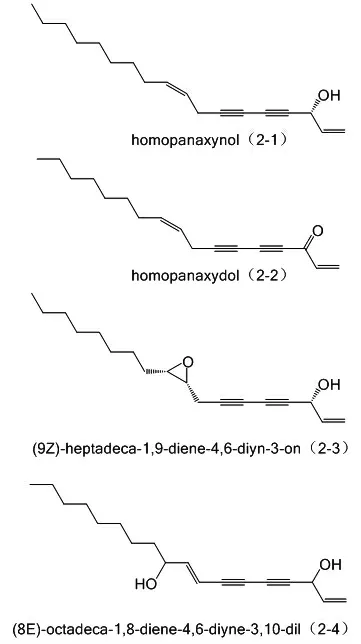
图4 化合物2-1、2-2、2-3、2-4的结构和名称
1.3 抗炎作用体外筛选表明中药多炔类化学成分具有抗炎活性,但尚未进行机制研究。苍术Atractylodes Lancea(Thunb.)DC.中化合物3-1在10 μmol/L浓度对脂多糖(lipopolysaccharide,LPS)诱导的小胶质细胞BV2产生一氧化氮(NO)有弱抑制作用[30]。葫芦科波棱瓜Herpetospermum caudigerum中herpecaudenes B(3-2)能显著抑制LPS诱导RAW264.7细胞产生NO的水平,IC50为(7.05±1.59)μmol/L[31]。盐蒿Artemisia halodendron Turcz.ex Bess.中新化合物3-3能抑制LPS诱导RAW264.7细胞NO、肿瘤坏死因子-α(tumornecrosis factor-α,TNF-α)和白细胞介素-6(interleukin-6,IL-6)水平,IC50分别为29.48、44.89、46.61 μmol/L[32]。化合物3-1、3-2、3-3结构及名称见图5。日常摄入水平的镰叶芹醇(5 mg/kg,2次/d)能通过Nrf2/Ho-1通路降低肠道刺激性基因IL-6、TNF-α/TNF-αr、INFγ、STAT3和IL-10/IL-10r的mRNA表达水平,对LPS诱导的CB57BL/6小鼠肠道炎症有保护作用[33]。
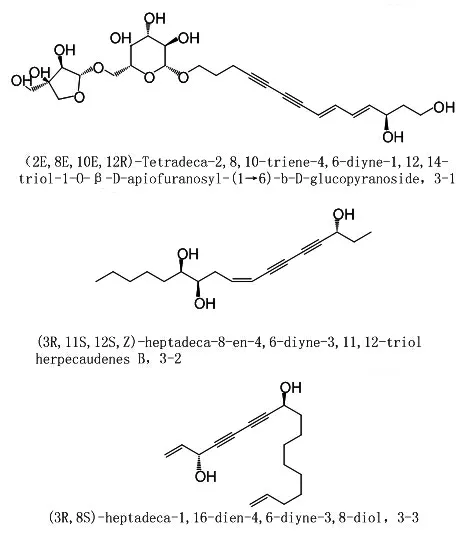
图5 化合物3-1、3-2、3-3结构及名称
1.4 调节血脂人参炔醇和兴安独活中新发现的3个聚乙炔糖苷类化合物有调节血脂活性。兴安独活Heracleum dissectum Ledeb.中化合物4-1、4-2和4-3为新发现的聚乙炔糖苷,在体外3T3-L1脂肪细胞中表现出较强的甘油三酯(triglycerides,TG)积累活性,结构及名称见图6[34]。人参炔醇能抑制活性氧(reactive oxygen species,ROS)的产生,以非过氧化物酶体增殖物激活受体-γ(peroxisome proliferator-activated receptor-γ,PPARγ)的方式恢复叉头框O1(forkhead box O1,FoxO1)蛋白的表达,从而增强FoxO1-C/EBPα转录复合物转录,逆转受损的3T3-L1细胞高脂蛋白脂联素(high-molecular weight,HMW)分泌[35]。
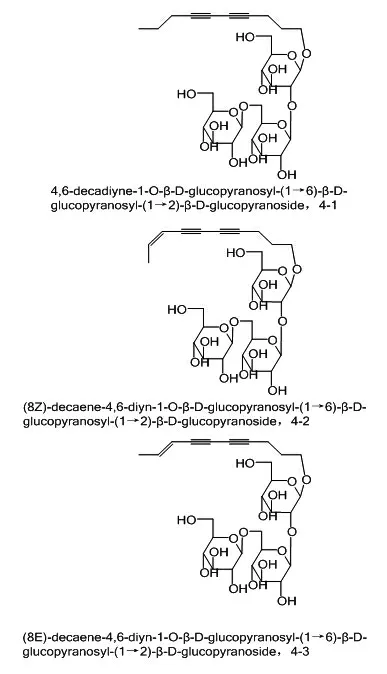
图6 化合物4-1、4-2、4-3结构及名称
1.5 其他作用中药多炔类化学成分还表现出抗氧化、抗疲劳、治疗痤疮、促进雌二醇(E2)分泌、保肝、抗尿酸和细胞毒性等作用。白术中化合物5-1在100 μmol/L时,能使HepG2细胞中抗氧化反应元件(antioxidant response element,ARE)的活性增强32.9倍[36]。腹腔注射人参环氧炔醇(0.10、0.25 mg/kg),能增加疲劳模型大鼠强迫游泳静止时间,降低血清乳酸脱氢酶(lactate dehydrogenase,LDH)水平[37]。以人参炔醇和人参环氧炔醇为有效成分的红参提取物能有效抑制痤疮丙杆菌,用其制成的乳膏可降低受试者氧化皮脂含量和皮肤红肿程度,明显改善痤疮早期至中期症状[38]。人参中的人参炔醇和人参环氧炔醇提取物(纯度>80%)对3T3-L1前脂肪细胞抗增殖的IC50分别为(13.52±3.05)g/mL和(3.69±1.09)g/mL[39]。
党参炔苷(lobetyolin,LBT)可通过cAMP和p38MAPK信号通路来促进卵巢颗粒细胞(granulosa cells of ovary,GCS)合成和分泌雌二醇(estradiol,E2),且不影响细胞增殖和正常分化[40]。人参炔醇对离体大鼠心脏有负性肌力作用,可能与降低心肌钙敏感度和降低心肌内钙浓度有关[41]。柴胡石油醚部位在1~25 g/kg范围内能降低血清谷丙转氨酶(alanine aminotransferase,ALT)和血清谷草转氨酶(glutamic oxaloacetic transaminase,AST)水平,表现出肝脏保护作用[8]。50 mg/kg剂量的党参炔苷能显著增强大鼠肝内黄嘌呤氧化酶(xanthine oxidase,XO)活性,抑制尿酸生成[42]。五加科屏边三七Panax stipuleanatus中新发现的化合物5-2对人表皮癌(KB)细胞IC50为10.05 μg/mL,结构及名称见图7[43]。

图7 化合物5-1、5-2名称与结构
2 药物代谢研究
多炔类化合物在人体内代谢性能良好,与血清蛋白结合的淬灭机制主要是静态淬灭。人参炔醇在大鼠体内血药经-时过程符合二室模型,呈线性动力学过程,代谢性能良好[44]。柴胡多炔RB-2和RB-4的代谢途径为氧化反应、葡萄糖醛酸结合反应等,介导柴胡多炔Ⅰ相代谢的主要酶是CYP2C9和CYP2E1酶,代谢性能良好[45]。镰叶芹醇、镰叶芹二醇和人参环氧炔醇可能在ⅢA域的Ⅱ位点单独结合人血清白蛋白(human serum albumin,HSA),体系猝灭是一个静态过程[46]。LBT主要以静电力与牛血清蛋白(bovine serum albumin,BSA)的ⅡA区位点Ⅰ结合,LBT-BSA体系以静态淬灭为主,相互作用力为静电作用力[47]。
3 成分含量研究
中药中多炔类化学成分种类丰富,含量稀少,不同基原和产地的药材中含量具有差异性,部分中药中多炔类化合物的含量见表1。柴胡中炔醇类有二十余种,其成分含量与药材基原、产地等均有关,采取优化提取条件、更新技术手段和人工合成的方法都能提高多炔类化合物产量[39,51-53]。五加科的三七[54]、北沙参[55]和刺人参[50],桔梗科的党参、半边莲[49]、川党参[56]、轮钟花[57]和兰花参[58],菊科的白术和苍术[59],伞形科的大叶柴胡、防风[60],以及番荔枝科山椒子[61]中均有发现多炔类化学成分。

表1 党参、半边莲、东北刺人参中多炔类化合物的含量
4 结语与展望
中药多炔类化学成分具有抗肿瘤、抗炎、神经保护、调节血脂、抗氧化、抗疲劳、治疗痤疮、促进雌二醇分泌、保肝、抗尿酸等多种药理活性。研究较为深入的主要是人参炔醇和柴胡炔醇等,及其具有的抗肿瘤、抗抑郁和神经保护作用。相关研究为阐明人参、柴胡等传统药物的有效成分及作用机制有重要意义,可为其质量控制研究提供参考。在人口老龄化加剧、抑郁症发病率逐渐增高的时代背景下,以上研究可为研发治疗肿瘤、抑郁和神经退行性疾病的药物提供先导化合物,有希望为治疗相关疾病开发出使用安全、作用良好的新药。
但就总体而言,中药中多炔类化合物的药理研究较少,研究结果缺少体内外的相互验证,许多药物的作用机制还不明确,应该加强相关研究。多炔类化合物在药材中分布广,但是含量较少,也是限制其研究的原因。使用更先进的分离设备,或者开发人工合成途径等方法,可获得满足实验用量的药物。现代药学研究者们从中药中提取、改进有效成分,已经开发出许多安全有效的新药。随着时间推移,关于中药中多炔类化合物一定会有更多研究成果。

