龙葵银消浸膏灌胃给药BALB/c小鼠14天的毒性评价*
朱聪聪,潘会君,喻 琴,连天雁,朱全刚,沈 敏
(上海市皮肤病医院,上海 200443)
银屑病,中国古籍常称为“白疕”“白癣”等,临床用药常以清热凉血解毒为主[1-2]。龙葵银消片(沪药制字Z05020300)是我院的特色中药制剂,由龙葵、凤尾草、紫草、白芷、山药5味中药组成,具有清热解毒、凉血祛风、匡扶正气的功效,临床用于治疗寻常型银屑病具有良好疗效[3-4],但尚未对该制剂进行安全性评价。现代药理学研究表明,君药龙葵含有的龙葵素,过度摄入轻者会出现恶心、呕吐、头晕、瞳孔放大等,重者可丧失知觉、休克,抢救不及时会导致死亡[5];龙葵碱具有胚胎毒性,并有致畸、致突变作用[6]。为了探究该制剂可能的潜在毒性,本研究开展龙葵银消浸膏连续灌胃给药BALB/c小鼠14 d的潜在毒性研究,从而为临床用药提供参考。
1 材 料
1.1 药物 龙葵(批号:190802)、凤尾草(批号:190704)、白芷(批号:190823)、山药(批号:190903)(上海虹桥中药饮片有限公司);紫草(上海蔡同德堂中药饮片有限公司,批号:19090202),经上海市皮肤病医院主任药师朱全刚鉴定,龙葵药材为茄科植物龙葵Solanum nigrum L.的全草;凤尾草药材为凤尾蕨科植物凤尾草Pteris multifida Poir.的全草;紫草为紫草科植物新疆紫草Arnebia euchroma(Royle)Johnst.的干燥根;白芷为伞形科植物白芷Angelica dahurica(Fisch.ex Hoffm.)Benth.et Hook.f.的干燥根;山药为薯蓣科植物薯蓣Dioscorea opposita Thunb的干燥根茎。
1.2 试剂 生理盐水(山东齐都药业有限公司,批号:20190 42203);10%福尔马林中性组织固定液(南昌雨露实验器材有限公司,批号:190908);无水乙醇(上海凌峰化学试剂有限公司,批号:20200319);盐酸(上海凌峰化学试剂有限公司,批号:20151105);氨水(上海凌峰化学试剂有限公司,批号:20161123);中性树胶(国药集团化学试剂有限公司);高效切片石蜡(上海华永石蜡有限公司);苏木素-伊红染液(武汉赛维尔生物科技有限公司)。
1.3 主要仪器JS6-01型大称量电子天平(上海浦春计量仪器有限公司);ZNHW型电热套(上海予申仪器有限公司);OSB-2100型水浴锅(上海爱朗仪器有限公司);SHZ-Ⅲ型循环水真空泵(郑州长城科工贸有限公司);载玻片(武汉赛维尔生物科技有限公司);盖玻片(江苏世泰实验器材有限公司);JB-P5型包埋机(武汉俊杰电子有限公司);RM2016型病理切片机(上海徕卡仪器有限公司);JB-L5型冻台(武汉俊杰电子有限公司);全自动生化分析仪(深圳雷杜生命科技有限公司)。
1.4 实验动物6~8周龄SPF级BALB/c小鼠20只,雌雄各半,体质量(20±2)g,购自上海杰思捷实验动物有限公司,生产许可证号:SCXK(沪)2018-0004。小鼠分笼饲养于动物房,5只/笼,自由摄食与饮水,环境温度(22±2)℃,相对湿度(55±5)%。本实验经同济大学机构伦理委员会批准,并按照机构指南进行。
2 实验方法
2.1 药物制备 称取各中药材饮片并置10倍温水中浸泡30 min,第一次煎煮2 h,第二次8倍水煎煮1 h。合并滤液,低温静置过夜。取上清液旋转蒸发进行浓缩,将黏稠浓缩液放至-80℃预冻3~4 h,随后利用真空冷冻干燥机进行干燥并打粉,形成龙葵银消干浸膏粉。
2.2 剂量设计 参考药物重复给药毒性试验技术指导原则[7],采用最大给药量进行灌胃给药。折算成每只小鼠一天给予量最多为0.375 g干浸膏粉,相当于375倍成人临床剂量。
2.3 动物分组及给药 按参考文献中方法[8-9],将20只小鼠按体质量随机分为空白组和给药组,雌雄各半,每组10只。取龙葵银消干浸膏粉0.3 g,用0.4 mL纯水溶解,得含干浸膏粉浓度为0.75 g/mL的龙葵银消浸膏。给药组每天给予龙葵银消浸膏0.5 mL,空白组给予同体积的生理盐水,连续给药14 d。
2.4 观察指标
2.4.1 体质量 每日记录小鼠体质量,观察各组体质量增长情况。
2.4.2 AST、ALT、BUN、CREA、UA血液生化学检测 末次给药后,利用摘眼球取血法采血,离心取血清,检测血清肝肾功能生化指标,包括谷草转氨酶(AST)、谷丙转氨酶(ALT)。肾脏功能指标包括血尿素氮(BUN)、血肌酐(CREA)、尿酸(UA)。
2.4.3 脏器系数 末次给药后对小鼠进行麻醉、解剖,取肝脏、心脏、脾脏、肺脏、肾脏组织进行称量脏器质量,计算各脏器系数,脏器系数=脏器质量/体质量×100。
2.4.4 病理组织学检查 将小鼠肝脏、心脏、脾脏、肺脏、肾脏组织用4%多聚甲醛固定24 h以上,进行石蜡包埋切片,片厚4 μm,进行HE染色,在光学显微镜下观察。
2.5 统计学方法 采用SPSS 26.0统计软件进行分析,计量资料采用“均数±标准差”(s)表示,对各组进行正态性检验与方差齐性检验,采用单因素方差分析。重复测量数据采用重复测量方差分析,数据经Mauchly球对称检验,若P>0.05,则认为该数据满足球对称假设;反之则不满足球对称假设,则用Greenhouse-Geisser法对组内效应的F界值进行校正。以P<0.05为差异有统计学意义。
3 结 果
3.1 两组小鼠不同时间点体质量比较 给药前后不同时间小鼠体质量比较,差异有统计学意义(F=7.656,P<0.001),即存在时间效应,两组均如此,说明空白组和给药组小鼠的体质量均随时间的推移而发生明显变化。两组小鼠体质量总体比较,差异有统计学意义(F=36.610,P<0.001),即存在分组效应,说明不同组别对小鼠体质量变化具有显著性影响。第0、4天给药组小鼠的体质量低于空白组,但差异无统计学意义(P>0.05);第8、12、14天给药组小鼠体质量明显低于空白组(P<0.05)。时间和组别不存在交互效应(F=3.281,P=0.068>0.05),说明不同组别的小鼠体质量虽然随着时间的推移而发生变化,但差异无统计学意义。(见图1、表1)
表1 两组小鼠在不同时间点的体质量比较
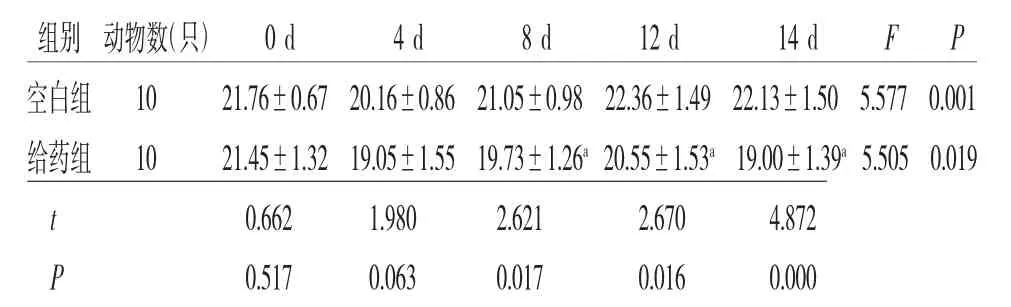
表1 两组小鼠在不同时间点的体质量比较
注:F分组主效应=36.610,P分组主效应<0.001;F时间主效应=7.656,P时间主效应<0.001;F交互效应=3.281,P交互效应=0.068;与空白组比较,aP<0.05
组别 动物数(只) 0 d 4 d 8 d 12 d 14 d F P空白组 10 21.76±0.67 20.16±0.86 21.05±0.98 22.36±1.49 22.13±1.50 5.577 0.001给药组 10 21.45±1.32 19.05±1.55 19.73±1.26a 20.55±1.53a 19.00±1.39a 5.505 0.019 t 0.662 1.980 2.621 2.670 4.872 P 0.517 0.063 0.017 0.016 0.000
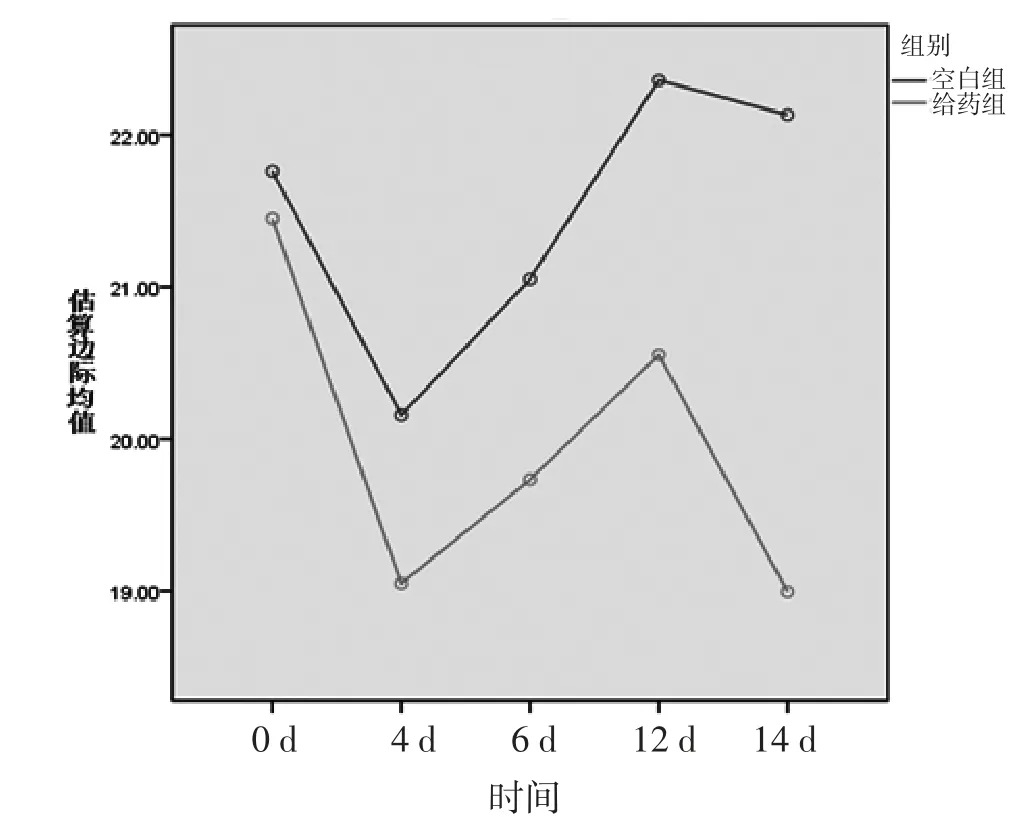
图1 交互效应轮廓图
3.2 两组小鼠血清肝肾功能生化指标比较 给药组小鼠血清CREA水平低于空白组(P<0.05),血清BUN、UA、AST、ALT水平与空白组比较,差异无统计学意义(P>0.05)。(见表2)
表2 两组小鼠血清肝肾功能生化指标比较
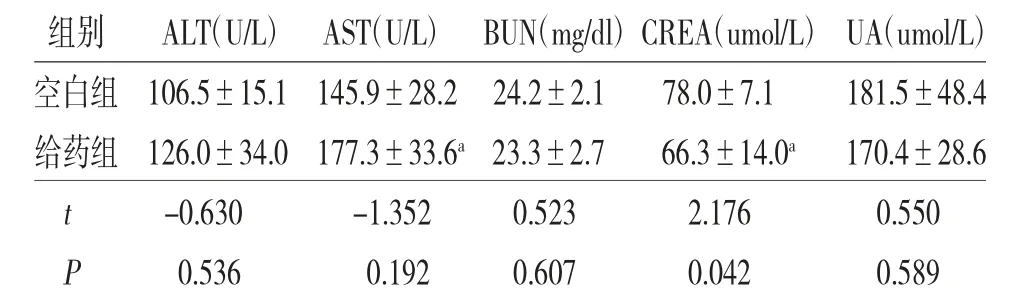
表2 两组小鼠血清肝肾功能生化指标比较
注:与空白组比较,aP<0.05
组别 ALT(U/L)AST(U/L)BUN(mg/dl)CREA(umol/L)UA(umol/L)空白组106.5±15.1 145.9±28.2 24.2±2.1 78.0±7.1 181.5±48.4给药组126.0±34.0 177.3±33.6a 23.3±2.7 66.3±14.0a 170.4±28.6 t -0.630 -1.352 0.523 2.176 0.550 P 0.536 0.192 0.607 0.042 0.589
3.3 两组小鼠脏器质量和脏器系数比较 给药组小鼠脾脏质量及脾脏系数低于空白组(P<0.05),心脏、肺脏、肝脏、肾脏质量及脏器系数与空白组比较,差异均无统计学意义(P>0.05)。(见表3~4)
表3 两组小鼠脏器质量比较

表3 两组小鼠脏器质量比较
注:与空白组比较,aP<0.05
组别 动物数(只) 心脏质量 肝脏质量 脾脏质量 肺脏质量 肾脏质量空白组 10 0.14±0.02 0.93±0.10 0.09±0.01 0.17±0.02 0.35±0.05给药组 10 0.14±0.02 0.91±0.32 0.08±0.01a 0.17±0.02 0.33±0.04 t-0.953 -0.335 -2.905 0.238 -1.369 P 0.353 0.741 0.010 0.815 0.188
表4 两组小鼠脏器系数比较
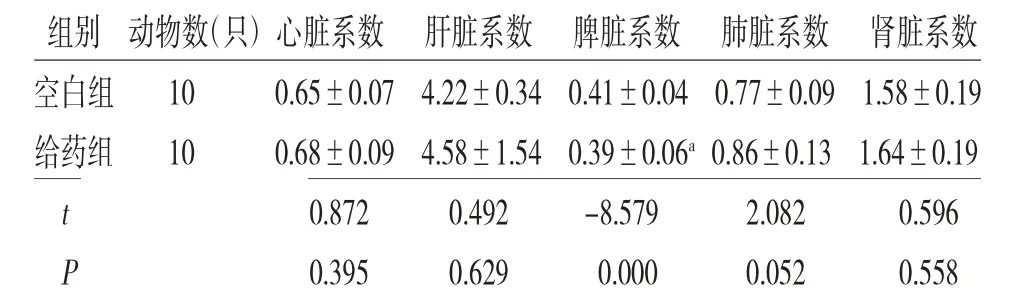
表4 两组小鼠脏器系数比较
注:与空白组比较,aP<0.05
组别 动物数(只)心脏系数 肝脏系数 脾脏系数 肺脏系数 肾脏系数空白组 10 0.65±0.07 4.22±0.34 0.41±0.04 0.77±0.09 1.58±0.19给药组 10 0.68±0.09 4.58±1.54 0.39±0.06a 0.86±0.13 1.64±0.19 t 0.872 0.492 -8.579 2.082 0.596 P 0.395 0.629 0.000 0.052 0.558
3.4 病理学检查结果 病理组织学检查发现龙葵银消浸膏连续给药14 d后,给药组心脏组织染色均匀,心肌纤维排列整齐,脾脏组织形态结构清晰,肺组织细支气管形态结构未见明显异常,与空白组比较,未显示出明显的心脏、脾脏、肺脏毒性。但是对肝脏、肾脏病理切片观察发现,给药组肝脏、肾脏局部出现病理组织学改变,主要表现为肝脏存在炎症细胞浸润,肾脏存在轻微肾间质轻微淤血等现象(箭头所示)。(见图2)
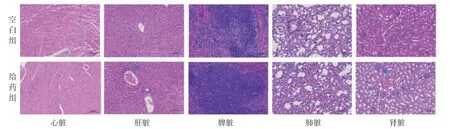
图2 两组小鼠各脏器组织病理切片图(HE,×200)
4 讨 论
毒性试验是评价药物安全性的重要环节。本研究采用BALB/c小鼠,连续14 d灌胃给予龙葵银消浸膏,考察了小鼠对龙葵银消浸膏的毒性反应。第0、4天给药组小鼠的体质量低于空白组,但差异无统计学意义(P>0.05);第8、12、14天给药组小鼠体质量明显低于空白组(P<0.05)。对脏器系数考察中发现,给药组小鼠脾脏质量、脾脏系数低于空白组(P<0.05)。对各脏器进行组织病理学检查发现肝脏、肾脏出现病理组织学改变,肝脏局部有炎症反应,肾脏则表现为肾间质轻微淤血。为了进一步探究龙葵银消浸膏对小鼠肝肾功能的影响,笔者对小鼠血清进行了肝肾功能生化学检测。AST、ALT是临床常见的肝功能检查指标,结果显示给药组小鼠血清CREA水平低于空白组(P<0.05),血清AST、ALT BUN、UA水平与空白组比较,差异无统计学意义(P>0.05)。
肝脏、肾脏是药物排泄的主要器官,发生毒性反应的概率要大于其他脏器。因此药物毒性研究中比较重视肝肾的毒性研究[10]。目前国内外关于龙葵和紫草不良反应尤其是肝肾损伤的报道日益增多。澳洲茄碱和澳洲茄边碱是龙葵的有效成分,具有抗炎、抗过敏、抗肿瘤等多种药理作用[11-12]。有研究显示,龙葵碱具有肝毒性,与影响肝脏中CYP450基因表达有关[13]。新紫草作为方中臣药,具有清热凉血、解毒透疹的功效。现代药理学研究表明紫草具有抗炎、抗肿瘤作用,临床常用来治疗银屑病[14]。但紫草含有的吡咯里西啶生物碱具有肝毒性,口服能引起大鼠尿中牛磺酸、氧化三甲胺及二甲基甘氨酸含量的持续增高[15-17]。另外,紫草有效成分紫草素、乙酰紫草素等萘醌色素类及提取物均显示毒性[18-20]。由于君药臣药均含有肝肾毒性成分,可能是导致肝脏及肾脏病理变化的原因。因此本研究提示临床使用过程中勿过量服用,长期服用时应注意药物对肝脏、肾脏可能存在的潜在影响。由于本研究针对龙葵银消浸膏对小鼠毒性只基于病理学及血液生化学研究,该药物的肝肾损伤仍需进一步深入机理研究。

