青光安颗粒剂含药血清对RGC5细胞损伤模型线粒体自噬及相关蛋白的影响
刘倩宏 陈立浩 时健 朱冰瑶 曾令聪 姚小磊
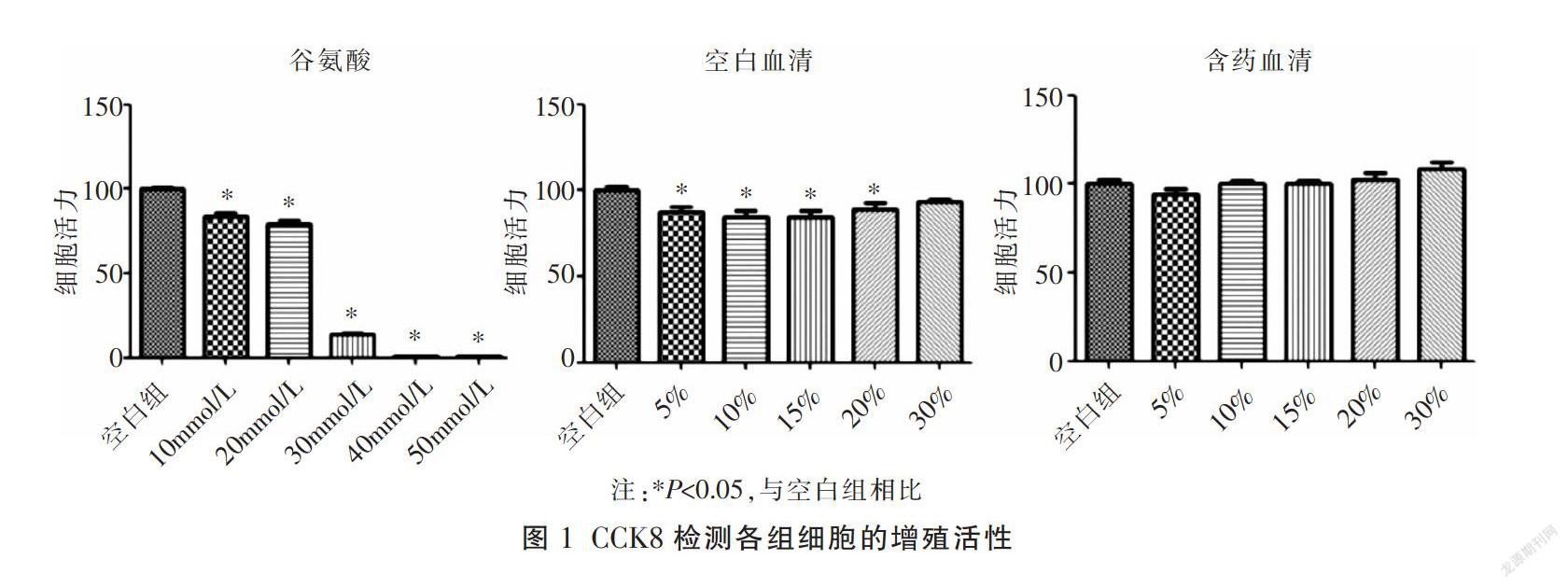


〔摘要〕 目的 觀察青光安颗粒剂含药血清对视网膜神经节细胞-5(retinal ganglion cells-5, RGC-5)损伤模型中线粒体自噬和相关蛋白的影响。方法 将14只大鼠随机分为空白对照组(3只)和青光安组(11只)。青光安组灌胃青光安颗粒剂,空白对照组灌胃同等剂量的生理盐水,1次/d,灌胃7 d,第7天灌胃后提取含药血清和空白血清。培养RGC-5细胞,用谷氨酸毒性模拟青光眼所造成的神经细胞损伤,CCK8法筛选合适的含药血清和谷氨酸浓度。细胞分组为正常细胞组、空白血清组(谷氨酸+空白血清)、含药血清组(谷氨酸+含药血清)、3-甲基腺嘌呤(3-methyladenine, 3-MA)+空白血清组(谷氨酸+3-MA+空白血清)、3-MA+含药血清组(谷氨酸+3-MA+含药血清组)。细胞培养24 h后,荧光共定位检测线粒体自噬发生情况;Western blot检测微管相关蛋白轻链3(microtubule associated protein light chain 3, LC3)中LC3-Ⅱ/LC3-I、溶酶体相关膜蛋白1(lysosome associated membrane protein1, LAMP1)蛋白的表达。结果 通过CCK8结果筛选,确定谷氨酸最佳的作用浓度为20 mmol/L,空白血清和含药血清的作用浓度均为20%。与空白血清组相比,含药血清组、3-MA+空白血清组和3-MA+含药血清组的溶酶体含量显著降低(P<0.05)。与空白血清组相比,含药血清组、3-MA+空白血清组和3-MA+含药血清组中LAMP1和LC3-Ⅱ/LC3-I蛋白表达水平均显著降低(P<0.05);与3-MA+空白血清组相比,3-MA+含药血清组中LAMP1和LC3-Ⅱ/LC3-I蛋白表达水平水平显著降低(P<0.05)。结论 青光安颗粒剂含药血清对青光眼损伤的保护作用可能通过抑制细胞的线粒体自噬,调控LAMP1和LC3-Ⅱ/LC3-I蛋白的表达,从而起到对RGCs的保护作用。
〔关键词〕 青光眼;视网膜神经节细胞;青光安颗粒剂;谷氨酸;3-甲基腺嘌呤;微管相关蛋白轻链3;溶酶体相关膜蛋白1
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.10.008
Effects of Serum Containing Qingguangan Granule on Mitochondrial Autophagy and Related Proteins in RGC5 Cell Injury Model
LIU Qianhong1,2, CHEN Lihao1,2, SHI Jian1,2, ZHU Bingyao1,2, ZENG Lingcong1,2, YAO Xiaolei1,2,3*
(1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Key Laboratory of Hunan Province for Prevention and Treatment of Eye, Ear, Nose and Throat Diseases with Traditional Chinese Medicine, Changsha, Hunan 410208, China; 3. The First Affiliated Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China)
〔Abstract〕 Objective To observe the effect of serum containing Qingguangan Granule on mitochondrial autophagy and related proteins in retinal ganglion cells-5 (RGC-5) injury model. Methods 14 rats were randomly divided into blank control group (n=3) and Qingguang'an group (n=11). Qingguang'an group was given Qingguang'an Granule by intragastric administration, and the blank control group was given the same dose of normal saline once a day for 7 days. The drug-containing serum and blank serum were extracted after 7 days of intragastric administration. RGC-5 cells were cultivated, and glutamate toxicity was used to simulate nerve cell damage caused by glaucoma, CCK8 method was used to screen appropriate drug-containing serum and glutamate concentration. Cells were grouped into: normal cell group, blank serum group (glutamate + blank serum), drug-containing serum group (glutamate + drug-containing serum), 3-methyladenine (3-MA) + blank serum group (glutamate + 3-MA + blank serum), 3-MA + drug-containing serum group (glutamic acid + 3-MA + drug-containing serum). After the cells were cultured for 24 hours, fluorescence colocalization was used to detect the occurrence of mitochondrial autophagy; the expression levels of LC3-II/LC3-I and lysosome associated membrane protein 1 (LAMP1) in microtubule associated protein light chain 3 (LC3) were detected by Western blot. Results Through the screening of CCK8 results, it was determined that the optimal concentration of glutamic acid was 20 mmol/L, and the concentration of blank serum and drug-containing serum were both 20%. Compared with the blank serum group, the lysosome content of the drug-containing serum group, the 3-MA + blank serum group and the 3-MA + drug-containing serum group were significantly reduced (P<0.05). Compared with the blank serum group, the LAMP1 and LC3-II/LC3-I protein expression levels in the drug-containing serum group, 3-MA + blank serum group and 3-MA + drug-containing serum group were significantly reduced (P<0.05). Compared with the 3-MA + blank serum group, the LAMP1 and LC3-II/LC3-I protein expression levels in the 3-MA + drug-containing serum group were significantly lower (P<0.05). Conclusion The protective effect of serum containing Qingguangan Granule on glaucoma injury may be through inhibiting cell mitochondrial autophagy and regulating the expression of LAMP1 and LC3-II/LC3-I, thereby playing a protective effect on RGCs.
〔Keywords〕 glaucoma; retinal ganglion cells; Qingguangan; glutamate; 3-methyladenine; microtubule associated protein light chain 3; lysosome associated membrane protein 1
青光眼为累计视神经及视觉功能的一组疾病,是目前一种不可逆性致盲眼病,其中,中老年患者占据多数,且发病率逐年增高[1]。视网膜神经节细胞(retinal ganglion cells,RGCs)在青光眼的治疗与防控中起到重要作用,研究[2]表明,青光眼中多种危险因素均可启动多种凋亡相关通路,如死亡受体、内质网凋亡、线粒体凋亡通路,触发核酸内切酶活化,导致RGCs的凋亡,从而造成不可逆性损伤。线粒体自噬是一种分解代谢过程,参与细胞质内物质成分的分离和溶酶体降解,对维持细胞内环境的稳定至关重要[3]。线粒体自噬广泛存在于中枢神经系统。在青光眼发生发展的过程中,RGCs自噬溶酶体含量增高,从而引起RGCs的凋亡[4]。青光眼状态下,线粒体自噬增强,存在对RGCs的保护作用[5-6];但更深入的研究[7-10]发现,如果产生自噬的线粒体没有通过完整的自噬途径,那么,自噬本身还会使线粒体通透性增加,线粒体中细胞色素C释放入胞浆中,导致RGCs凋亡的发生。青光安颗粒剂(以下简称“青光安”)是湖南中医药大学第一附属医院的院内制剂,前期研究[11-12]证明,青光安对青光眼患者有良好的疗效,能有效改善患者视力、视野、血液流变学等指标,具有良好的临床应用前景。因此,本研究采用青光安含药血清作用于体外培养RGCs,通过Western blot检测药物作用后及3-甲基腺嘌呤(3-methyladenine, 3-MA)阻断剂干预后引起的线粒体自噬及相关指标表达变化,以探明青光安对RGCs线粒体自噬的调节作用,阐明青光安保护视神经的作用机制,以期为中药复方的研发提供理论依据。
1 材料与方法
1.1 实验动物
Wistar大鼠14只,雄性,体质量140~200 g,许可证号:SCXK(沪)2018-0006,购自上海西普尔-必凯实验动物有限公司。在温度20~26 ℃、湿度40%~70%的环境中饲养。
1.2 药物及细胞来源
青光安(黄芪30 g,茯苓20 g,白术10 g,赤芍10 g,生地黄10 g,地龙10 g,红花5 g,盐车前子20 g)购于湖南中医药大学第一附属医院,将115 g青光安超微颗粒用生理盐水50 mL加热溶解,配置成每毫升含生药2.3 g药材的青光安溶液。RGC-5细胞(批号:CC-Y2138)购于上海酶研生物科技有限公司。
1.3 主要试剂和仪器
HAM'S F-12营养液培养基(Kaighns改进型)(21127022,赛默飞世尔科技(中国)有限公司);CCK8法细胞增殖检测试剂盒(KGA317,江苏凯基生物技术股份有限公司);线粒体绿色荧光探针(C1048,上海碧云天生物技术有限公司);溶酶体红色荧光探针(C1045,上海碧云天生物技术有限公司);3-MA[189490-50MG,默克生命科學(上海)有限公司];CO2培养箱(BPN-80CW,上海一恒科学仪器有限公司);倒置荧光显微镜(MF53,广州市明美光电有限公司);洁净工作台(BBS-SDC,博科控股集团有限公司);全自动酶标仪(WD-2102B,北京六一生物科技有限公司);离心机(TD4A,长沙英泰仪器有限公司)
1.4 含药血清的制备与干预
随机选取3只大鼠为空白组,其余11只为青光安组。适应性喂养7 d后,按体表面积折算的临床等效剂量计算,青光安组灌胃5.625 mL/(kg·d)青光安溶液,空白组用生理盐水灌胃,1次/d,灌胃7 d,第7天灌胃后1 h用1%戊巴比妥钠腹腔注射麻醉,腹主动脉采血。离心提取含药血清和空白血清。将收集的血清在56 ℃下灭活补体30 min,按组别混合后放于-80 ℃冰箱。
1.5 RGC-5细胞处理
1.5.1 细胞培养 清洗、消化、离心后将细胞悬液分配至准备好的培养皿中,做好标记,将细胞置于 37 ℃、5% CO2培养箱中。
1.5.2 分组方法 将细胞分为正常细胞组、空白血清组(谷氨酸+空白血清)、含药血清组(谷氨酸+含药血清)、3-MA+空白血清组(谷氨酸+3-MA+空白血清)、3-MA+含药血清组(谷氨酸+3-MA+含药血清组)。
1.5.3 细胞干预方法 以谷氨酸毒性模拟青光眼损伤模型,其中谷氨酸为20 mmol/L的浓度,20%的空白血清、青光安含药血清加入,3-MA以5 mmol/L的浓度用作自噬抑制剂,培养24 h。
1.6 指标检测
1.6.1 CCK8检测 将RGC-5细胞消化、重悬,计数,铺板,细胞密度为7 000个/孔;待细胞贴壁后,分别加入10、20、30、40、50 mmol/L的空白血清、含药血清和谷氨酸,24 h后换成普通的培养基,加入CCK8试剂,后使用酶标仪在450 nm波长处检测吸光值,计算不同药物浓度作用下细胞的增殖抑制率。
细胞增殖抑制率=(1-实验孔OD值/对照孔OD值)×100%
1.6.2 免疫荧光共定位 在各组细胞培养板中加入线粒体探针和溶酶体探针的培养液200 μL置于孵育箱37 ℃ 30 min;滴加Hoechst 33342染色液避光孵育30 min,对标本进行染核,然后在荧光显微镜下观察采集图像。
1.6.3 Western blot检测 提取总蛋白后用BCA试剂盒测定蛋白浓度。蛋白变性,上样,电泳2 h,转膜80 min。一抗(Mouse Monoclonal Anti-GAPDH,用一抗稀释液稀释,浓度为1∶2 000)孵育过夜;二抗[辣根酶标记山羊抗鼠IgG(H+L)用二抗稀释液稀释,浓度为1∶2 000]室温孵育2 h。采用ImageJ软件分析LAMP1、LC3-I及LC3-II内参条带灰度值。
1.7 统计学分析
采用SPSS 21.0进行分析,符合正态分布及方差齐性检验数据以“x±s”表示,方差齐者用单因素方差分析,方差不齐者采用Satterthwaite方法进行校正t检验,非正态分布采用Wilcoxon秩和检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 CCK8筛选合适的血清和谷氨酸浓度
与空白组细胞相比,5个谷氨酸浓度都显著抑制了细胞增殖,且随着浓度的增加效果更显著(P<0.05);空白血清在浓度为5%、10%、15%和20%时显著抑制了细胞增殖(P<0.05);含药血清在任何浓度都对细胞增殖没有影响。根据本研究及前期研究结果得出,谷氨酸的作用浓度为20 mmol/L,空白血清和含药血清的作用濃度均为20%。见图1。
2.2 荧光共定位检测自噬发生的情况
与正常细胞组相比,空白血清组的细胞核、线粒体、溶酶体数量差异无统计学意义(P>0.05);与空白血清组相比,含药血清组、3-MA+空白血清组和3-MA+含药血清组的溶酶体含量显著降低(P<0.05)。见图2-3。
2.3 Western blot检测谷氨酸损伤细胞相关蛋白表达的情况
与正常细胞组相比,空白血清组、含药血清组、3-MA+空白血清组和3-MA+含药血清组中的LAMP1和LC3-Ⅱ/LC3-I的蛋白表达水平均显著增加(P<0.05);与空白血清组相比,含药血清组、3-MA+空白血清组和3-MA+含药血清组中LAMP1和LC3-Ⅱ/LC3-I蛋白表达水平均显著降低(P<0.05);与3-MA+空白血清组相比,3-MA+含药血清组中LAMP1和LC3-II/LC3-I蛋白表达水平显著降低(P<0.05)。见图4。
3 讨论
青光眼是一种老年眼疾病,大多数患者为60岁以上。由于预期寿命的延长,青光眼的发病率呈上升趋势[13],青光眼患者最终的治疗目的即维持视觉功能与生活质量,但目前没有治疗方法可以逆转由青光眼造成的视神经病变与RGCs的损伤。事实上,即使成功控制了眼压,视神经和RGCs的进行性损伤也可能继续。因此,保护视神经以及RGCs成为青光眼治疗过程中不可忽视的环节。尽管许多学者对视神经保护药物做出了许多研究,但疗效以及给药剂量仍处于探索阶段,如何对青光眼造成的RGCs损伤进行保护,成为了青光眼治疗的重点环节[14]。
青光眼即中医学中的“五风内障”,在五轮辨证中属于“水轮”,房水属中医学“神水”范畴,本病由于风火痰郁等上犯目窍,至目珠局部气滞血瘀、神水瘀积,神光不得发越所致,治疗上应活血利水,以通血脉、开玄府、宣瘀滞、缩瞳神为基本原则。青光安是湖南中医药大学第一附属医院自制中药方剂,以黄芪、白术、茯苓益气健脾利水,生地黄、赤芍清热凉血,红花活血通经、祛瘀止痛,车前子利水、清肝明目,地龙利尿通络,全方共奏益气养阴、活血利水之功[15]。前期研究[5,6,13,16-18]表明青光安对于急性高眼压模型中的视网膜、视神经及筛板有保护作用,对其术后有抑制瘢痕增生的作用;青光安含药血清能够使青光眼滤过性手术细胞模型自噬增加,降低结膜下瘢痕生成,从而达到青光眼滤过性术后抗瘢痕化作用。
青光眼状态下,通过调控自噬相关通路能够影响RGCs凋亡过程:一方面,有学者证实自噬的增加促进视网膜神经节细胞的存活[19-20];另一方面,实验证明,细胞自噬能够引起神经节细胞层视网膜神经元的丢失,导致RGCs的凋亡,而通过阻断自噬通路,则能够有效减少细胞凋亡的发生[21-22],因此,自噬的调节作用仍然是未知的。前期研究[5,23-25]发现青光安能够抑制视网膜细胞凋亡,对青光眼模型起到保护作用,青光安含药血清能够阻断凋亡相关信号传导系统而抑制细胞的凋亡。
神经元细胞高度依赖于线粒体自噬的效率,神经退行性疾病与线粒体自噬通路的功能障碍息息相关。青光眼所致视神经病变是致盲的主要原因,而RGCs是视网膜视觉通路的最后一个细胞元件,是投射到视网膜外的唯一神经元,随着青光眼发生过程,RGCs即出现进行性凋亡,从而导致视神经病变。当线粒体受损或功能障碍时,PINK1在线粒体外膜聚集,并且募集Parkin到线粒体膜上,使线粒体外膜蛋白泛素化,泛素化蛋白被受体蛋白识别(RGCs的受体蛋白为optineurin);同时,LC3通过与optineurin等受体蛋白结合,LC3-I将转变为脂质形式LC3-Ⅱ,其与自噬体的外膜和内膜相关联,使线粒体被自噬小泡包裹,随后的吞噬泡的延展与LC3-Ⅱ/LC3-I的比率相关,形成自噬体,最终线粒体在溶酶体内降解,此为线粒体自噬的终末环节,而LAMP1作为一种溶酶体相关蛋白,其表达代表了溶酶体的活性变化[26-31]。
LC3-Ⅱ/LC3-I的比率水平已被用于监测线粒体自噬,这个比例反映自噬过程是否完整[10]。
通过CCK8实验发现,含药血清在任何浓度都对细胞增殖没有影响。根据本研究及课题组前期研究[6,18,32]结果确定,含药血清的作用浓度为20%。通过使用谷氨酸毒性模拟青光眼所造成的神经细胞损伤模型,研究发现当RGCs损伤时,青光安含药血清及3-MA阻断剂能够抑制细胞中线粒体自噬发生;与空白血清组相比,LC3-Ⅱ/LC3-I蛋白在含药血清组、3-MA+空白血清组和3-MA+含药血清组中的表达水平均显著降低;与3-MA+空白血清组相比,LC3-Ⅱ/LC3-I蛋白在3-MA+含药血清组中的表达水平显著降低,说明在视神经受到损伤后,细胞内线粒体自噬增加,而通过抑制线粒体自噬途径,或者通过青光安含药血清的干预,降低了线粒体泛素化途径的中途相关蛋白表达,使得RGCs无法通过泛素化途径完成自噬过程,且青光安的调控作用比线粒体阻断剂显著;与空白血清组相比,LAMP1及LC3-Ⅱ/LC3-I蛋白在含药血清组、3-MA+空白血清组和3-MA+含药血清组中的表达水平均显著降低;与3-MA+空白血清组相比,LAMP1蛋白在3-MA+含药血清组中的表达水平显著降低,说明线粒体自噬抑制剂以及青光安能够在RGCs受损时通过调控线粒体自噬终端相关蛋白,减少细胞中溶酶体的形成,减少线粒体自噬的发生,从而起到RGCs的保护作用,且作用优于线粒体阻断剂。
综上所述,青光安含药血清能够降低LAMP1蛋白的表达及LC3-Ⅱ/LC3-I的比值,抑制线粒体自噬的发展,由此推测,青光安能够对RGCs起到保护作用,其作用是否与线粒体自噬相关通路引起的抑制凋亡作用有关,其具体机制有待进一步研究。
参考文献
[1] 戴 毅,孙兴怀.从流行病学角度认识青光眼的特点与危害[J].中国眼耳鼻喉科杂志,2016,16(3):179-181.
[2] 吴姗姗,田庆梅,高延娥,等.青光眼视神经节细胞凋亡的作用机制研究进展[J].眼科新进展,2019,39(9):882-885.
[3] 黄昌泉,汪 耀,吴仁毅.自噬与青光眼关系的研究进展[J].国际眼科纵览,2014,38(6):366-369.
[4] LIN W J, KUANG H Y. Oxidative stress induces autophagy in response to multiple noxious stimuli in retinal ganglion cells[J]. Autophagy, 2014, 10(10): 1692-1701.
[5] 羅向艳.青光安含药血清对TGF-β1干预下HTFs自噬的影响[D].长沙:湖南中医药大学,2018.
[6] 喻 娟,罗向艳,彭清华.青光安颗粒含药血清对TGF-β1诱导的人tenons囊成纤维细胞自噬的影响[J].中医药导报,2019,25(5):
34-39.
[7] VAN HUMBEECK C, CORNELISSEN T, VANDENBERGHE W. Ambra1: a Parkin-binding protein involved in mitophagy[J]. Autophagy, 2011, 7(12): 1555-1556.
[8] VAN HUMBEECK C, CORNELISSEN T, HOFKENS H, et al. Parkin interacts with Ambra1 to induce mitophagy[J]. Journal of Neuroscience, 2011, 31(28): 10249-10261.
[9] RODRíGUEZ-MUELA N, BOYA P. Axonal damage, autophagy and neuronal survival[J]. Autophagy, 2012, 8(2): 286-288.
[10] COUGHLIN L, MORRISON R S, HORNER P J, et al. Mitochondrial morphology differences and mitophagy deficit in murine glaucomatous optic nerve[J]. Investigative Ophthalmology & Visual Science, 2015, 56(3): 1437-1446.
[11] COLEMAN A L. Glaucoma[J]. The Lancet, 1999, 354(9192): 1803-1810.
[12] 于莎莎,赵 云,汤 欣.视神经损伤药物治疗的研究进展[J].眼科新进展,2019,39(3):291-295.
[13] 蒋鹏飞,黄学思,彭 俊,等.青光安有效组分对兔青光眼术后滤过道瘢痕组织中胶原纤维、成纤维细胞特异性蛋白-1、结缔组织生长因子及转化生长因子-β1表达的影响[J].中国中医药信息杂志,2019,26(5):59-63.
[14] 吴权龙,彭清华,赵海滨,等.青光安颗粒剂对兔急性高眼压视网膜的保护作用[J].中国中医眼科杂志,2004,14(4):208-210.
[15] 彭清华.眼科活血利水法的研究[M].北京:中国中医药出版社,2018.
[16] 赵海滨,彭清华,吴权龙,等.青光安颗粒对兔急性高眼压视神经轴突的保护作用[J].国际眼科杂志,2009,9(12):2318-2321.
[17] 李晓静,彭清华,曾志成,等.复方中药青光安对兔慢性高眼压筛板结构及Ⅳ型胶原纤维含量的影响[J].国际眼科杂志,2009,9(12):2310-2314.
[18] 曾志成,彭清华,李 波,等.中药青光安含药血清对体外加压后人小梁细胞凋亡的影响机制[J].国际眼科杂志,2009,9(6):1046-1050.
[19] RODRíGUEZ-MUELA N, GERMAIN F, MARI O G, et al. Autophagy promotes survival of retinal ganglion cells after optic nerve axotomy in mice[J]. Cell Death & Differentiation, 2012, 19(1): 162-169.
[20] DENG S F, WANG M, YAN Z C, et al. Autophagy in retinal ganglion cells in a rhesus monkey chronic hypertensive Glaucoma model[J]. PLoS One, 2013, 8(10): e77100.
[21] LI R, JIN Y P, LI Q, et al. MiR-93-5p targeting PTEN regulates the NMDA-induced autophagy of retinal ganglion cells via AKT/mTOR pathway in Glaucoma[J]. Biomedicine & Pharmacotherapy, 2018, 100: 1-7.
[22] 汪霄瑞.探索自噬抑制剂3-甲基腺嘌呤在视网膜缺血损伤后的保护作用和机制[D].福州:福建医科大学,2019.
[23] 李银鑫,蒋鹏飞,曾志成,等.青光安Ⅱ号方有效组分对青光眼模型DBA/2J小鼠视网膜中RhoA、ROCK及caspase-3蛋白表达的影响[J].湖南中医药大学学报,2020,40(6):673-678.
[24] 周亚莎,徐 剑,彭 俊,等.青光安Ⅱ号对慢性高眼压模型大鼠视网膜GSK-3β及β-catenin mRNA表达影响[J].湖南中医药大学学报,2017,37(10):1049-1051.
[25] 彭清华,曾志成,李 波,等.青光安颗粒含药血清对加压后人小梁细胞活性的影响[J].国际眼科杂志,2009,9(5):839-842.
[26] BAE J Y, PARK H H. Purification and characterization of a ubiquitin-like system for autophagosome formation[J]. Journal of Microbiology and Biotechnology, 2010, 20(12): 1647-1652.
[27] VAZQUEZ-MARTIN A, CUFI S, COROMINAS-FAJA B, et al. Mitochondrial fusion by pharmacological manipulation impedes somatic cell reprogramming to pluripotency: New insight into the role of mitophagy in cell stemness[J]. Aging, 2012, 4(6): 393-401.
[28] WONG Y C, HOLZBAUR E L F. Optineurin is an autophagy receptor for damaged mitochondria in parkin-mediated mitophagy that is disrupted by an ALS-linked mutation[J]. PNAS, 2014, 111(42): E4439-E4448.
[29] SATOO K, NODA N N, KUMETA H, et al. The structure of Atg4B-LC3 complex reveals the mechanism of LC3 processing and delipidation during autophagy[J]. The EMBO Journal, 2009, 28(9): 1341-1350.
[30] TANIDA I, MINEMATSU-IKEGUCHI N, UENO T, et al. Lysosomal turnover, but not a cellular level, of endogenous LC3 is a marker for autophagy[J]. Autophagy, 2005, 1(2): 84-91.
[31] WU Z M, WANG H G, FANG S Y, et al. Roles of endoplasmic reticulum stress and autophagy on H2O2 induced oxidative stress injury in HepG2 cells[J]. Molecular Medicine Reports, 2018: 18(5): 4163-4174.
[32] 彭 抿,彭清華,李建超,等.青光安颗粒剂含药血清对体外培养大鼠视网膜神经节细胞调亡的实验研究[J].医药世界,2006,7(7):84-85.

