伴失眠的肝肾阴虚型系统性红斑狼疮患者睡眠结构与Treg细胞、细胞因子的关系研究
胡晓辉,吕婷婷,刘春莹
(1.陕西中医药大学第一临床医学院,陕西 咸阳 712000;2.空军军医大学唐都医院,陕西 西安 710038;3.陕西中医药大学附属医院,陕西 咸阳 712000)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种自身免疫性疾病,病变部位在全身结缔组织,且常多系统、多脏器受累。而SLE中医辨证类型较多,较常见的为热毒血瘀、肝肾阴虚、风湿痹阻及气血亏虚四型。其中,SLE病程后期以肝肾阴虚型多见,该型患者多伴有失眠。肾阴虚是引起失眠的重要病机,肝肾同源,故肝肾阴虚是导致失眠的关键所在。研究显示,外周血Treg细胞表达异常或者数量变化,引起体内T细胞和B细胞功能紊乱,导致过多自身抗体及细胞因子产生,最终引起SLE发病。而有关Treg细胞及细胞因子在肝肾阴虚型SLE患者表达及与其睡眠结构变化是否存在潜在的关系,查阅文献罕有报道。本文拟通过观察伴失眠的肝肾阴虚型SLE患者睡眠结构、Treg细胞、细胞因子表达变化,探讨研究肝肾阴虚型SLE患者免疫功能紊乱与失眠的关系,失眠程度与Treg细胞及细胞因子表达的相关性。现报告如下。
1 资料与方法
1.1 诊断标准 依据美国风湿病学会(ACR)1997年推荐的SLE诊断标准及SLE疾病活动度评分(SLEDAI)标准[1],并参照2002年国家药品监督管理局修订的《中药新药临床研究指导原则(试行)》[2]中SLE中医辨证标准。失眠西医诊断符合2001年《CCMD-3中国精神障碍分类与诊断标准》[3]中诊断标准,中医诊断符合1993年《中药新药临床研究指导原则(第一辑)》[4]中制定的失眠中医诊断标准。
1.2 纳入标准(1)符合以上所述西医诊断及中医证候标准的受试者;(2)年龄18~70周岁;(3)SLEDAI积分为非活动期患者(SLE-DAI≤10分);(4)匹兹堡睡眠质量指数(Pittsburg sleep quality index,PSQI)总分>7分;(5)入组前2周内没有相关镇静安神类药物服用史;(6)自愿参与本研究并签署知情同意书;(7)临床资料完备,并能接受定期随访。
1.3 排除标准 重度SLE活动型患者;合并其它风湿病或自身免疫性疾病者;合并各系统靶器官严重病变、血液病、肿瘤、各种急性感染及精神病等为非SLE所致者;合并认知功能障碍,无法完成PSQI测评者;不能耐受多导睡眠监测者;近半年内使用免疫抑制剂者;哺乳期或者妊娠期妇女;对本研究不能耐受者。
1.4 研究对象及分组 选取2018年7月至2019年9月在陕西中医药大学附属医院风湿肾病二科就诊的SLE患者63例,其中男11例,女52例;年龄35~70(50.92±7.88)岁。本研究通过陕西中医药大学附属医院伦理委员会的伦理审核,所有受试者均签署知情同意书。纳入患者分为3组:肝肾阴虚型SLE组(LKYD-SLE)、短期失眠肝肾阴虚型SLE组(SI-LKYD-SLE)、长期失眠肝肾阴虚型SLE组(LI-LKYD-SLE),各21例。其中,LKYD-SLE组不伴失眠,SLEDAI≤10分;SI-LKYD-SLE组失眠≤3个月,SLEDAI≤10分;LI-LKYD-SLE组失眠>3个月,SLEDAI≤10分。
1.5 观察指标(1)测评PSQI、汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)、汉密尔顿抑郁量表(Hamilton depression scale,HAMD)、多导睡眠监测(PSG)相关睡眠参数(睡眠潜伏期、觉醒次数、觉醒时间、睡眠效率)。由固定的专业量表评定人员对入组患者进行PSQI、HAMA、HAMD评测,采用飞利浦伟康A6多导睡眠监测仪对入选受试者进行连续7 h夜间睡眠监测,记录睡眠参数。(2)检测外周血IgG、IgA、IgM、C3、C4、红细胞沉降率(ESR)水平。仪器采用西门子BNⅡ全自动蛋白分析仪,采集受试者空腹外周静脉血5 mL,离心提取血清,严格按照西门子BNⅡ全自动蛋白分析仪的SOP操作规程执行,运用散射速率免疫比浊法检测血清IgG、IgA、IgM、C3、C4含量,采用魏氏法检测外周血ESR。(3)检测Treg细胞表达。采用BD FACSAriaⅡ流式细胞仪和美国eBioscience公司提供的试剂,运用BD FACSDIVA 6软件分析Treg细胞的表达,空腹抽取受试者外周静脉血5 mL,肝素钠抗凝并提取外周血单个核细胞(PBMC),标记细胞内分子后清洗,采用流式细胞仪对Treg细胞(Foxp3+CD25highCD4+)进行检测。(4)检测外周血转化生长因子-β(TGF-β)、白细胞介素-6(IL-6)、IL-10水平。采集受试者空腹外周静脉血5 mL,离心提取血清,采用酶联免疫吸附试验(ELISA)检测外周血TGF-β、IL-6、IL-10含量,所用试剂为上海晶抗生物工程有限公司。
1.6 统计学方法 采用SPSS 22.0统计软件进行数据的处理分析,计量资料用“均数±标准差”(±s)表示,计数资料用例和率(%)表示。计量资料比较采用One-way ANOVA(单因素方差分析),组间两两比较采用LSD-t检验,计数资料比较采用χ2检验。P<0.01为差异有统计学意义。
2 结 果
2.1 基线资料3组患者基线资料比较,差异均无统计学意义(P>0.05),具有可比性。(见表1)
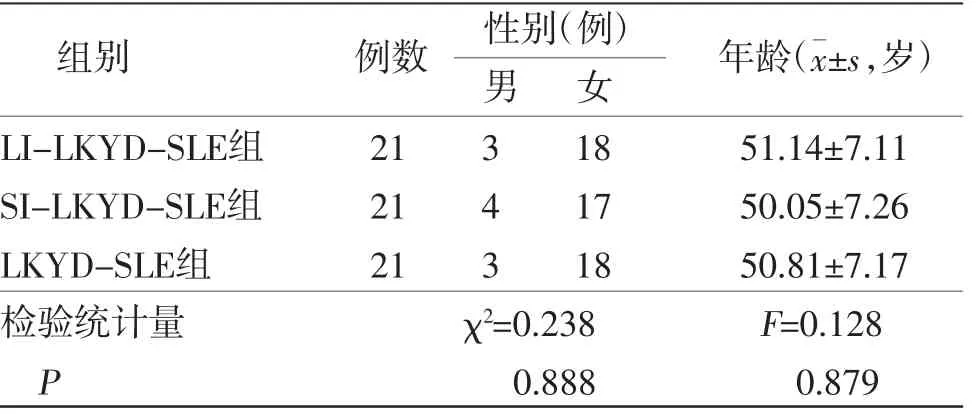
表1 3组患者基线资料比较
2.2 3组患者PSQI、HAMA、HAMD评分比较SI-LKYD-SLE组、LI-LKYD-SLE组患者PSQI、HAMA、HAMD评分均高于LKYD-SLE组患者(P<0.01),且随着失眠时间增长,LI-LKYDSLE患者PSQI、HAMA、HAMD评分均高于SI-LKYD-SLE组患者(P<0.01)。(见表2、图1)
表2 3组患者PSQI、HAMA、HAMD评分比较(±s,分)
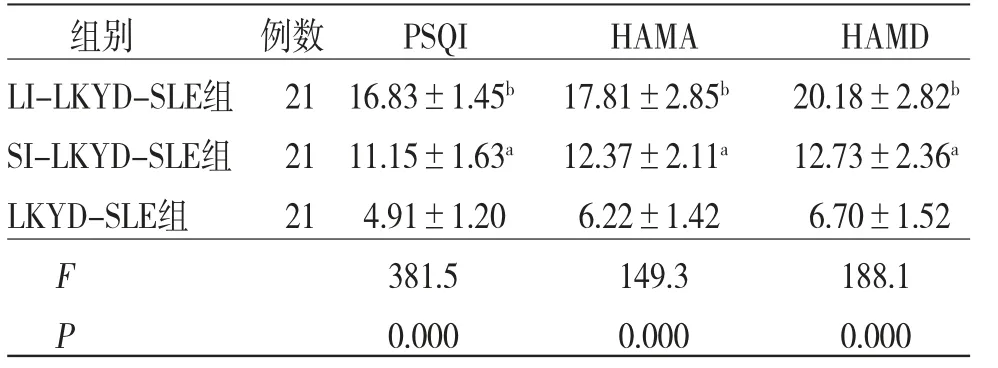
表2 3组患者PSQI、HAMA、HAMD评分比较(±s,分)
注:与LKYD-SLE组比较,aP<0.01;与SI-LKYD-SLE组比较,bP<0.01
组别 例数 PSQI HAMA HAMD LI-LKYD-SLE组21 16.83±1.45b 17.81±2.85b 20.18±2.82b SI-LKYD-SLE组 21 11.15±1.63a 12.37±2.11a 12.73±2.36a LKYD-SLE组 21 4.91±1.20 6.22±1.42 6.70±1.52 F 381.5 149.3 188.1 P 0.000 0.000 0.000
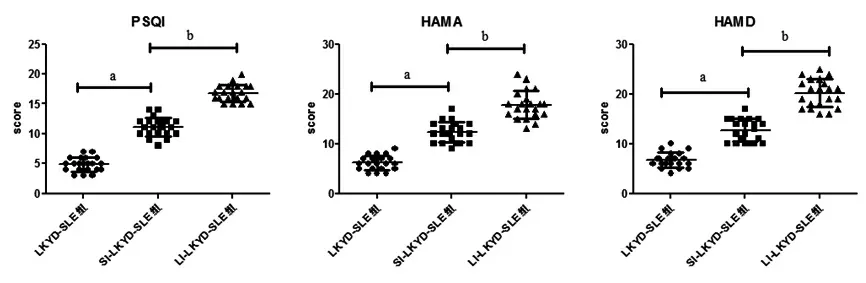
图1 3组患者PSQI、HAMA、HAMD评分散点图
2.3 3组患者PSG监测睡眠潜伏期、觉醒次数、觉醒时间、睡眠效率比较SI-LKYD-SLE组、LI-LKYD-SLE组患者睡眠潜伏期、觉醒次数、觉醒时间均高于LKYD-SLE组(P<0.01),并且随失眠时间增长,LI-LKYD-SLE组患者睡眠潜伏期、觉醒次数、觉醒时间均高于SI-LKYD-SLE组(P<0.01)。相反,SI-LKYD-SLE组、LI-LKYD-SLE组 患 者 睡 眠 效 率 低 于LKYD-SLE组(P<0.01),LI-LKYD-SLE组患者睡眠效率低于SI-LKYD-SLE组(P<0.01)。(见表3、图2)
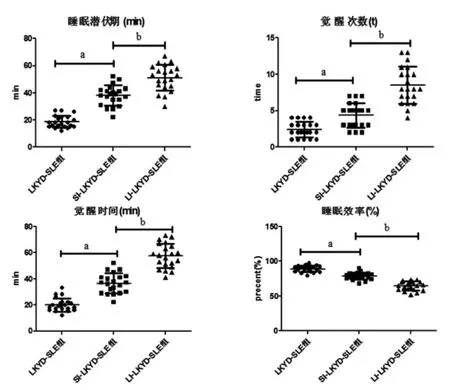
图2 3组患者PSG监测睡眠潜伏期、觉醒次数、觉醒时间、睡眠效率比较散点图
表3 3组患者PSG监测睡眠潜伏期、觉醒次数、觉醒时间、睡眠效率比较(±s)
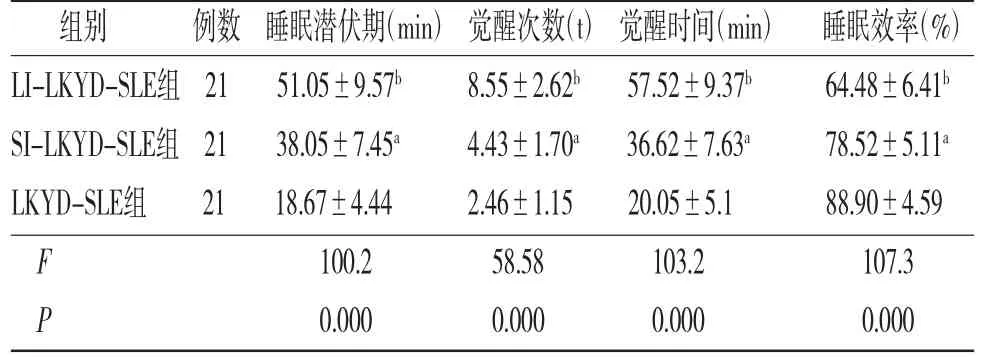
表3 3组患者PSG监测睡眠潜伏期、觉醒次数、觉醒时间、睡眠效率比较(±s)
注:与LKYD-SLE组比较,aP<0.01;与SI-LKYD-SLE组比较,bP<0.01
组别 例数 睡眠潜伏期(min)觉醒次数(t)觉醒时间(min) 睡眠效率(%)LI-LKYD-SLE 组21 51.05±9.57b 8.5组21 38.05±7.45a 4.4 21 18.67±4.44 2.45±2.62b 57.52±9.37b 64.48±6.41b SI-LKYD-SLE3±1.70a 36.62±7.63a 78.52±5.11a LKYD-SLE组 6±1.15 20.05±5.1 88.90±4.59 F 100.2 58.58 103.2 107.3 P 0.000 0.000 0.000 0.000
2.4 3组患者外周血中IgG、IgA、IgM、C3、C4、ESR表达比较SILKYD-SLE组、LI-LKYD-SLE组患者IgG、IgA、IgM、ESR均高于LKYD-SLE组(P<0.01),LI-LKYD-SLE组患者IgG、IgA、IgM、ESR显著高于SI-LKYD-SLE组(P<0.01)。相反,SI-LKYDSLE组、LI-LKYD-SLE患者C3、C4均低于LKYD-SLE组(P<0.01),LI-LKYD-SLE组患者C3、C4低于SI-LKYD-SLE组(P<0.001)。(见表4、图3)
表4 3组患者外周血中IgG、IgA、IgM、C3、C4、ESR表达比较(±s)

表4 3组患者外周血中IgG、IgA、IgM、C3、C4、ESR表达比较(±s)
注:与LKYD-SLE组比较,aP<0.01;与SI-LKYD-SLE组比较,bP<0.01
组别 例数 IgG(g/L) IgA(g/L) IgM(g/L) C3(g/L) C4(g/L) ESR(mm/h)LI-LKYD-SLE组21 34.05±4.455.31±0.79 24.43±2.79a 3.88±0.65b b 2.45±0.51b 0.54±0.24b 0.26±0.08b 55.87±4.99b SI-LKYD-SLE组21a 1.66±0.37a 0.83±0.26a 0.47±0.10a 46.23±3.32a LKYD-SLE组 21 16.43±2.81 3.08±0.48 1.37±0.34 1.02±0.27 0.59±0.13 39.69±2.86 F 138.2 63.30 38.28 17.98 49.97 94.61 P 0.000 0.000 0.000 0.000 0.000 0.000
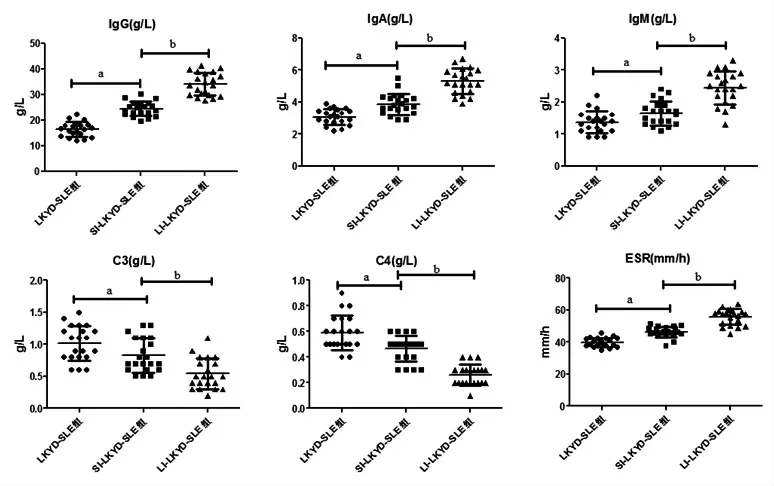
图3 3组患者外周血中IgG、IgA、IgM、C3、C4、ESR表达比较散点图
2.5 3组患者外周血Treg、TGF-β、IL-10、IL-6比较SI-LKYDSLE组、LI-LKYD-SLE组患者Treg细胞、TGF-β低于LKYDSLE组(P<0.01),且LI-LKYD-SLE组患者Treg细胞、TGF-β显著低于SI-LKYD-SLE组(P<0.001)。相反,SI-LKYD-SLE组、LI-LKYD-SLE组患者IL-6、IL-10均高于LKYD-SLE组(P<0.01),LI-LKYD-SLE组患者IL-6、IL-10均显著高于SI-LKYD-SLE组(P<0.01)。(见表5、图4)

图4 3组患者外周血Treg、TGF-β、IL-10、IL-6比较散点图
表5 3组患者外周血Treg、TGF-β、IL-10、IL-6比较(±s)

表5 3组患者外周血Treg、TGF-β、IL-10、IL-6比较(±s)
注:与LKYD-SLE组比较,aP<0.01;与SI-LKYD-SLE组比较,bP<0.01
组别 例数Treg(%)TGF-β(pg/mL)IL-10(pg/mL)IL-6(pg/mL)LI-LKYD-SLE组21 2.85±0.33b 20.81±2.45b 19.44±1.69b 77.20±5.52b SI-LKYD-SLE组21 3.81±0.34a 25.15±2.56a 14.86±1.43a 61.07±4.86a LKYD-SLE组 21 5.02±0.46 34.48±3.76 11.17±1.27 50.05±4.08 F 170.9 115.2 166.0 166.0 P 0.000 0.000 0.000 0.000
3 讨 论
系统性红斑狼疮(SLE)是一种自身免疫性结缔组织病,由于体内产生大量自身抗体,导致全身多组织多器官受累。有研究指出,SLE的发生涉及机体过多的自身抗体,由于T、B淋巴细胞功能异常活化发生免疫紊乱,大量免疫复合物在肾脏、关节等沉积,造成多系统多脏器损害[5-6]。中医典籍对于SLE并无准确记载,相关中医文献称之为“鬼脸疮”“日晒疮”,临床症状与SLE的蝶形红斑、光敏感及盘状红斑等有相似之处。SLE病因病机可能是以素体禀赋不足、肾精亏损为本,感受外界热毒之邪、瘀血阻滞为标,虚实互为因果,尤其育龄女性气火旺盛,多有阴虚内热,加之邪毒外袭,病久虚火灼津,阴血亏虚,故以肝肾阴虚为本,热毒瘀血为标[7-8]。且SLE活动期免疫反应亢进,以邪盛为主,多为血热加湿毒,缓解期免疫功能下降,多以正虚为主,辨证为肝肾阴虚、脾肾阳虚[9],从而导致一系列多脏器受损、多器官功能障碍的临床表现。
中医学称失眠为“不寐”。《灵枢·大惑论》记载:“卫气不得入于阴,常留于阳,留于阳则阳气满,阳气盛则阳跷盛;不得入于阴则阴气虚,故目不瞑矣。”[10]传统中医理论指出,失眠是由于阳不交阴、阴阳失调所致。阴虚是诱发阴阳不交的主要原因,肾为先天之本,肾阴虚是引起失眠的重要病机,而肝肾同源,故肝肾阴虚是导致长期而顽固失眠的重要病机[11]。肝肾阴虚型失眠,多心烦易躁,伴自汗及盗汗,醒时烘热汗出,睡中盗汗,盗汗即醒[12]。由于SLE患者病程长,病情反复,生活节律被打乱,出现难以入睡而不得眠,醒后不易再睡,甚至彻夜不眠等失眠症状,推测与大脑皮层的兴奋和抑制调节功能失衡有关。SLE患者随着病情进展多出现失眠,会累及脏腑,导致功能障碍。
本研究结果显示,SI-LKYD-SLE组、LI-LKYD-SLE组患者PSQI、HAMA、HAMD评分均高于LKYD-SLE组(P<0.01),尤其LI-LKYD-SLE组患者上述各项指标较SI-LKYD-SLE组明显增加(P<0.001),提示随失眠时间延长,睡眠质量下降,患者焦虑抑郁情绪会明显加重。进一步PSG监测提示各肝肾阴虚型失眠组患者睡眠潜伏期、觉醒次数、觉醒时间发生异常,随失眠时间延长,睡眠效率明显下降(P<0.01)。有研究指出,失眠症与焦虑障碍及抑郁症的共患率较高,其焦虑障碍患者伴睡眠紊乱、惊恐障碍和创伤后应激障碍的比例竟达70%[13-14],提示失眠与焦虑抑郁障碍可能有相似的发病机制,因此存在着高度的共病特点。所以,伴有失眠的肝肾阴虚型系统性红斑狼疮患者在病程发展进程中,随着失眠时间的增加,睡眠质量及不良情绪均会明显加重。
研究报道,SLE相关免疫炎性因子表达的增多,与病情发展的程度相关,尤其IgG、IgA、IgM、ESR表达的增加与SLE发展严重程度有明确相关性,而C3、C4随着SLE严重程度的增加则会减少[15-16]。本试验中SI-LKYD-SLE、LI-LKYD-SLE组患者IgG、IgA、IgM、ESR含量均较LKYD-SLE组患者增高(P<0.01),而C3、C4的表达则减少。与研究结果一致,失眠发生涉及多种体内炎性反应因子、神经体液多系统,长期失眠会引起机体免疫机能紊乱及失调,提示SLE患者失眠程度与免疫功能异常存在相关。研究证实,SLE患者初期气血亏虚,进展至后期出现肝肾阴虚,机体免疫功能下降,导致红细胞、白细胞、粒细胞、淋巴细胞及补体等减少[17]。并且,肝肾阴虚型SLE患者发展至后期,病情相对稳定,但体内多种炎性因子仍存在动态变化,随失眠时间的不断增加,睡眠质量相关参数、情绪因素及各种炎性因子表达会发生显著变化,与失眠的严重程度存在潜在关系。
近年研究指出,Treg淋巴细胞是T细胞家族一个新亚群,能够调控具有潜在伤害性的自身反应性T淋巴细胞,对病原体、异变细胞和机体异物具有防御、清除和识别的作用,对免疫反应有抑制作用[18]。Treg细胞参与SLE、肿瘤和类风湿性关节炎等多种自身免疫性疾病的发病过程[19]。本试验显示,Treg细胞在不同失眠程度的肝肾阴虚型SLE患者中表达是不相同的,随失眠时间延长,Treg细胞数表达会减少,且Treg细胞与TGF-β可能存在促进作用,与IL-6、IL-10之间可能存在相互抑制的关系。其中,炎症因子IL-6、IL-10具有调节睡眠的作用,当睡眠结构紊乱时,IL-6、IL-10表达会增高,失眠时间越长,IL-6、IL-10表达越明显,而IL-6是B淋巴细胞分化因子,可诱导B淋巴细胞产生免疫球蛋白,其表达增高会干扰Treg细胞功能,使CD4+T淋巴细胞向Treg细胞转化减少[20]。有研究[21]指出,Treg细胞负性免疫调节作用是通过TGF-β抑制免疫细胞增生及Th1和Th2细胞的分化成熟,以及致炎因子IL-6、TGF-β等介导炎症细胞浸润而实现的。所以,体内Treg细胞数量变化、功能异常及细胞因子表达情况均与肝肾阴虚型SLE患者失眠程度存在一定关系。
总之,肝肾阴虚型SLE患者随着失眠时间的增加、失眠程度的加重,睡眠结构会发生改变,机体免疫紊乱程度愈加明显,Treg细胞及细胞因子表达愈异常。但机体免疫功能存在多种因素调节,Treg细胞及细胞因子参与SLE的发病,可能还存在其它T淋巴细胞或B淋巴细胞及细胞因子参与失眠相关肝肾阴虚型SLE的发生,仍需进一步研究。所以,肝肾阴虚型SLE患者免疫功能紊乱参与失眠发生,且失眠程度与Treg细胞及细胞因子存在潜在相关。

