miR-365a-3p靶向调控JAK-STAT信号通路抑制三阴性乳腺癌细胞的恶性生物行为研究
黄君华,王 琼,杨 进,但家强,黄元坤,谭旭东△
(四川省成都市第五人民医院:1.甲状腺乳腺外科;2.健康管理中心 611130)
乳腺癌是起源于女性乳腺上皮细胞的恶性肿瘤,2018年全球肿瘤普查性研究表明,乳腺癌占女性恶性肿瘤新确诊病例的 25%,已成为全球范围内影响女性身体健康最常见的恶性肿瘤[1-2]。而三阴性乳腺癌(triple negative breast cancer,TNBC)作为侵袭性最高的乳腺癌类型[3],占乳腺癌确诊病例的15%~25%[4],早期即可出现腋窝淋巴结转移。且由于无法应用曲妥珠单抗等生物靶向药物,临床治疗手段较为局限,故多数TNBC患者出现病灶侵袭及转移预后差,极易复发,生存时间短[5]。因此,探究TNBC生物治疗靶标及潜在的发生、发展机制对开发TNBC的临床治疗方式、改善患者预后具有重要意义。
微小RNA(micro RNA,miRNA)是内生性非编码短链核苷酸序列,可调控体内1/3的蛋白编码基因[6]。有研究发现,miRNA通过调节下游信号通路参与调控TNBC肿瘤细胞的侵袭、发展,并与TNBC耐药性及预后相关[7-8]。XU等[7]报道,miRNA-193通过靶向作用磷脂酰肌醇-3-羟激酶及蛋白激酶B等通路促进TNBC的进展,而UMEH-GARCIA等[8]则发现,miR-127可通过下调神经酰胺激酶活性进而抑制TNBC侵袭、转移。最近有研究表明,miR-365a-3p通过调节蛋白激酶B/β-链蛋白等相关通路参与了结直肠癌、喉癌、肝癌等肿瘤的发生、发展[9-11],然而miR-365a-3p在TNBC组织中表达如何、是否介导TNBC的恶性生物行为及潜在的作用机制尚不可知,故本研究针对TNBC,探究了miR-365a-3p的作用及潜在机制,现报道如下。
1 资料与方法
1.1 一般资料
选取2018年6月至2019年12月本院收治的行外科手术切除治疗的TNBC患者50例,年龄35~67岁,平均(51.78±9.84)岁。纳入标准:(1)经病理学及影像学检查确诊为TNBC;(2)术前未接受任何形式的非外科治疗。排除标准:乳腺癌复发或合并其他恶性肿瘤者。本研究符合本院伦理委员会制订的相关标准。
1.2 方法
1.2.1细胞及试剂
人正常乳腺上皮细胞系MCF-10A和乳腺癌细胞系MDA-MB-231、MDA-MB-468、HCC-1937、MCF-7均购自武汉大学生命科学系,其中MDA-MB-468为TNBC细胞株。杜氏改良Eagle培养基(Dulbecco′s modified Eagle medium,DMEM)培养基、胎牛血清(fetal bovine serum,FBS)、Lipofectamine 2000均购自广州派真生物科技公司。miR-365a-3p 模拟物(mimic) 及阴性对照(Negative control,NC)mimic均购自上海吉凯生物科技有限公司。CCK-8试剂购自上海碧云天生物科技公司。细胞质双面蛋白酪氨酸激酶(janus Kinase,JAK)和信号传导及转录激活因子(signal transducers and activators of transcription,STAT)及β-actin抗体均购自美国Abcam生物公司。
1.2.2标本及临床资料收集
所有患者均取1份肿瘤组织,并取癌灶边缘3 cm的癌旁组织作为对照。提取组织后迅速放置-80 ℃进行保存并进行相关后续实验,同时收集患者年龄、肿瘤大小、Ki67表达水平、浸润范围、淋巴结转移及TNM分期等临床资料。
1.2.3细胞转染及培养
将MCF-10A、MDA-MB-468、MDA-MB-231、HCC-1937、MCF-7培养于含10% FBS的DMEM培养基内并置于37 ℃培养箱内培养,当细胞生长融合度为70%~80%时用0.25%胰酶-乙二胺四乙酸消化传代。按照Lipofectamine 2000试剂说明书将TNBC细胞株MDA-MB-468转染miR-365a-3p mimic和NC mimic探究miR-365a-3p对TNBC细胞株的恶性生物行为。
1.2.4实时荧光定量PCR检测miR-365a-3p表达水平
采用Trizol裂解TNBC组织及TNBC细胞系并用总 RNA 纯化试剂盒提取乳腺癌细胞总RNA;用QuantiTect Reverse Transcription Kit将RNA逆转录为cDNA后采用两步扩增法进行PCR扩增。随后进行荧光定量检测。miR-365a-3p、U6及内参 GAPDH的引物序列见表1。采用2-ΔΔCt法计算目的基因表达水平。
1.2.5蛋白提取及Western blot实验
用RIPA裂解乳腺癌细胞提取细胞总蛋白后采用蛋白质定量(BCA)法测定蛋白浓度。然后将蛋白在80 V电压下进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,然后在120 V条件下采用湿转法将蛋白转移至聚偏氟乙烯膜。用5%脱脂奶粉室温封闭1 h后分别孵育JAK、STAT、β-actin抗体,并4 ℃过夜。漂洗后加入辣根过氧化物酶标记的二抗室温孵育1 h。采用电化学发光(ECL)发光液检测蛋白条带,并用Image J进行条带定量计算。
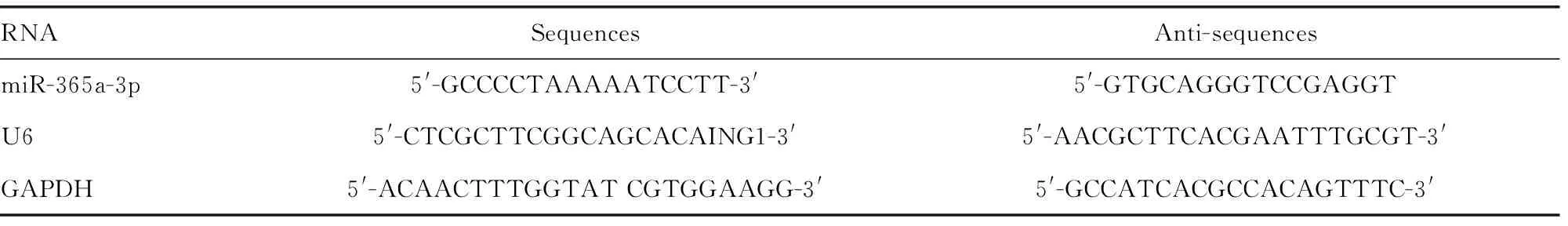
表1 miR-365a-3p、U6及GAPDH的引物序列
1.2.6CCK-8实验检测MDA-MB-468增殖能力
将5×103个细胞接种于96孔培养板中置于含5% CO2的37 ℃培养箱内培养24 h。然后每孔加入10 μL CCK-8试剂后在培养箱中37 ℃孵育1 h。在转染miR-365a-3p mimic和NC mimic后第0、24、48、72、96 h检测波长450 nm处的光密度值。
1.2.7克隆形成实验检测细胞集落形成能力
MDA-MB-468细胞转染24 h后以0.25%胰酶-乙二胺四乙酸消化,用含10% FBS的DMEM培养基重悬并接种至6孔板,每孔800个细胞。置37 ℃、5% CO2及饱和湿度细胞培养箱中培养2~3周后采用4%多聚甲醛固定后以0.1%结晶紫染色,低倍显微镜下拍照记录细胞克隆数。
1.2.8Transwell法检测细胞侵袭能力
将转染后的MDA-MB-468细胞接种于RPMI-1640培养基重悬后加入Transwell上室无血清培养,Transwell下室加入含10%胎牛血清的DMEM培养液。细胞于含5% CO2的37 ℃培养箱内培养48 h,用棉签擦去Transwell上室细胞。4%多聚甲醛固定后以0.1%结晶紫染色。随机选取5个视野计数每个视野中的迁移或侵袭细胞数。
1.2.9细胞划痕实验检测细胞迁移能力
取6×105个转染后的细胞并将其接种于6孔板,在6孔板背面画5条平行线作为标记,24 h后枪头比着直尺,垂直于背后的横线划痕,用磷酸盐缓冲溶液洗细胞3次,去除划下的细胞,加入无血清培养基。置于放入37 ℃、5% CO2培养箱中进行孵育。
1.2.10双荧光素酶报告基因实验预测miR-365a-3p的潜在靶通路
通过TargetScan在线预测 JAK 是否存在与 miR-365a-3p的可匹配的碱基序列。将JAK基因3′-端非编码区 (3′-untranslated region,3′-UTR)构建到荧光素酶报告基因载体上,将JAK-野生型(wild type,WT)和JAK-突变型(mutant type,MUT) 分别与NC mimic及miR-365a-3p mimic转染 至MDA-MB-468细胞内。孵育72 h 后检测细胞中荧光素酶活性。
1.3 统计学处理
2 结 果
2.1 miR-365a-3p在TNBC组织及TNBC细胞系中的表达水平
与癌旁组织比较,TNBC组织中miR-365a-3p表达明显降低,差异有统计学意义(P<0.05),见图1A。同时肿瘤越大、Ki67表达水平越高、浸润范围越深、存在淋巴结转移、TNM分期越差患者miR-365a-3p表达水平越低,差异有统计学意义(P<0.05),见表2。此外与正常乳腺上皮细胞MCF-10A比较,乳腺癌细胞中miR-365a-3p表达明显下降,差异有统计学意义(P<0.05),见图1B。
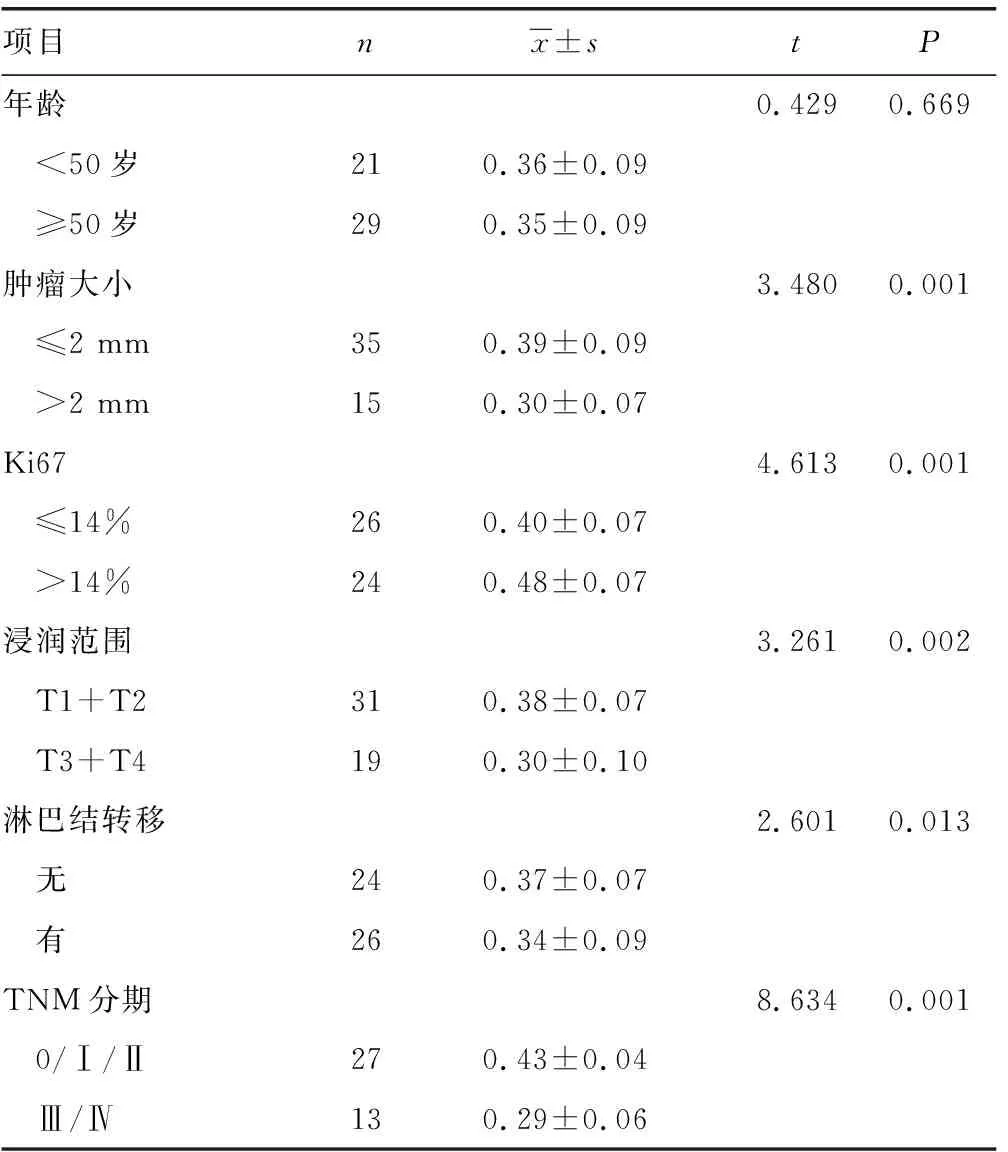
表2 TNBC患者临床特征与miR-365a-3p表达水平比较

A:TNBC组织和癌旁组织中miR-365a-3p表达水平;B:乳腺癌细胞及正常乳腺上皮细胞中miR-365a-3p表达水平。
2.2 miR-365a-3p促进TNBC细胞的恶性生物行为
转染miR-365a-3p mimics后miR-365a-3p表达明显升高,差异有统计学意义(P<0.05),见图2A,提示转染成功。转染miR-365a-3p mimics后MDA-MB-468细胞增殖水平明显下降,差异有统计学意义(P<0.05),见图2B。与NC mimics组比较,miR-365a-3p mimics组细胞克隆集落形成能力明显降低,差异有统计学意义(P<0.05),见图2C。转染miR-365a-3p mimics后TNBC细胞迁移能力受损,差异有统计学意义(P<0.05),见图2D。高表达miR-365a-3p可抑制MDA-MB-468细胞侵袭能力,差异有统计学意义(P<0.05),见图2E。
2.3 miR-365a-3p靶向调控JAK-STAT的通路
JAK启动子区存在miR-365a-3p的靶向结合位点,即JAK可能是miR-365a-3p靶向调节基因,见图3A。JAK-WT+miR-365a-3p共转染组荧光素酶活性明显降低,与JAK-MUT+miR-365a-3p共转染组比较,差异有统计学意义(P<0.05),见图3 B。miR-365a-3p mimics组JAK、STAT蛋白水平较NC mimics组明显下降,差异有统计学意义(P<0.05),见图3C。

A:转染miR-365a-3p模拟物后miR-365a-3p 表达水平;B:miR-365a-3p促进细胞增殖;C:miR-365a-3p提高细胞击落形成能力;D:miR-365a-3p促进细胞迁移能力 (200×); E:miR-365a-3p促进乳腺癌细胞侵袭能力(200×)。
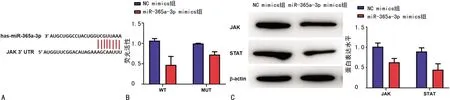
A:JAK 是miR-365a-3p潜在靶点;B:miR-365a-3p-WT降低荧光活性;C:miR-365a-3p模拟物可降低JAK、STAT蛋白表达水平。
3 讨 论
TNBC是具有高度侵袭性、转移性和异质性的乳腺癌亚型,该亚型患者发病年龄低,早期即出现淋巴结转移,同时对常规内分泌和靶向药物治疗无效,预后差,复发率高,严重威胁着人类健康[7]。因此,探究TNBC发生、发展机制对完善临床治疗方式、改善患者预后极为重要。miRNA可通过调控编码蛋白的表达而控制肿瘤细胞生长、分化、侵袭等病理过程,成为近年来乳腺癌研究的热点问题,也是实现TNBC精准基因靶向治疗的重要研究方向[12]。
miR-365a-3p是近年来新发现的抗癌因子,其异常表达参与了众多实体恶性肿瘤的发生、发展,并与多种疾病的不良预后有关。HONG等[9]报道,低表达miR-365a-3p结肠癌患者无复发生存率和总生存率明显降低,同时是结肠癌患者预后的独立危险因素。而LI等[10]则通过功能学实验发现,miR-365a-3p作为长链非编码RNAZEB1-AS1的下游调控基因可明显抑制肝癌细胞增殖和侵袭。本研究结果显示,TNBC组织中miR-365a-3p明显降低,同时低表达miR-365a-3p患者肿瘤范围更大、Ki67表达水平较高、浸润深、存在淋巴结转移情况及TNM分期较差提示低表达miR-365a-3p作为抗癌因子与TNBC的不良预后明显相关。因此,本研究进一步通过实时荧光定量PCR检测发现,各乳腺癌细胞系miR-365a-3p均较低,与临床组织学结果一致。通过转染miR-365a-3p mimics发现,MDA-MB-468细胞内miR-365a-3p表达升高,同时能明显抑制MDA-MB-468细胞株增殖、集落形成、迁移及侵袭能力,表明高表达miR-365a-3p可明显阻滞TNBC细胞株发生、发展,抑制其恶性生物学行为,提示miR-365a-3p可作为TNBC潜在的治疗靶点。
尽管现有研究表明,E2F转录因子2、核转录因子-κB及跨膜蛋白Robo1等作为miR-365a-3p靶通路参与了众多肿瘤的发生、发展[11-13],然而miR-365a-3p调控TNBC的增殖和侵袭等恶性生物行为的作用机制尚不明确,本研究通过 TargetScan软件发现,JAK编码基因存在与miR-365a-3p序列存在可匹配位点,继而通过双荧光素酶报告基因实验发现,miR-365a-3p靶向调控JAK蛋白基因。而STAT作为JAK的下游蛋白,二者共同组成JAK-STAT顺序通路信号参与肿瘤的进展。本研究结果显示,miR-365a-3p可明显抑制JAK-STAT蛋白表达水平,提示miR-365a-3p通过靶向抑制JAK-STAT信号通路。而最新有研究表明,JAK-STAT信号通路突变激活后可促进乳腺癌细胞的增殖、侵袭[14],同时通过诱导原细胞源性因子的表达参与了乳腺癌的耐药性[15],进一步佐证了JAK-STAT信号通路可作为miR-365a-3p的调控靶点抑制TNBC细胞的恶性生物行为。
综上所述,miR-365a-3p在TNBC肿瘤样本和乳腺癌细胞系中表达水平下降,同时与TNBC患者的不良预后指标存在相关性,此外miR-365a-3p可通过抑制JAK-STAT信号通路而抑制TNBC细胞株的恶性生物行为,为解释TNBC发展的潜在机制及开发新的治疗靶点提供了重要参考。

