肝癌细胞来源的外泌体作用正常肝细胞后差异表达环状RNA的筛选*
沈彩红,孙 林,黄文杰,沈永奇,卢永刚,孙一帆△
(广西医科大学附属柳铁中心医院:1.感染科;2.检验科;3.肿瘤科;4.肝胆外科,广西柳州 545007)
肝癌是常见的恶性肿瘤之一,其在肿瘤中的发病率位列第4,病死率位列第3[1]。肝癌具有较高的发病率和病死率,急切需要有效的早期诊断。目前,肝癌早期诊断较为理想的血清标志物为甲胎蛋白,但由于其特异度不高,故亟待探索其他有助于肝癌早期有效诊断的生物标志物。近年来,外泌体在肿瘤疾病中的作用已成为研究热点之一。外泌体中含大量核酸、蛋白、脂质等物质,参与了细胞之间或细胞与组织间的通讯,影响肿瘤的发生、发展。环状RNA(circRNA)作为外泌体内含物中的一种核酸,随着RNA测序技术的迅速发展,大量circRNA被发现与肿瘤的发生存在潜在的关联,发挥了重要的调控作用,具有巨大潜力,因此,其有可能成为肝癌早期筛查的一种新型生物标志物[2]。本研究通过对肝癌HepG2细胞外泌体与正常肝细胞LO2共同培养后circRNA表达进行比较,筛选验证了具有差异表达的circRNA,并预测分析了其在肝癌发展的作用,现报道如下。
1 材料与方法
1.1 试剂与仪器
外泌体提取试剂盒(美国Thermo公司)、总RNA提取试剂盒(美国Qiagen公司)、Trizol试剂(美国Invitrogen公司)、Arraystar Super RNA Labeling Kit(美国Arraystar公司)、Arraystar Human circRNA Arrays V2(美国Arraystar公司)、SYBRGreen 聚合酶链反应(polymerase chain reaction,PCR)试剂盒(美国Thermo公司)、逆转录试剂盒(美国Thermo公司)、AB7500荧光定量PCR仪(美国Applied Biosystems公司)、低温冷冻离心机(美国Sigma公司)、Agilent Hybridization Oven、Agilent Scanner G2505C、Nanodrop ND-1000等。实时荧光定量 PCR所用引物由生工生物工程(上海)股份有限公司合成,序列见表1。
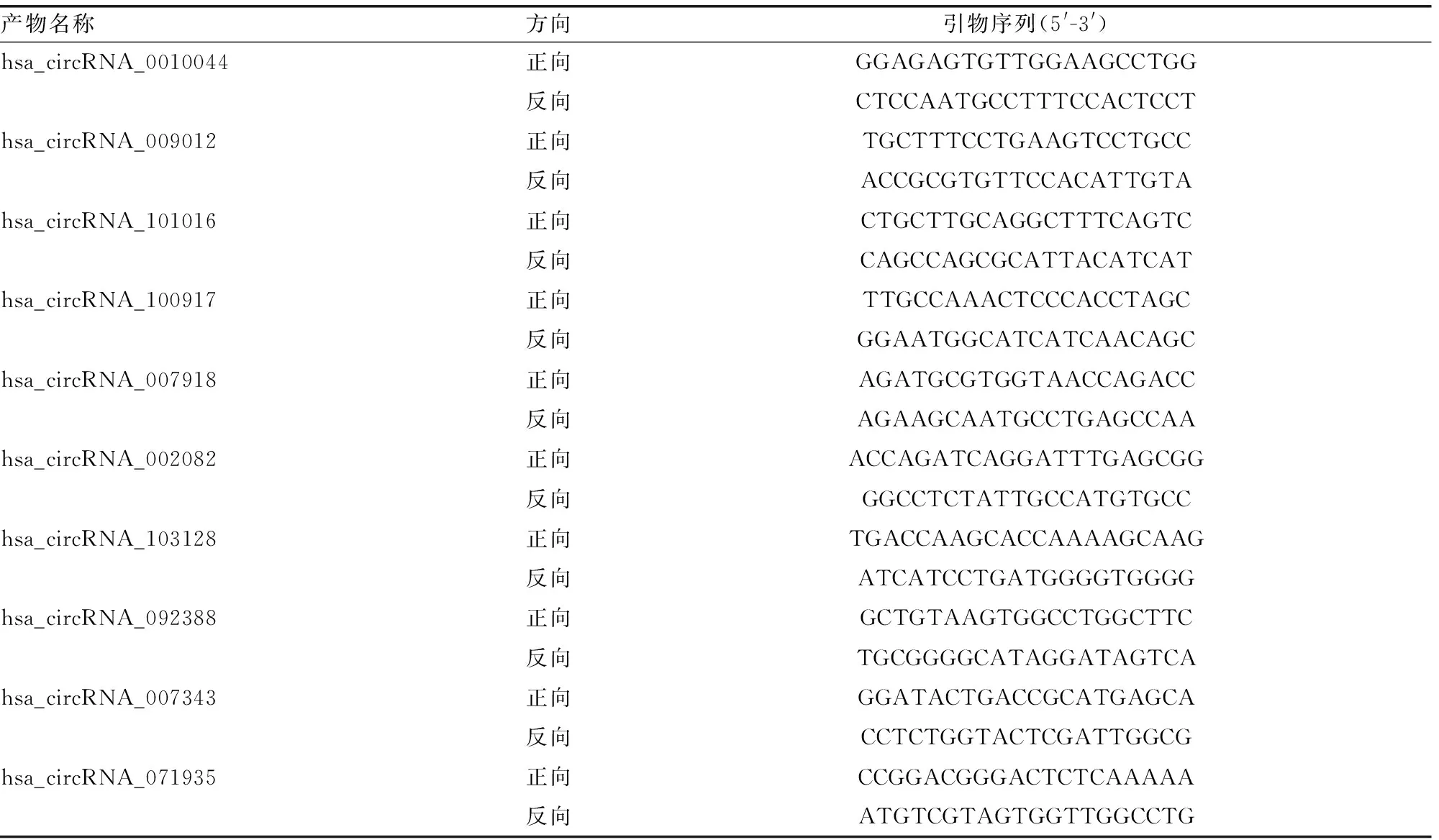
表1 实时荧光定量PCR反应引物
1.2 方法
1.2.1外泌体提取与鉴定
收集生长良好的HepG2细胞培养液至离心管中,4 ℃、3 000 r/min离心30 min后收集上清液至新的离心管加入外泌体提取试剂,4 ℃过夜孵育后再4 ℃、3 000 r/min离心60 min,弃上清液,所得沉淀即为外泌体。用无菌1×磷酸盐缓冲盐溶液(PBS)重悬外泌体,储存于-80 ℃备用。通过透射电镜扫描和纳米颗粒跟踪分析仪对所提取的外泌体进行鉴定。
1.2.2标本收集与处理
分为对照组(正常肝细胞LO2)和实验组[正常肝细胞LO2+HepG2细胞外泌体(100 μg/mL)]。按照分组对LO2细胞进行处理,HepG2细胞外泌体与LO2细胞共培养48 h后收集细胞,加上Trizol裂解液,用总RNA提取试剂盒提取总RNA,进行circRNA芯片分析。
1.2.3外泌体处理LO2细胞后差异表达circRNA筛选
选取实验组和对照组标本各2份总RNA,使用美国Arraystar公司的8x15K的Arraystar Human circRNA Arrays V2芯片在Agilent Hybridization Oven 仪器上进行circRNA杂交检测,用Agilent Scanner G2505C仪器进行扫描获取circRNA芯片检测数据。利用R software limma package,以P<0.05且差异表达倍数(fold change)>2的条件筛选差异表达的circRNA。在筛选差异表达circRNA中选择上调和下调差异表达倍数排在前5位的circRNA进行进一步验证。
1.2.4差异表达的circRNA生物信息学分析
通过生物信息学相关数据库对差异表达的circRNA进行基因本体论(gene ontology,GO)富集分析和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)信号通路分析,预测差异表达的circRNA相关的生物学功能。
1.2.5实时荧光定量PCR 验证circRNA的表达
使用逆转录试剂盒将提取的细胞总RNA逆转录为cDNA,按照SYBRGreen PCR试剂盒说明书进行实时荧光定量 PCR检测筛选得到的上调和下调差异表达前5位的 circRNA相对表达水平。
1.3 统计学处理
2 结 果
2.1 外泌体的提取和鉴定
经透射电镜观察,从HepG2细胞培养液中提取到的沉淀物其形态为有圆形或椭圆形脂膜结构的小囊泡,见图1A;颗粒大小为50~150 nm,见图1B。成功从HepG2细胞培养液中分离提取到外泌体。
2.2 CircRNA芯片原始数据均一化
CircRNA芯片原始图像资料采用Agilent Feature Extraction软件进行数据提取,利用R语言limma软件包依据Quantile算法规则对circRNA芯片数据进行标准化和均一化处理。经标准化和均一化处理后消除了染色偏差和点样针头带来空间差异引起基因表达量的不同,对照组和实验组标本circRNA表达经标准化后荧光信号强度基本一致,可进一步进行circRNA基因差异表达分析。
2.3 芯片数据差异表达基因筛选分析
CircRNA基因芯片在对照组和实验组共培养后共检测出10 017个circRNA,为筛选出正常LO2细胞和外泌体处理后细胞中差异表达的基因,以FC>2且P<0.05为筛选标准,筛选出235个差异表达的circRNA,其中50个circRNA上调表达,185个circRNA下调表达;其中前10位明显上调和明显下调的circRNA见表2。根据FC>2且P<0.05作为筛选标准绘制火山图,见图2。经HepG2细胞外泌体处理LO2细胞后,circRNA低表达数量多于高表达数量。

A:外泌体形态鉴定;B:外泌体颗粒大小检测。
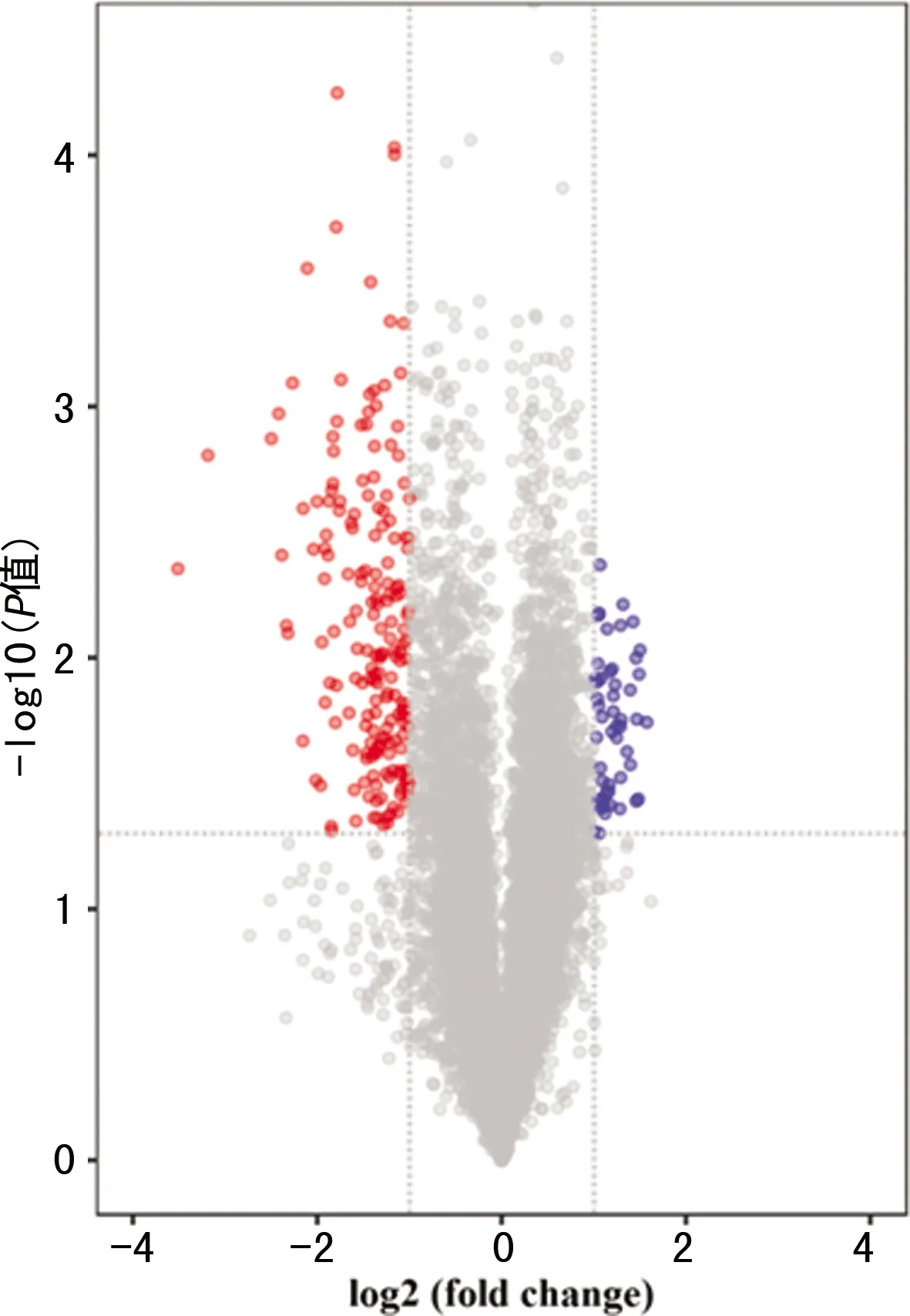
两侧红点和蓝点:两组间存在差异表达的circRNA;右侧蓝点:经外泌体处理后LO2细胞中上调表达的circRNA;左侧红点:外泌体处理后LO2细胞中下调表达的circRNA。
2.4 外泌体处理后LO2细胞相关circRNA的聚类分析
对照组和实验组经筛选获得的circRNA表达水平进行聚类分析结果见图2。差异表达的circRNA中LO2细胞经外泌体处理后低表达的circRNA多于高表达的circRNA,见图3。与火山图分析结果一致。
2.5 在LO2细胞中验证差异表达的circRNA
根根前面筛选结果挑选出其中表达倍数差异较大的前5个表达上调或下调的circRNA,见表2。上调表达的hsa_circRNA_0010044、hsa_circRNA_009012、hsa_circRNA_101016、hsa_circRNA_100917、hsa_circRNA_007918和下调表达的hsa_circRNA_002082、hsa_circRNA_103128、hsa_circRNA_092388、hsa_circRNA_007343、hsa_circRNA_071935等circRNA在HepG2细胞外泌体处理后的LO2细胞表达与之前分析结果一致,见图4。hsa_circRNA_0010044、hsa_circRNA_009012、hsa_circRNA_101016、hsa_circRNA_100917、hsa_circRNA_007918等circRNA确实在经外泌体处理后的LO2细胞中的表达水平明显上调,差异均有统计学意义(P<0.05);hsa_circRNA_002082、hsa_circRNA_103128、hsa_circRNA_092388、hsa_circRNA_007343、hsa_circRNA_071935等circRNA确实在经外泌体处理后的LO2细胞中的表达水平明显下调,差异有统计学意义(P<0.05),与之前生物信息学预测分析结果一致。
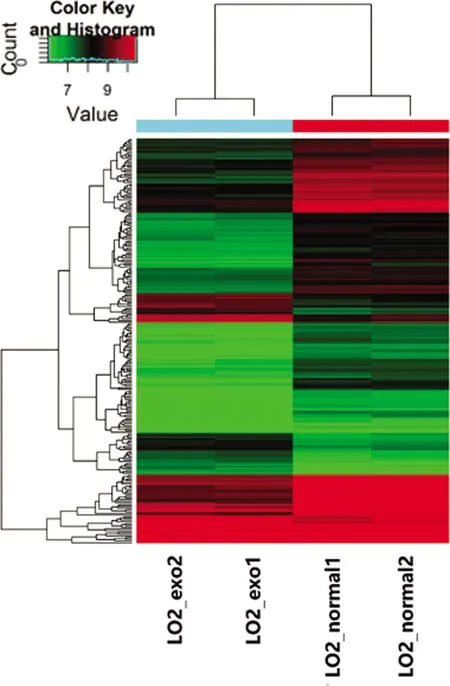
纵轴:基因聚类;横轴:标本聚类;绿色:该基因在经外泌体处理后的LO2细胞中低表达;红色:基因在经外泌体处理后的LO2细胞中高表达;黑色:该基因在二者中无明显差异。
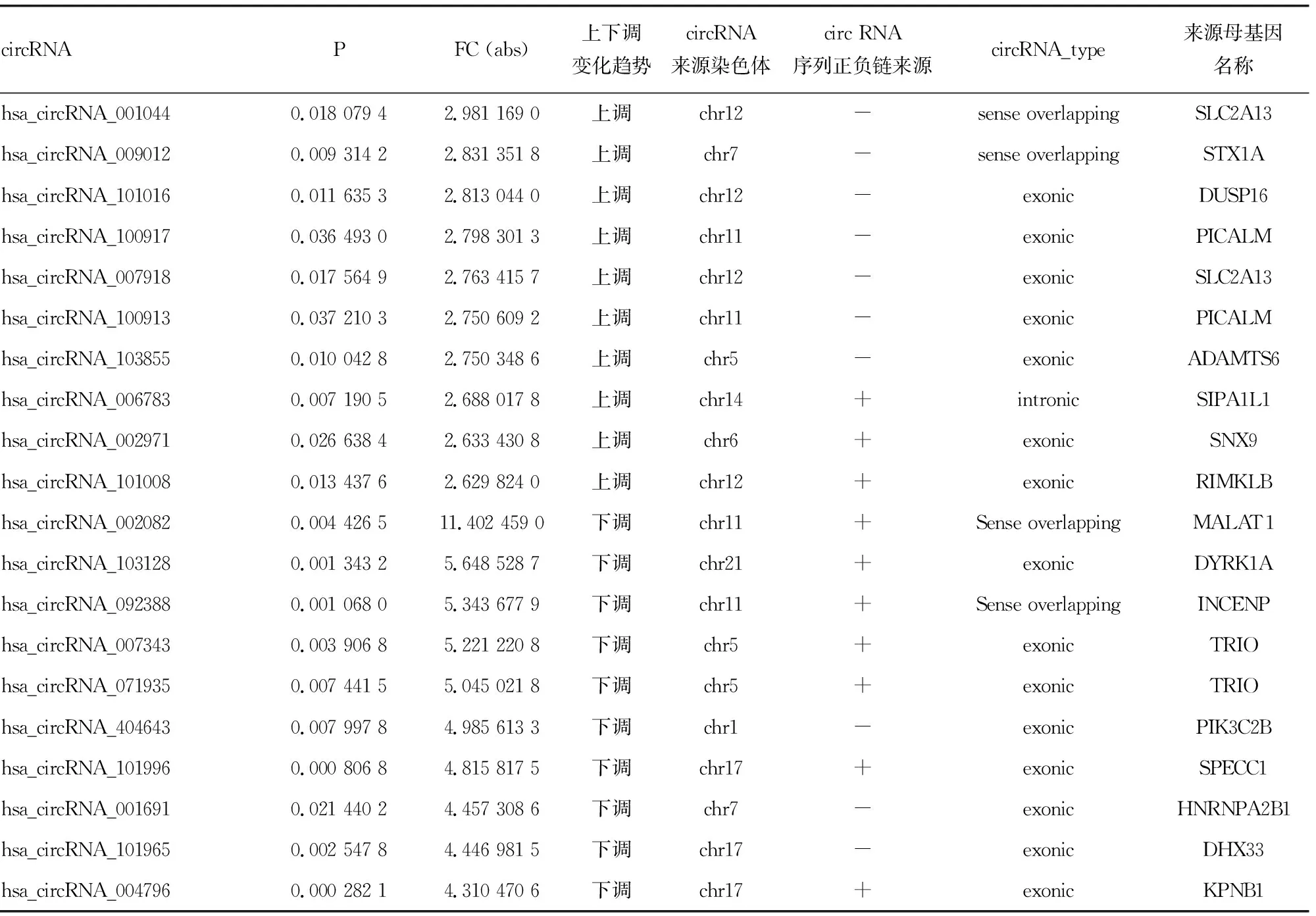
表2 正常LO2细胞经HepG2细胞外泌体处理后表达上调和下调的circRNA(倍数改变排列在前10的circRNA)

图4 正常LO2细胞经HepG2细胞外泌体处理后差异表达上调和下调的circRNA聚类分析热图
2.6 差异表达circRNA的GO、KEGG分析结果
GO富集分析经HepG2外泌体处理后LO2细胞中表达上调或下调前5个的circRNA宿主基因可能参与的生物过程主要富集在转录、转录调控,RNA聚合酶Ⅱ启动子转录的调控,Rac蛋白信号传导的调控,血管内皮生长因子受体信号通路等;可能参与的细胞成分主要富集在核仁、细胞质、核质、细胞膜等;可能参与的分子功能主要富集在蛋白质结合、DNA结合、转录因子激活结合、N-乙酰转移酶活性等。KEGG信号通路分析发现经HepG2外泌体处理后LO2细胞中表达上调或下调前5的circRNA的宿主基因与细胞周期、丝裂原活化蛋白激酶(MAPK)信号通路、磷酸肌醇-3激酶/蛋白激酶B(PI3K/Akt)信号通路、神经营养蛋白信号通路、肿瘤发生等密切相关。
3 讨 论
外泌体是一种具有双层脂膜结构的细胞外小泡,由JOHNSTONE等[3]在1989年研究成熟的绵羊网织红细胞时发现报道。外泌体经细胞“内吞-融合-外排”等过程形成直径为50~140 nm圆形或椭圆形囊泡,广泛分布于血浆、脑脊液、乳汁、胸腹腔积液、尿液等物质中,甚至存在于细胞培养上清液中[4],其内含丰富的核酸[(微小RNA(micro RNA,miRNA)、长非编码RNA(long non-coding RNA,lncRNA)、circRNA等]、蛋白质、脂质等生物活性物质可在细胞间进行信号传递[5]。 外泌体参与了细胞之间或细胞与组织之间重要信息和物质的交换,在人类细胞生长、发育、分化、衰老等生理过程中发挥着重要作用。越来越多的研究表明,外泌体参与了细胞间通讯和微环境调节,可促进病毒扩散及炎症的发生,诱导肿瘤细胞之间交换致癌因子并维持相邻基质细胞的肿瘤生长,在肿瘤转移、发生中具有重要作用;通过传递非编码RNA触发化学耐药性诱导肝脏疾病的恶性转化, 刺激免疫激活及免疫逃逸,可作为生物标志物用于肿瘤的预测和诊治[6-8]。
circRNA是由5′和3′末端首尾环化形成一个特殊环状结构,通过套索驱动环化和内含子配对驱动环化形成的circRNA[9-10],其结构稳定在体内不易被核酸酶降解。近年来,随着高通量测序技术和生物信息学的迅速发展,circRNA广泛存在于不同生物的细胞质中,具有多样性、高度稳定性、时空特异性等[11-12]。在胃癌、乳腺癌、结肠癌等恶性肿瘤中的研究发现,circRNA可与miRNA结合,竞争性抑制miRNA的转录调控,进而影响肿瘤的生长、发育[13-15]。此外,在多种恶性肿瘤中发现,肿瘤分泌的外泌体中存在大量差异表达的circRNA,研究其影响肿瘤生长、发育的生物功能,可作为一种生物标志物在肿瘤诊断、预后评估等方面具有极大的潜力[16]。
肝癌分泌的外泌体中含丰富的核酸(miRNA、lncRNA、circRNA等),在肝癌的发生、发展中起着重要的作用,其生物功能也成为研究热点之一。肝癌细胞分泌的外泌体miRNA-21能使肝星状细胞向肿瘤相关的成纤维细胞转化促进肿瘤的发生[17]。肝癌高转移的肝癌细胞分泌的外泌体miRNA-1247-3p可直接作用靶向B4GALT3基因促使肝细胞癌(HCC)向肺癌转移[18]。转化生长因子β选择性使lincRNA-ROR在肝癌细胞分泌的外泌体中表达增加,使HCC细胞对索拉菲尼敏感性降低,对其产生耐药性而降低疗效[19]。在肝癌HepG2、97L、LM3等细胞系分泌的外泌体中发现,circPTGR1与间质表皮转化因子(MET)竞争性靶向miRNA449a促进肝癌的发生、发展[20]。肝癌细胞分泌的外泌体circ-100338可通过作用人脐静脉内皮细胞促进血管生成,使肝癌发生转移[21]。Circ-0061395在肝癌分泌的外泌体中表达增加,可通过miR-877-5p/PIK3R3轴影响细胞增殖、侵袭、迁移等能力促进肝癌的发生、发展[22]。肝癌细胞分泌的外泌体中circUHRF1表达增加造成自然杀伤细胞功能紊乱,circUHRF1可通过降解miR-449c-5p上调TIM-3的机制诱导自然杀伤细胞的功能障碍,参与免疫抑制导致肝癌预后较差[23]。因此,肝癌分泌的外泌体中含有大量核酸物质在肝癌转移、发生、发展及治疗中均发挥了重要的作用,在肝癌的诊断和预后治疗方面具有巨大潜力,外泌体中更多的核酸其生物功能需进一步研究发现。
本研究通过HepG2细胞外泌体与正常LO2细胞共同培养后对其circRNA表达谱进行了全面测序,按FC>2且P<0.05为筛选标准,筛选出235个差异表达的circRNA,其中50个circRNA上调表达,185个circRNA下调表达。通过火山图、聚类热图等分析,在HepG2细胞外泌体与正常LO2细胞共同培养后筛选出差异表达明显上调或下调的前5个circRNA,并通过实时荧光定量PCR验证hsa_circRNA_0010044、hsa_circRNA_009012、hsa_circRNA_101016、hsa_circRNA_100917、hsa_circRNA_007918等circRNA经外泌体处理后表达水平明显上调,差异有统计学意义(P<0.05);hsa_circRNA_002082、hsa_circRNA_103128、hsa_circRNA_092388、hsa_circRNA_007343、hsa_circRNA_071935等circRNA经外泌体处理后表达水平明显下调,差异有统计学意义(P<0.05)。通过GO、KEGG富集分析,经HepG2外泌体处理后LO2细胞中表达上调或下调前5个的circRNA的宿主基因可能参与了转录调控、RNA聚合酶Ⅱ启动子转录的调控血管内皮生长因子受体信号通路、蛋白质结合、DNA结合、转录因子激活结合、细胞周期、MAPK信号通路、PI3K-Akt信号通路、神经营养蛋白信号通路等生物过程。细胞周期是细胞分裂和复制的过程,与细胞增殖、分化密切相关,而细胞增殖失控正是癌症发生、发展的特征之一[24]。
综上所述,hsa_circRNA_0010044、hsa_circRNA_009012、hsa_circRNA_101016、hsa_circRNA_100917、hsa_circRNA_007918等5个表达上调和hsa_circRNA_002082、hsa_circRNA_103128、hsa_circRNA_092388、hsa_circRNA_007343、hsa_circRNA_071935等5个表达下调的circRNA可能影响肝癌的发生、发展,有可能成为潜在的生物标志物,为今后研究肝癌的发生机制提供了理论依据。同时,本研究尚存在一些不足,由于实验条件和时间的限制对差异表达的circRNA只在细胞上进行了初步的验证其表达,并未进行后续实验验证。因此,今后仍需增加后续相关验证实验,逐步验证其生物功能,进一步研究circRNA在肝癌发生、发展中的作用机制。

