超声引导ESPB与TPVB联合静脉自控镇痛用于三孔胸腔镜肺叶切除术中的随机对照研究*
朱肖萌,范 飒
(河北省保定市第二医院麻醉科 071000)
相关临床资料显示,三孔胸腔镜肺叶切除手术虽属微创术式,创伤较小,但患者仍易因手术切口、胸壁神经、肋间肌损伤等出现炎性应激反应及术后疼痛,积极采取科学、有效镇痛处理是保证手术整体效果、促进机体康复的重要措施[1-2]。受损组织炎性反应、神经损伤等是引起术后疼痛的最主要原因[3],除静脉自控镇痛外,安全、有效的神经阻滞技术也可针对上述途径对术后疼痛实施干预[4]。竖脊肌平面阻滞(erector spinae plane block,ESPB)、胸椎旁神经阻滞(thoracic paravertebral block,TPVB)是胸外科手术常用的2种神经阻滞技术,均有良好的安全性及可行性[5],但二者在术后镇痛中的应用效果尚存在争议。本研究采用多模式镇痛方案,观察了超声定位下ESPB与TPVB分别联合静脉自控镇痛在三孔胸腔镜肺叶切除手术术后镇痛中的应用效果,旨在为临床选择提供参考。
1 资料与方法
1.1 一般资料

1.2 纳入标准
(1)经胸部X线片、CT等影像学及组织病理学检查确诊为原发性肺癌;(2)具备三孔胸腔镜肺叶切除手术适应证,且行单侧手术;(3)凝血功能、血常规、传染5项等术前常规检查结果正常;(4)无麻醉药物过敏史;(5)入院近2周内未服用过镇痛药物,且既往无长期镇痛药物使用史;(6)对本研究知情并签署同意书。
1.3 排除标准
(1)重要器官(心、肝、肾等)功能障碍;(2)合并其他恶性肿瘤;(3)妊娠、哺乳期女性;(4)对本研究所用麻醉方案存在使用禁忌证或不耐受;(5)患有精神类、自身免疫、血液系统疾病;(6)术前合并慢性疼痛;(7)穿刺部位皮肤感染。
1.4 方法
1.4.1手术方法
术前常规禁食8 h,禁饮4 h,入室后开放外周静脉通道,穿刺桡动脉置管,连接心电监护设备,检测脑电双频谱指数(bispectral index,BIS)。两组患者均于气管插管全身麻醉下实施三孔胸腔镜肺叶切除手术,术后予以静脉自控镇痛;TPVB组在麻醉诱导前实施超声定位下TPVB,ESPB组在麻醉诱导前实施超声定位下ESPB。
1.4.2超声定位下TPVB
患者取健侧卧位,常规消毒、铺巾,以Edge型超声(美国Sonosite)高频线阵探头扫描T5棘突,以横突为标志,在超声视窗中找到肋横突韧带、胸膜形成的三角形胸椎旁间隙,体表定位;平面内横向入路进针至胸椎旁间隙,进针深度35~60 mm,针尖至胸膜上方;回抽无出血、无气体后于胸椎旁间隙注入罗哌卡因(河北一品制药股份有限公司,国药准字H20173027)100 mg;注入局部麻醉(局麻)药后可见胸膜下移,注射完成后5、10、15 min以针刺法检查阻滞平面。

表1 两组患者一般资料比较
1.4.3超声定位下ESPB
患者取健侧卧位,常规消毒、铺巾,以Edge型超声(美国Sonosite)高频线阵探头扫描T5棘突,探头外移至显现T5、T6横突,可见斜方肌、大菱形肌、竖脊肌覆盖横突表面;平面内头向尾端进针,针尖触及横突骨质后,进针深度35~60 mm;回抽无出血、无气体后于竖脊肌、横突间注入罗哌卡因100 mg;可见局麻药在竖脊肌平面内扩散,注射完成后5、10、15 min以针刺法检查阻滞平面。
1.4.4气管插管全身麻醉
(1)麻醉诱导:依次静脉注射舒芬太尼(宜昌人福药业有限责任公司,国药准字H20054172)0.5 μg/kg、咪达唑仑(江苏恩华药业股份有限公司,国药准字H20143222)0.02~0.05 mg/kg、罗库溴铵(浙江仙琚制药股份有限公司,国药准字H20093186)0.6 mg/kg、依托咪酯(江苏恒瑞医药股份有限公司,国药准字H32022379)0.3~0.4 mg/kg;面罩通气,待BIS低于50、肌肉松弛后置入双腔管,连接呼吸机进行机械通气。(2)麻醉维持:以全凭静脉麻醉维持,持续泵注瑞芬太尼(江苏恩华药业股份有限公司,国药准字H20143315)12~20 μg·kg-1·h-1、丙泊酚(四川国瑞药业有限责任公司,国药准字H20030114)4~6 mg·kg-1·h-1、右美托咪定(江苏恒瑞医药股份有限公司,国药准字H20130093)0.2~0.7 μg·kg-1·h-1,术中按需追加罗库溴铵0.1~0.2 mg/kg;手术结束后进入麻醉恢复室(postanesthesia care unit,PACU)进行监测及麻醉复苏。
1.4.5静脉自控镇痛
术后连接电子镇痛泵(爱朋,ZZB-Ⅳ型)持续进行静脉自控镇痛,负荷量为5 mL,镇痛药物配方:150~200 μg舒芬太尼联合8~12 mg昂丹司琼(吉林菲诺制药有限公司,国药准字H20058614),混合后以注射用生理盐水稀释至100 mL;设置背景剂量为1 mL/h,自控追加剂量为1 mL,锁定时间为10 min;术后48 h撤掉镇痛泵。
1.5 观察指标
1.5.1临床监测指标
(1)记录心电监护设备上阻滞前(T0)、手术切皮时(T1)、手术开始后30 min(T2)、术毕拔管时(T3)心率、平均动脉压(mean arterial blood pressure,MAP)以评估两组患者血流动力学变化情况。(2)分别于T0、T3、术后24 h(T4)、术后48 h(T5)采集两组患者外周静脉血约5 mL,3 500 r/min低温离心5 min后取上层血清,采用全自动生化分析仪(贝克曼库尔特,IMMAGE)以酶联免疫吸附法测定肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-8(IL-8)、白细胞介素-6(IL-6)水平以评估两组患者炎性反应水平;采用免疫比浊法测定免疫球蛋白A(immunoglobulin A,IgA)、免疫球蛋白M(immunoglobulin M,IgM)、免疫球蛋白G(immunoglobulin G,IgG)水平以评估两组患者体液免疫水平。
1.5.2临床指标
(1)分别于术后1、6 h,T4、T5采用疼痛数字评分法(NRS)评估两组患者静息、咳嗽状态下疼痛程度,总分为0~10分,评分越高表示疼痛越严重;(2)统计比较两组患者PACU补救镇痛比例(静息状态下NRS评分大于4分时静脉推注曲马多1 mg/kg)、镇痛泵应用情况(静脉自控镇痛输注总量、静脉自控镇痛按压次数)和不良反应发生情况(包括恶心、呕吐、头晕、后背痛等)。
1.6 统计学处理
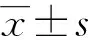
2 结 果
2.1 神经阻滞平面
TPVB组患者在采取阻滞15 min后平均阻滞平面为(6.72±0.94)节段;ESPB组在采取阻滞15 min后平均阻滞平面为(6.46±1.02)节段,两组比较,差异无统计学意义(t=1.365,P=0.175)。
2.2 血流动力学变化
两组患者心率、MAP水平组间、不同时间点及交互作用比较,差异均无统计学意义(P>0.05);两组患者T0~T3时心率、MAP水平比较,差异均无统计学意义(P>0.05);两组患者T1~T3时心率、MAP水平均较T0时明显降低,差异均有统计学意义(P<0.05),见表2、图1。
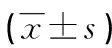
表2 两组患者各时间点血流动力学变化比较

a:P<0.05,与同组T0时比较。
2.3 血清炎性反应水平
两组患者血清TNF-α、IL-8、IL-6水平组间、不同时间点及交互作用比较,差异均有统计学意义(P<0.05);TPVB组患者血清TNF-α、IL-8、IL-6升高幅度更低。两组患者T0时血清TNF-α、IL-8、IL-6水平比较,差异均无统计学意义(P>0.05);TPVB组患者T3~T5时均明显低于ESPB组,差异均有统计学意义(P<0.05);两组患者T3~T5时均较T0时提高,差异均有统计学意义(P<0.05),见表3、图2。
2.4 血清体液免疫水平
两组患者血清IgA、IgM、IgG水平组间、不同时间点及交互作用相比,差异均有统计学意义(P<0.05);TPVB组患者血清IgA、IgM、IgG降低幅度更小。两组患者T0时血清IgA、IgM、IgG水平比较,差异均无统计学意义(P>0.05);TPVB组患者T3~T5时均明显高于ESPB组,差异均有统计学意义(P<0.05);两组患者T3~T5时均较T0时明显降低,差异均有统计学意义(P<0.05),见表4、图3。
2.5 NRS评分
TPVB组患者术后1、6 h,T4、T5静息与咳嗽状态下NRS评分均较ESPB组低,差异均有统计学意义(P<0.05),见表5。
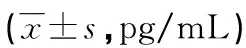
表3 两组患者各时间点血清炎性反应水平比较
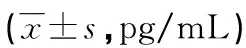
续表3 两组患者各时间点血清炎性反应水平比较

组别nIL-6T0T3T4T5TPVB组5360.49±7.0296.93±8.26145.14±10.39126.03±9.65ESPB组5358.51±8.24143.47±10.35185.16±13.42167.58±12.51组间比较F=7.812,P=0.008各时间点比较F=9.328,P=0.001交互作用比较F=8.640,P=0.001
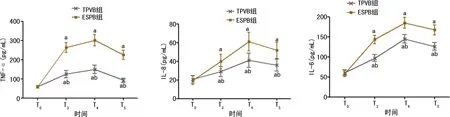
a:P<0.05,与同组T0时比较;b:P<0.05,与ESPB组比较。
图2 两组患者各时间点血清炎性反应水平比较

组别nIgMT0T3T4T5TPVB组5318.61±2.4216.58±2.0515.39±1.7216.15±1.97ESPB组5319.09±2.6014.26±1.8712.95±1.4813.72±1.63组间比较F=8.018,P=0.009各时间点比较F=8.761,P=0.001交互作用比较F=8.429,P=0.001

组别nIgGT0T3T4T5TPVB组5314.73±2.8412.97±1.5711.75±1.8012.38±2.16ESPB组5315.06±2.3910.43±1.269.72±1.5010.16±1.75组间比较F=8.004,P=0.010各时间点比较F=8.976,P=0.001交互作用比较F=8.501,P=0.001
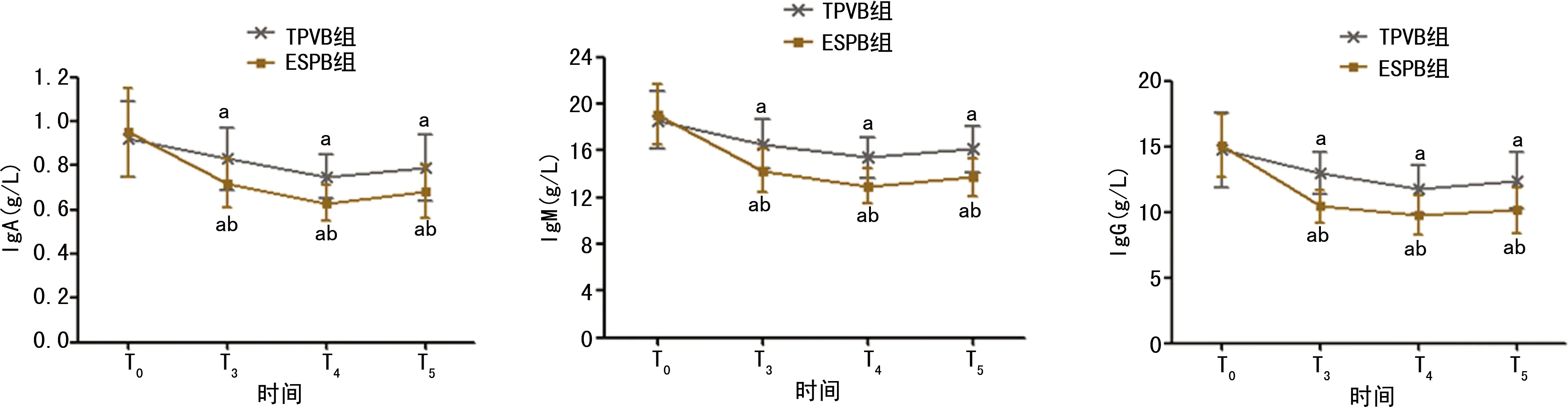
a:P<0.05,与同组T0时比较;b:P<0.05,与ESPB组比较。
2.6 PACU补救镇痛比例、镇痛泵应用情况及镇痛药物配方舒芬太尼剂量
两组患者镇痛药物配方舒芬太尼剂量比较,差异无统计学意义(P>0.05);TPVB组患者PACU补救镇痛比例、静脉自控镇痛输注总量、按压次数均较ESPB组低,差异均有统计学意义(P<0.05),见表6。
2.7 不良反应发生情况
两组患者不良反应发生率比较,差异无统计学意义(P>0.05),见表7。
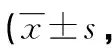
表5 两组患者各时间点静息与咳嗽状态下NRS评分比较分)
表6 两组患者PACU补救镇痛比例、镇痛泵应用情况、镇痛药物配方舒芬太尼剂量比较

表7 两组患者不良反应发生情况比较[n(%)]
3 讨 论
术后疼痛是三孔胸腔镜肺叶切除手术最常见的一类并发症[6],据数据统计,术后8 h内患者静息状态时也存在剧烈疼痛感,术后24~48 h静息状态下疼痛虽有所缓解,但在咳嗽或其他活动时疼痛感依然较为强烈[7],如何减轻术后疼痛已成为麻醉医师关注的重点问题。
静脉自控镇痛是减轻术后疼痛最直接的方式,但舒芬太尼及其他阿片类镇痛药物的应用易引起恶心、呼吸抑制等不良反应,影响患者的康复[8]。随麻醉技术及加速康复外科的发展,围术期多模式镇痛方案已逐渐受到临床重视,多提倡联合运用不同机制的镇痛方法以提高镇痛效果,减少麻醉药物使用,保证麻醉安全性[9-10]。硬膜外阻滞是既往临床用于胸外科手术术后镇痛的“金标准”,但存在发生硬膜外血肿、低血压等严重并发症的风险,且对凝血功能要求严格,进而限制了其临床应用[11]。随超声可视化技术在麻醉领域的不断发展,超声定位下ESPB、TPVB等区域神经阻滞技术已逐渐用于胸外科手术围术期多模式镇痛,且可在患者术后康复中发挥良好的促进作用,为麻醉医师提供了更多的选择[12-13]。基于此,本研究对三孔胸腔镜肺叶切除手术患者实施了超声定位下神经阻滞联合静脉自控镇痛的多模式镇痛方案,以弥补单一静脉自控镇痛的不足之处,并分组从术中血流动力学、术后疼痛、炎性反应、免疫状态等多个影响机体康复的方面比较了ESPB、TPVB的应用效果。其中TPVB是近年来备受关注的区域神经阻滞技术,胸椎旁间隙包含肋间神经及其背侧支、交通支、交感干,包含了感觉、运动神经纤维[14],因此,可对脊神经根、肋间神经产生确切阻滞效果,且仅阻滞单侧脊神经,对循环、呼吸影响较小[15]。ESPB属新型躯干神经阻滞技术,局麻药物注射至竖脊肌下筋膜间隙后可通过作用于脊神经背侧支、腹侧支达到镇痛作用[16];同时沿胸腰筋膜向头端、尾端纵行扩散至胸椎旁间隙,阻滞范围基本覆盖胸外科手术创伤范围,且在超声引导下实施操作较为简单,可避免肥胖、脊柱畸形、胸腔积液等的影响[17]。
本研究首先针对围术期血流动力学指标进行了分析,结果显示,与T0时比较,两组患者术中心率、MAP水平均有所降低,差异均有统计学意义(P<0.05),可能与ESPB、TPVB对交感神经节的阻滞作用导致外周血管扩张有关;两组患者术中各时间点心率、MAP水平比较,差异均无统计学意义(P>0.05),且波动较小,可见ESPB、TPVB联合全凭静脉麻醉均可有效维持术中血流动力学稳定。手术创伤性刺激可破坏机体促炎性细胞因子、抗炎性细胞因子平衡状态,引起炎性反应,加重机体损伤[18]。TNF-α、IL-8、IL-6均属促炎性细胞因子,其血清水平可因手术创伤异常升高,可有效反映机体炎性反应程度,且与术后疼痛严重程度有一定相关性[19]。此外,手术疼痛除刺激应激性炎性反应外,还可损伤机体免疫功能,抑制免疫应答,使IgA、IgM、IgG等重要体液免疫因子表达降低[20]。此外,郭荣鑫等[21]研究表明,与ESPB比较,胸椎旁阻滞可明显减少术后补救镇痛例数,术后镇痛效果更佳。本研究镇痛效果评估及血标本检查结果显示,与ESPB组比较,TPVB组患者在减轻术后疼痛方面效果更为显著,可避免补救镇痛,减少静脉自控镇痛输注总量及按压次数,与上述研究结论一致,而且还发现TPVB组患者炎性反应较轻,对体液免疫影响较小。实施超声定位下ESPB时局麻药物可沿竖脊肌、肋间肌扩散,作用于同侧脊神经背侧支,产生广泛的前胸、侧胸壁皮区感觉阻滞[22];而实施超声定位下TPVB时局麻药物可走行于椎旁间隙的椎旁神经、交感神经,并扩散至硬脊膜外腔、椎前间隙、对侧椎旁间隙,且胸椎旁间隙存在连续性解剖结构,单点注射后药物可向上、下扩散,阻滞多个皮肤节段[23]。而神经阻滞效果与药物扩散密切相关,与肌肉筋膜间隙比较,相同容量局麻药物在胸椎旁间隙更易扩散[24],因此,超声定位下TPVB对胸壁、内脏的镇痛效果更佳,进而减轻了手术刺激引起的炎性反应及免疫抑制。本研究两组患者麻醉安全性均良好,未引起严重不良反应,可见多模式镇痛方案可有效避免因麻醉药物用量过多引起的机体不适。
综上所述,超声定位下TPVB联合静脉自控镇痛是麻醉技术、药理学相结合的多模式镇痛方案,镇痛效果理想,可稳定患者术中血流动力学状态,减轻手术疼痛感,缓解炎性反应及免疫抑制,减少镇痛泵的使用,且麻醉安全性良好,可充分发挥区域麻醉优势。但超声定位下TPVB对解剖学及超声技术要求较高,麻醉医师需加强学习,熟练掌握操作方法,以保证整体效果。

