LAMP和MALDI-TOF-MS技术在检测食品中沙门氏菌方面的应用
刘单单 李婉珊 周露 苏章庭 曾晓琮
(广东省食品检验所 广东广州 510435)
1 前言
沙门氏菌(Salmonella)为革兰氏阴性菌,具有鞭毛、无荚膜,分类为肠杆菌科的沙门氏菌属,属于兼性胞内致病菌,是最常见的肠道致病菌,可引起食物中毒[1-2]。沙门氏菌有多种抗原,上千种血清型,许多血清型可产毒素,严重危害人类和畜禽健康。沙门氏菌可在世界各地爆发流行,每年因食物感染沙门氏菌而患病的事件已屡见不鲜,是各个国家食品检验机构的必检项目之一[3]。
目前有多种方法可对食品中沙门氏菌进行检测,其中既有基于生理生化反应和血清型鉴定的国家标准方法(国标法)[4],也包括较先进的酶联免疫法(ELISA)[5-6]、PCR法[7-8]、基质辅助激光解吸电离飞行时间质谱法(MALDI-TOF-MS)法[9-10]等。食品中沙门氏菌检测的国标法作为公认的最基础、最准确的方法,其操作步骤主要包括预增菌、增菌、分离纯化、生化试验、血清学鉴定等,然而整个检测过程时间周期长、操作繁琐,需要5~7 d才能完成,无法适用于大批量样本的检测。基于免疫学的ELISA方法,也是在沙门氏菌检测中常用的方法[11]。
KUMAR等[12]建立了基于单克隆抗体的酶联免疫吸附试验(sELISA),用于快速检测食品和水样中的伤寒沙门菌血清型,并优化了用于提高检测灵敏度的富集程序。Febo等[13]采用单克隆抗体4E6F11对84个样品进行检测,且与采用ISO 6579:2002检测的结果一致。然而,该方法只适合于特定沙门氏菌的检测,而且抗干扰能力和灵敏度相对较低,不适合大批量未知沙门氏菌种类样本的检测。PCR法在沙门氏菌检测中应用越来越广泛,包括如环介导等温扩增技术(LAMP)、多重PCR法、套式PCR法、实时荧光PCR法,以及PCR法与微板检测、ELISA和其他技术相结合的方法等[14-15]。MALDI-TOF MS法在菌株水平上对微生物进行精确和详细的鉴别方面具有很大的潜力[16-17]。利用PCR和MALDI-TOF-MS相结合的方法在沙门氏菌快速检测中具有较大优势。Li等[18]利用LAMP和MALDI-TOF-MS技术检测沙门氏菌,检测时间从3~7 d缩减至1~3 d。PCR法和MALDI-TOF-MS法的检测时效性强,检测周期较国标法短,但是检测结果无法定位至沙门氏菌血清型。
基于此,本研究采用LAMP和MALDI-TOF-MS技术对2个未知食品样品进行沙门氏菌检验,通过对比国标法的检测结果,评价每种检测方法的时效性和准确性,为大批量样本沙门氏菌检测规程的建立提供重要技术参考。
2 实验材料
2.1 样品来源
食品样品A和B均由中国检验检疫科学研究院提供,每份样品均由透明玻璃瓶包装。
2.2 仪器设备
主要实验仪器:LRH-250生化培养箱(上海一恒科学仪器有限公司);VITEK 2 Compact自动微生物快速检测分析系统(法国梅里埃);AxioScope A1显微镜(德国卡尔蔡司);Masticator均质器(西班牙IUL);恒温扩增荧光检测仪(广州迪澳生物科技有限公司);VITEK MS全自动快速微生物质谱检测系统(法国梅里埃)。
主要试剂:缓冲蛋白胨水(buffered peptone water,BPW);亚硫酸铋琼脂(bismuth sulfite,BS);营养琼脂(nutrient agar,NA);沙门氏菌生化鉴定盒(广东环凯微生物科技有限公司);四硫磺酸钠煌绿(tatrathionate broth,TTB)增菌液;亚硒酸盐胱氨酸(selenite cystine,SC)增菌液;木糖赖氨酸脱氧胆盐(xylosely sine desoxycholate,XLD)琼脂;沙门氏菌属显色培养基(陆桥、法国科玛嘉);三糖铁琼脂(triple sugar iron,TSI);革兰氏阴性细菌鉴定卡;沙门氏菌核酸检测试剂盒(恒温荧光法);细菌基因组DNA快速提取试剂盒(广州迪澳生物科技有限公司);两套沙门氏菌诊断血清(分别来自丹麦SSI公司和宁波天润生物药业有限公司)。
阳性对照菌株:ATCC 14028鼠伤寒沙门氏菌(广东环凯微生物科技有限公司)。
阴性对照菌株:ATCC 25922大肠杆菌(广东环凯微生物科技有限公司)。
质谱指控菌株:ATCC 8739大肠杆菌(广东环凯微生物科技有限公司)。
3 实验方法
3.1 样品前处理
按照作业指导书要求,样品前处理全程在生物安全柜中进行。准备灭菌生理盐水40 mL,开启样品瓶后,立即加入4 mL无菌生理盐水水化,待溶解后,吸出置于无菌采样袋中,再反复用余下的无菌生理盐水清洗西林瓶内壁,回收清洗液置于上述无菌采样袋中,此40 mL溶液即为待测样品原液。依此方法,分别对2份样品进行前处理,各操作环节应保证充分混匀。
3.2 国标法分析
实验中涉及的预增菌、增菌、划线分离、NA纯化、生化实验、VITEK 2 Compact鉴定及血清学鉴定均依据GB 4789.10-2016《食品安全国家标准 食品微生物学检验 沙门氏菌检验》要求进行。
3.3 环介导等温扩增分析
(1)模板提取
把各个样品的TTB、SC增菌液摇匀,取100μL增菌液转移至DNA提取管中(已预装900μL的DNA提取液)。涡旋震荡混匀,100℃条件下热浴5~10 min。完成后上清液即为提取的核酸基因组,用于后续PCR反应需求。依照沙门氏菌核酸检测试剂盒(恒温荧光法)的说明进行试剂配制、加样与检测。
(2)反应程序
将63℃45 s作为1个循环,于63℃45 s处搜集荧光信号,进行45个循环。
3.4 基质辅助激光解吸电离飞行时间质谱分析
从NA板上挑取各个可疑沙门氏菌以及阳性菌落、质控菌株的新鲜菌落于384孔靶板上点样,每个样品用1.2μL的HCCA基质溶液覆盖,并在室温下干燥后用于质谱检验。
4 结果与分析
4.1 可疑沙门氏菌株筛选
利用陆桥沙门氏菌显色培养基、科马嘉沙门显色培养基、XLD沙门氏菌显色培养基和BS沙门氏菌选择性培养基对样品A和B的增菌液进行划线分离培养(图1)。选择多种培养基,可以很大程度上减少漏检几率。样品A、B分别在4种培养基中筛选到10和13株疑似沙门氏菌株,菌株的菌落特征如表1所述。

图1 样品在四种沙门氏菌培养基平板划线结果

表1 A、B和ATCC 14028菌株增菌液在四种培养基中的菌落特征
4.2 国标法生化鉴定结果分析
4.2.1 三糖铁和赖氨酸脱羧酶试验
样品A、B分别筛选到的10和13株疑似沙门氏菌株进行三糖铁和赖氨酸脱羧酶试验,各株菌在三糖铁琼脂和赖氨酸脱羧酶试验培养基中的反应结果如表2所示。编号A-a、A-c、A-e、A-g、A-i、B-a、B-c、B-f、B-h、B-m等10株菌为可疑沙门氏菌属。
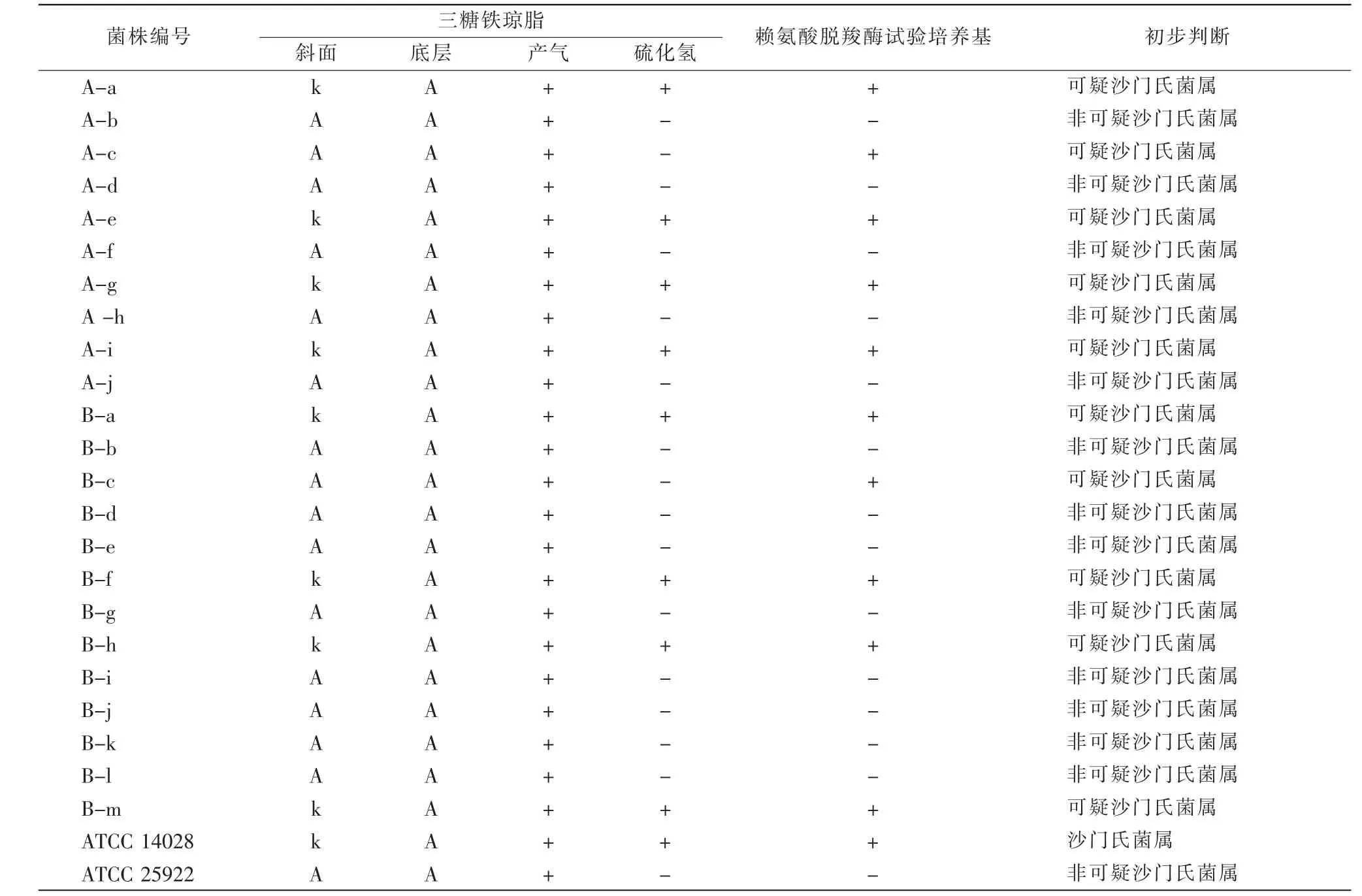
表2 各可疑沙门氏菌株在三糖铁琼脂和赖氨酸脱羧酶试验培养基内的反应结果
4.2.2 生化试剂条试验和VITEK 2 Compact自动微生物快速检测分析
将筛选出的10株可疑沙门菌株经NA平板纯化后,进行生化试剂条试验,结果如表3所示。A-a、A-e、A-g、A-i、B-a、B-f、B-h、B-m等8株菌为可疑沙门氏菌属,A-c和B-c为非沙门氏菌属。
VITEK 2系统采用微生物和其发生生化反应的数据来鉴定微生物。菌株的生化试验反应结果,与数据库中菌株的反应结果相比较,进而推测菌株的典型性反应,其中可能性百分率用来计算反应结果与典型微生物相关和匹配度,可信限范围为85%~99%。利用VITEK 2 Compact自动微生物快速检测分析系统对4株菌的生化鉴定结果如表3所示。与生化试剂条试验结果一致,菌株A-c和B-c为克雷伯氏菌属的概率为99%;菌株A-a、A-e、A-g、A-i、Ba、B-f、B-h和B-m符合沙门氏菌的典型性反应,因此初步鉴定这8株菌为沙门氏菌。本结果初步表明样品A和B可能为沙门氏菌阳性样品。

表3 可疑沙门氏菌株生化试剂条和VITEK 2系统鉴定结果
4.2.3 血清学鉴定结果
进一步,将生化实验判定为沙门氏菌的菌株Aa、A-e、A-g、A-i、B-a、B-f、B-h和B-m进行血清学鉴定。根据标准中GB4789.4-2016,采用1.8%琼脂培养物作为玻片凝集试验用的抗原,然后在洁净的玻片上滴加一滴生理盐水,制成均一性的混浊悬液,观察结果为无自凝性反应。对无自凝的培养物参照国标方法进行血清学鉴定,以生理盐水对照。经血清学鉴定,A-a、A-e、A-g、A-i、B-a、B-f、B-h和B-m血清型均为肠炎沙门氏菌(Salmonella enterica ssp.enterica.Enteritidis),详见表4。

表4 可疑沙门氏菌株血清学鉴定结果
4.3 环介导等温扩增结果分析
环介导恒温扩增技术(LAMP)荧光法检测法,是基于2对特殊引物和具有链置换活性的Bst DNA聚合酶技术,实现了在恒温条件下(60℃~65℃)进行连续快速扩增的可能,由于反应体系中已经加入了显色指示剂,可通过在线读取显色剂的颜色变化来判读结果,避免了开盖过程中造成的核酸产物的污染,又避免了常规PCR中不同步骤不同温度的设计要求,因此,与常规PCR相比,LAMP技术具有简单、快速、特异性强的特点,更适合现场高通量的快检。
利用LAMP技术对样品A和B的增菌液BPW、TTB和SC进行分析。扩增曲线如图2所示。阴性对照ATCC 25922未检测到沙门氏菌的FAM荧光信号,而ATCC 14028、样品A和B的BPW、TTB和SC增菌液均检测到沙门氏菌的FAM的荧光信号。与国标检测方法一致,LAMP技术检测表明样品A和B为沙门氏菌阳性样本,详见表5。

图2 A和B样品的BPW、TTB和SC增菌液LAMP扩增曲线

表5 A和B样品的LAMP检测结果
4.4 基质辅助激光解吸电离飞行时间质谱分析
利用MALDI-TOF-MS技术对从A样品中分离到的可疑菌株(A-a、A-e、A-g和A-i)、B样品中分离到的可疑菌落(B-a、B-f、B-h和B-m)以及标准菌株ATCC 14028鼠伤寒沙门氏菌(PC-a和PC-b)进行检测,获得这10株菌株的蛋白质指纹图谱,结果如图3所示。通过图谱及原始数据进行比较,得出10株沙门氏菌主要的离子峰为2488-2489、2691-2692、2807-2808、2893-2894、3006、3047-3049、3580-3581、4366-4368、4622-4623、4764-4766、5384-5386、5616-5619、6013-6015、6097-6101、6258-6262、7162-7165、7665-7669、8335-8338、9245-9249、9528-9532、10292-10294、10962-10968等。

图3 可疑沙门氏菌的MALDI-TOF-MS蛋白质指纹图谱
其中,A和B样品内分离的菌株以及标准菌株平行菌落的离子峰最为相似,基本无差异离子峰;A、B以及标准菌株共有的离子峰有4366-4368、4764-4766、5384-5386、6258-6262、7162-7165、9245-9249、9528-9532等;A与B特有的离子峰有2488-2489、2691-2692、3580-3581等;A与标准菌株无特有的离子峰;B与标准菌株特有的离子峰有2807-2808、3047-3049、5616-5619、6097-6101、7665-7669、10962-10968等;A特有的离子峰有4622-4623、10292-10294等;B特有的离子峰有2893-2894等;标准菌株特有的离子峰有3006、6013-6015、8335-8338等。
经质谱数据库比对,得到鉴定结果如表6所示。鉴定结果显示,A-a、A-e、A-g、A-i、B-a、B-f、B-h、B-m为肠炎沙门氏菌种肠炎亚种I,菌株鉴定的可信度较高,因此可以确定这8株可疑沙门氏菌株为沙门氏菌。有研究发现,4366-4368、5384-5386、6258-6262、7162-7165、9528-9532等A、B以及标准菌株共有的离子峰也是甲型副伤寒沙门氏菌MALDI-TOF-MS检测的共有离子峰[10]。我们推测,这些离子峰可能是沙门氏菌的特征性离子峰。本研究的MALDI-TOF-MS检测结果表明,样品A和B为沙门氏菌阳性样品。

表6 可疑沙门氏菌株MALDI-TOF-MS鉴定结果
5 讨论
沙门氏菌是一种常见的食源性致病菌,食用被其污染的食品后可进入人体或动物肠道内,过量食用或经大量繁殖后,可引起食物中毒,全世界每年因沙门氏菌导致的食源性疾病高达数千万人[19]。选择何种检测方法,对沙门氏菌进行快速准确的定性检验,也是当今研究学者们讨论的热门话题之一,对于食品生产企业,尤其是畜禽肉产品经营者来说也至关重要。
6 结论
本文分别采用国标法、LAMP法和MALDITOF-MS法对样品A和B进行检测,检测结果均为沙门氏菌阳性,表明这3种检测方法具有很好的准确性、可靠性和一致性。对3种方法所用检测过程及优缺点进行比较,结果如表7所示。国标方法的检测过程包括预增菌(8~18 h)、增菌(18~24 h)、划线培养(沙显18~24 h;BS 40~48 h)、NA纯化(18~24 h)、生化验证(18~24 h或48 h)等,每个样品总的检测时间为5~7 d;LAMP法的检测过程包括预增菌(8~18 h)、增菌(18~24 h)、检测(约1 h)。每个样品总的检测时间为2 d;MALDI-TOF-MS方法的检测过程包括预增菌(8~18 h)、增菌(18~24 h)划线培养(沙显18~24 h;BS 40~48 h),NA纯化18~24 h,检测(约1 h),每个样品总的检测时间为4~5 d。

表7 国标法、LAMP和MALDI-TOF-MS 3种方法检测过程及优缺点比较
比较3种方法发现,国标方法中涉及的生化和血清学分型方法准确、可靠,是目前国标方法是目前沙门氏菌的主流方法,也是世界上公认的沙门菌鉴定方法,但是检测过程较为繁琐、耗时长,对于人员的要求较高[20];LAMP法灵敏度高、操作简便、耗时最短、结果易判读;不足之处在于其仪器成本和环境要求较高,不能进行准确的沙门氏菌分型检验,检测过程易形成气溶胶,造成实验室污染。MALDITOF-MS法是近几年发展起来的一种全新的用于微生物鉴定和分型的技术,可根据细菌可产生特定的蛋白指纹图谱,已越来越多地用于微生物的检测与鉴定[21]。其检测过程简单,效率和准确率双高,但对仪器要求较为特殊,仪器成本及配套试剂成本较高,对于沙门氏菌的鉴定目前只能鉴定到种或亚种的水平,不能准确鉴定到血清型。
综上所述,今后在检测大批量沙门氏菌样品或突发的应急检验时,建议采用LAMP法作为快速检测的方法,优先对检验结果进行预判,后续阳性样品可进一步采用国标方法进行生化和血清型鉴定,而MALDI-TOF-MS法作为辅助检测方法可提高样品检测的准确性和可靠性,从而缩短检测时间,提高检测效率,尽早对食源性致病菌的突发事件做出处理。

