窖藏和冷藏条件下鸭梨挥发性物质及其相关基因表达分析
岳盈肖,何近刚,赵江丽,闫子茹,程玉豆,武肖琦,王永霞,关军锋
窖藏和冷藏条件下鸭梨挥发性物质及其相关基因表达分析

1河北工程大学生命科学与食品工程学院,河北邯郸056038;2河北省农林科学院生物技术与食品科学研究所/河北省植物转基因中心,石家庄050051
【】比较窖藏和冷藏过程中,鸭梨果实品质、呼吸速率、乙烯释放速率、电子鼻特征、挥发性物质及其相关基因表达的差异,进一步解析两种贮藏方式对鸭梨香气物质形成的影响及其机制。鸭梨采收后以窖藏和冷藏两种方式贮藏,测定贮藏期间果实硬度、可溶性固形物含量(SSC)、可滴定酸(TA)含量、呼吸速率和乙烯释放速率,使用电子鼻检测挥发性物质变化,利用气质联用色谱(GC-MS)测定挥发性物质成分及含量,利用荧光定量PCR(Real-time PCR)技术分析乙烯生成(、)及其信号转导(、、、、、)、挥发性物质合成(、、、、、、)相关基因的表达量变化情况。冷藏期间,鸭梨果实硬度变化较小,SSC上升,TA含量下降。窖藏时,果实硬度下降比较明显,但对SSC的影响较小,而TA含量增加。与冷藏相比,窖藏下果实呼吸速率较高,乙烯释放高峰提前1个月出现,且其峰值较高。电子鼻可有效区分两种贮藏方式下的挥发性物质,其中W1W、W5S、W2W、W1S这4种传感器对挥发性物质区分起主要作用;窖藏期间果实挥发性物质较多。鸭梨果皮和果肉的挥发性物质包含醛类、酯类、醇类、萜类、烷烃类等,且果皮中含量较高;窖藏果皮和果肉、冷藏果皮和果肉中分别检出36种和33种、28种和24种挥发性物质,窖藏鸭梨较冷藏时生成更多的乙酯类化合物,其中己酸乙酯、辛酸乙酯、丁酸乙酯、(E,Z)2,4-癸二烯酸乙酯等为果皮主要香味物质,己酸乙酯、丁酸乙酯为果肉主要香味物质。相关基因的表达分析表明,与冷藏相比,窖藏明显上调鸭梨果皮和果肉ACC氧化酶()脂氧合酶()和醇酰基转移酶()相关基因的表达,下调乙烯不敏感转录因子()的表达。在贮藏3个月内,与冷藏鸭梨相比,窖藏条件明显促进乙烯生成()和香气合成(、)等基因的表达,此时果实具有较多的香气物质种类和较高含量,表现出香味浓郁的特点。
鸭梨;品质;挥发性物质;电子鼻;乙烯;基因表达
0 引言
【研究意义】挥发性芳香物质是水果风味物质的重要组成部分,浓郁的果香气味深受消费者喜欢。鸭梨是我国主栽梨品种之一,但目前对鸭梨挥发性物质生成的调控机理研究较少。深入研究鸭梨果实的挥发性物质,尤其是探讨香味物质的生成规律,对阐明鸭梨风味品质的形成具有重要意义。【前人研究进展】果实的香气是由多种挥发性化合物组成的复杂混合物,其中包括酯类、醛类、萜类、醇类、羰基化合物及硫化物等。根据果实挥发性物质合成前体不同,其合成分为脂肪酸途径、氨基酸途径、萜类合成途径,其中脂肪酸代谢中的脂氧合酶(LOX)途径、-氧化途径是芳香化合物合成的主要方式,由此生成的己酯及乙酯类化合物促成了果实的果香味[1-2]。LOX是脂肪酸代谢途径中的关键酶,其他如乙醇脱氢酶(ADH)、氢过氧化物裂解酶(HPL)、醇酰基转移酶(AAT)等在果实香气物质形成过程中也发挥重要作用,这些酶的相关基因表达发生显著变化[3-10]。就梨果实而言,低温、乙烯、采收期和贮藏条件等均会影响挥发性物质的生成[8-15],其中低温会减少果实贮藏过程中香气物质的形成[8-10],在其他水果中也存在类似情况[16-17]。【本研究切入点】在我国,地下通风窖藏是一种传统的水果贮藏方式,不仅具有节能环保的优势,而且贮藏后果实香味浓郁,但果实容易衰老,不宜长期贮藏。相对来说,冷藏仍是当前商业贮藏的主要形式,但冷藏果实的香气物质明显减少[8-10]。鸭梨贮藏期间挥发性物质变化很大[18]。但目前为止,尚未见鸭梨在窖藏、冷藏过程中挥发性物质成分变化的报道。【拟解决的关键问题】本研究通过分析窖藏和冷藏期间,鸭梨品质、挥发性物质成分和电子鼻信号响应情况,检测香气物质形成相关基因的表达,进一步阐明这两种贮藏方式对鸭梨果实香气物质形成的影响及其调控机制。
1 材料与方法
1.1 试验材料
供试套袋(外灰内黑单层纸袋)鸭梨于2019年9月27日采于赵县基地果园,果实采后当天解袋,进行分拣,除去病虫害和残次果。选取大小一致的果实(平均单果重238 g),装入纸箱内,每箱40个果实。次日存放于当地冷库(库容量:175 t;(0±0.5)℃,空气湿度(79.47±4.16)%)和地下通风窖(库容量:150 t;温度从入库初期的20℃逐渐下降至12月的7℃,空气湿度(78.70±8.35)%)。在贮藏初期(入库当天)、1个月、2个月、3个月时,将贮藏的果实(每次每处理3箱)运回实验室,经室温(25℃±1℃)过夜后进行品质和生理指标检测,并对果皮和果肉分别进行取样,经液氮速冻后,于-80℃冻藏备用。
1.2 方法
1.2.1 硬度、可溶性固形物及可滴定酸含量测定 采用GY-4型果实硬度计(浙江托普仪器有限公司)测定果实赤道部位去皮硬度;榨取果汁,采用PAL-1型手持数字糖度计(日本爱拓公司生产)测定果实可溶性固形物含量(SSC)。采用酸碱滴定法测定可滴定酸(TA)含量,用苹果酸含量表示。每次重复3次,每重复5个果实。
1.2.2 呼吸速率和乙烯释放速率测定 将果实置于密闭容器中,密封30 min抽取气体10 mL,用HWF-1红外线分析器(江苏金坛市科析仪器有限公司)测定CO2浓度,换算为呼吸速率。果实密封3 h后,抽取气体1 mL,用GC9790Ⅱ气相色谱仪(浙江福立分析仪器有限公司)测定乙烯浓度,换算为乙烯释放速率。每次重复3次,每重复10个果实。
1.2.3 电子鼻检测 将果实置于密闭容器中,密封2 h时,使用PEN3便携型电子鼻(德国Airsense公司)进行测定[19](表1)。测定条件:气体流量400 mL·min-1,清洗时间60 s,调零时间5 s,准备时间5 s,测定时间100 s,选取97—99 s 3个点的响应值用于数据分析。每次重复3次,每重复10个果实。
1.2.4 挥发性物质含量测定 准确称取果皮和果肉粉末冻样,加入适量饱和氯化钠,磁力搅拌,40℃水浴中预热30 min后,经固相微萃取柱(PDMS/DVB,65 μm)吸附30 min,采用TQ-8040型气相色谱-质谱联用(GC-MS)(日本岛津公司)测定挥发性物质成分[20]。GC条件:SH-Rxi-5Sil MS毛细管柱(30 m×0.25 mm,0.25 μm);升温程序:40℃下保持1 min;2℃·min-1升温至100℃,保持2 min;5℃·min-1升温至250℃,保持5 min。进样口温度250℃,载气:高纯氦,柱流量1 mL·min-1。MS条件:电离方式为电子电离源,电子能量70 eV,接口温度250℃,离子源温度200℃,溶剂延迟时间3 min,m/z 35—500下进行质量扫描,测定时加入200 ng 2-辛酮作为内标物,通过匹配质谱数据库NIST17及保留指数对挥发性物质进行定性分析,计算各成分的含量,并进行差异显著性分析。重复3次。

表1 PEN3型电子鼻传感器阵列
1.2.5 RNA提取与定量分析 采用改良CTAB法[21]提取总RNA。总RNA经DNase清除DNA后,用反转录试剂盒Primescript TM RT reagent Kit(宝生物工程(大连)有限公司)进行反转录,按照定量PCR反应试剂盒TB GreenTMPremix Ex Taq II(宝生物工程(大连)有限公司)说明书进行定量分析。定量PCR仪为美国Applied BiosystemsTMABI 7500型。参照Genbank登记序列,使用Primer Premier 5.0软件设计引物。所有引物(表2)委托上海生物工程有限公司合成。以为内参基因[22],通过2-∆∆CT法计算待测基因相对表达量。
1.3 统计分析
采用Excel 2007软件对数据进行统计处理,利用SPSS 20.0软件Duncan多重比较法进行差异显著性分析,<0.05为差异显著;电子鼻信号采用系统自带的Winmuster软件进行主成分分析(PCA)和线性判别分析(LDA)。
2 结果
2.1 果实品质变化
窖藏条件下,鸭梨贮藏1个月时硬度有所增加,此后缓慢降低,至3个月时最小。窖藏时果实的SSC先明显增加,之后下降;冷藏果实后期具有较高的SSC,窖藏果实的SSC较低。冷藏时,TA含量逐渐下降,而窖藏保持较高的TA含量(表3)。

表2 定量PCR引物序列
2.2 呼吸速率和乙烯释放速率变化
两种贮藏方式下,鸭梨果实呼吸速率均表现为逐渐上升趋势,且同期窖藏果实显著高于冷藏果实;果实乙烯释放速率均呈现先上升后下降的趋势,其中果实窖藏1个月时达到高峰,且峰值明显高于同期冷藏果实,果实冷藏2个月时达到峰值;贮藏3个月时,二者的乙烯释放速率差异不显著(图1)。
2.3 电子鼻检测结果
PCA结果表明,电子鼻检测数据可降维成主成分1(PC1)和主成分2(PC2)。其中PC1贡献率97.75%,为影响各样品的主要因素。根据图形分布将坐标图分为两个区域,其中贮藏初期、冷藏鸭梨处于PC1值较小的区域。贮藏初期鸭梨气味对应的PC1特征值最小,冷藏鸭梨试样呈相互交叉分布,位于贮藏初期和窖藏1月之间,与贮藏初期位置更相近。窖藏鸭梨在PC1上变化范围大,相对应PC1值由小到大排列分别是:窖藏1月、窖藏3月、窖藏2月(图2)。表明冷藏期间鸭梨气味较初始时变化较小,挥发性成分性质相近;窖藏鸭梨挥发性物质成分变化大,其含量较高,并以贮藏2月时最高。
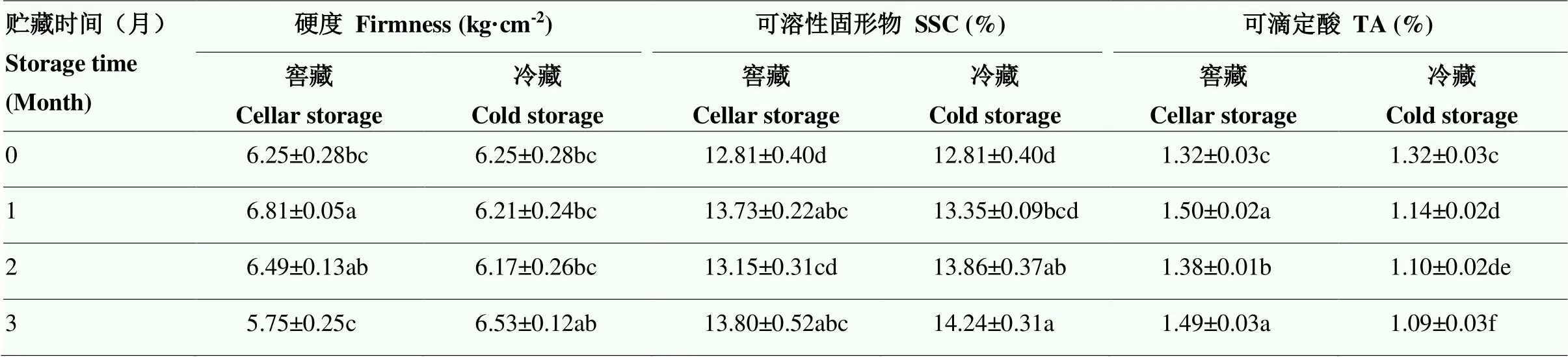
表3 鸭梨窖藏、冷藏期硬度、可溶性固形物和可滴定酸含量变化
不同小写字母表示差异显著(<0.05)。下同
Different lowercase letters indicate significant difference (<0.05). The same as below
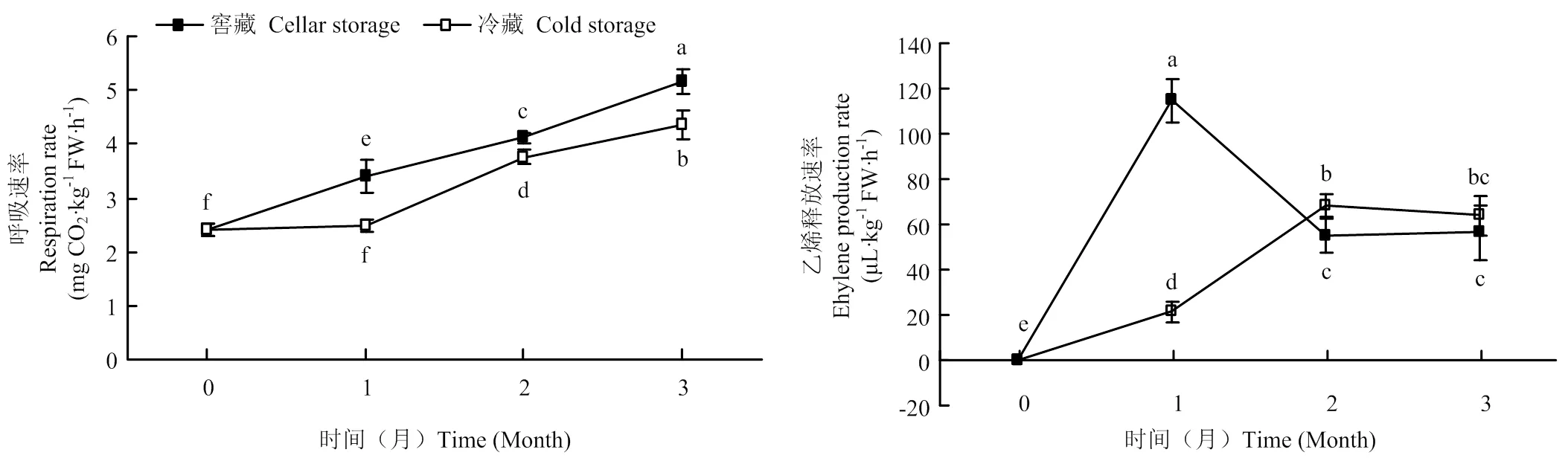
不同小写字母表示差异显著(P<0.05)。下同
进一步采用线性判别分析(LDA)表明,不同贮藏时期鸭梨样品均能集中独立分布且不存在相互交叉现象,并且窖藏2个月时的距离最远,说明此时分离程度最大(图3),这表明电子鼻可有效区分窖藏、冷藏鸭梨的挥发性物质,反映出贮藏方式显著影响果实的挥发性物质含量。
电子鼻传感器响应雷达图分析表明,由雷达图中心向外扩展始于贮藏初期,之后冷藏1个月、2个月、3个月时,交叉叠加分布,然后窖藏1个月、3个月、2个月,逐步外延。就传感器的变化而言,W1W(代表硫化物、萜烯类)、W5S(代表氮氧化合物)、W2W(代表有机硫化物、芳香成分)、W1S(代表甲烷)变化程度较大。因此,这4种传感器对挥发性物质的区分起主要作用(图4)。
2.4 挥发性物质组分变化
GC-MS分析表明,鸭梨中挥发性物质主要为醛类、酯类、醇类、烷烃类、萜类化合物等。将两种贮藏方式同期果皮、果肉中挥发性物质进行比较表明,果肉中挥发性成分种类及同类别物质含量均少于同期果皮。贮藏期鸭梨酯类含量增加,香气物质增多。果皮、果肉酯类物质含量依次为:窖藏下果皮(8.696—16.336 mg·kg-1)>窖藏下果肉(1.188—6.149 mg·kg-1)>冷藏下果皮(0.148—0.308 mg·kg-1)>冷藏下果肉(0.015—0.039 mg·kg-1)(表4、表5)。

冷藏-1、冷藏-2、冷藏-3分别为冷藏1个月、2个月、3个月;窖藏-1、窖藏-2、窖藏-3分别为窖藏1个月、2个月、3个月。0为贮藏初期。下同

图3 基于电子鼻窖藏及冷藏鸭梨挥发性成分LDA分析
就鸭梨果皮而言,贮藏期内,鸭梨果皮中挥发性物质总量呈现先升高后降低的规律,且窖藏果皮明显高于同期冷藏果皮,其中差别比较明显的香气物质为酯类、醇类化合物,其含量高峰出现在贮藏2个月,分别高于冷藏果实53.11、56.22倍。具体成分表现为,窖藏鸭梨果皮中检出36种成分,含量较高的物质为酯类、醛类、醇类、萜类,其中酯类为主要香气物质。酯类主要是乙酯和甲酯类,其中己酸乙酯、辛酸乙酯、丁酸乙酯、乙酸己酯、乙酸辛酯为主要成分,并且2-己烯酸乙酯、庚酸乙酯和(E, Z)-2,4-癸二烯酸乙酯等为窖藏过程中特有的酯类物质;醛类主要为E-2-己烯醛,以及新生成的(E, Z)-2,4-癸二烯醛;醇类主要为Z-4-癸烯醇、正辛醇和正癸醇;萜类主要是-法尼烯和6-甲基-5-庚烯-2-酮(MHO)。冷藏鸭梨果皮中检出28种挥发性物质成分,含量较高的物质为醛类、烷烃、萜类等,其中醛类主要为己醛、反-2-己烯醛;酯类物质(主要是丁酯类)相对较少,而此时出现较多的烷烃类物质,且主要是癸烷,而窖藏却未检出烷烃类物质(表4)。
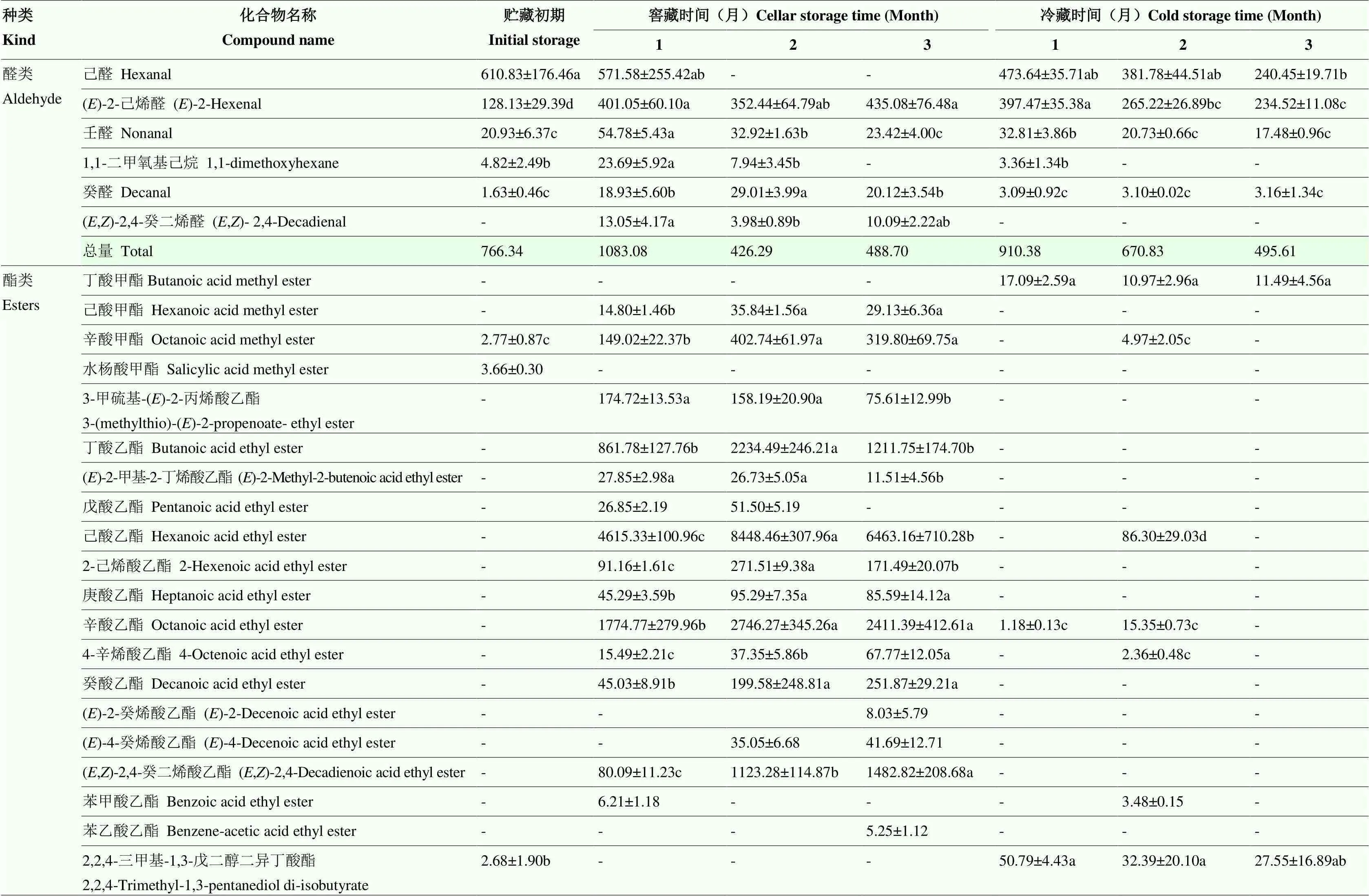
表4 窖藏、冷藏鸭梨果皮中挥发性成分变化

续表4 Continued table 4
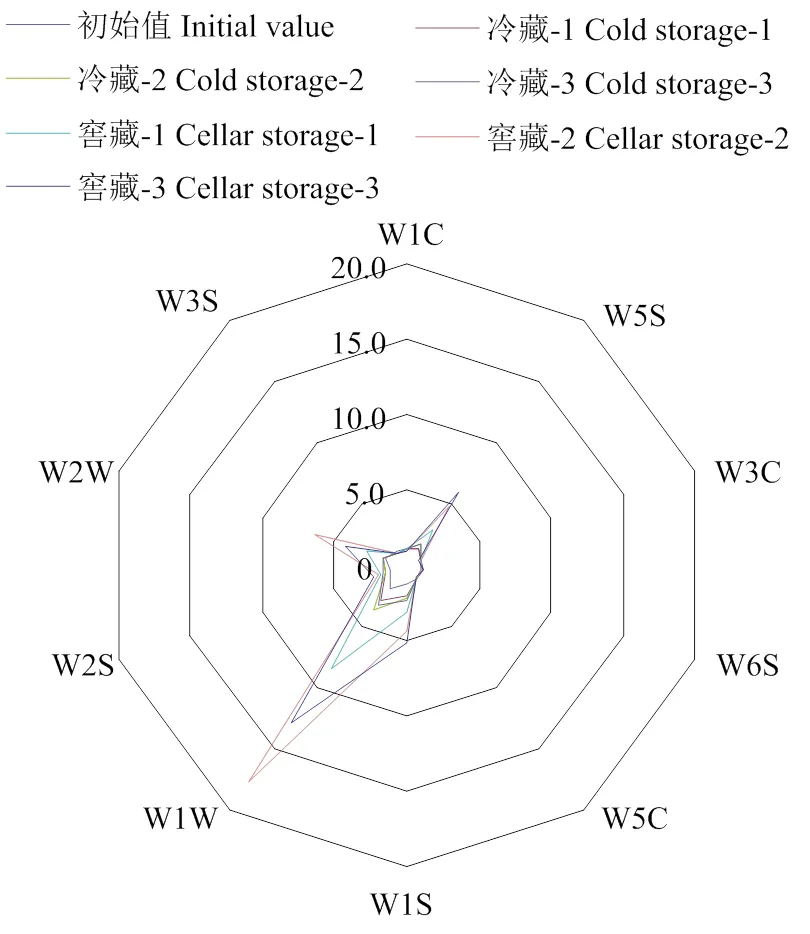
图4 窖藏及冷藏鸭梨电子鼻传感器响应雷达图
就鸭梨果肉来说,窖藏时果肉中的挥发性物质总量明显高于冷藏果肉,尤其是萜类、酯类、醇类物质的差别更为显著,其总量高峰均出现在贮藏2个月时,分别是冷藏果肉的16.10、78.43、158.60倍。窖藏鸭梨果肉中检出33种挥发性物质成分,主要为酯类和萜类,未检出烷烃类物质,酯类主要为己酸乙酯、丁酸乙酯,萜类以-法尼烯为主。冷藏鸭梨果肉中检出24种挥发性物质成分,主要为烷烃类和醛类。烷烃类以癸烷为主,醛类以己醛为主(表5)。
进一步相关分析表明,鸭梨果皮、果肉中醇类物质与酯类物质总量之间呈极显著正相关(=0.9902、0.9599),说明酯类物质的生成与醇类物质向酯类的转化有密切关系。
2.5 乙烯合成及其信号转导相关基因的表达
贮藏时,鸭梨果皮和果肉、、表达量明显上调,其中果肉的上调幅度显著大于果皮,并以窖藏果肉表现更为明显。在贮藏后期,窖藏果皮、、表达量低于冷藏果皮。此外,、表达量上调后下降,相对来说,冷藏果肉具有较高的表达量;表达量相对较小,窖藏果皮与果肉的表达量低于冷藏果实。在果皮中的表达量高于果肉,果皮和果肉的变化趋势不同,并且窖藏的果肉表达量明显低于冷藏果肉(图5)。

图5 窖藏和冷藏下鸭梨乙烯生成及其信号转导、香气物质合成相关基因表达热图

表5 窖藏、冷藏鸭梨果肉中挥发性成分变化
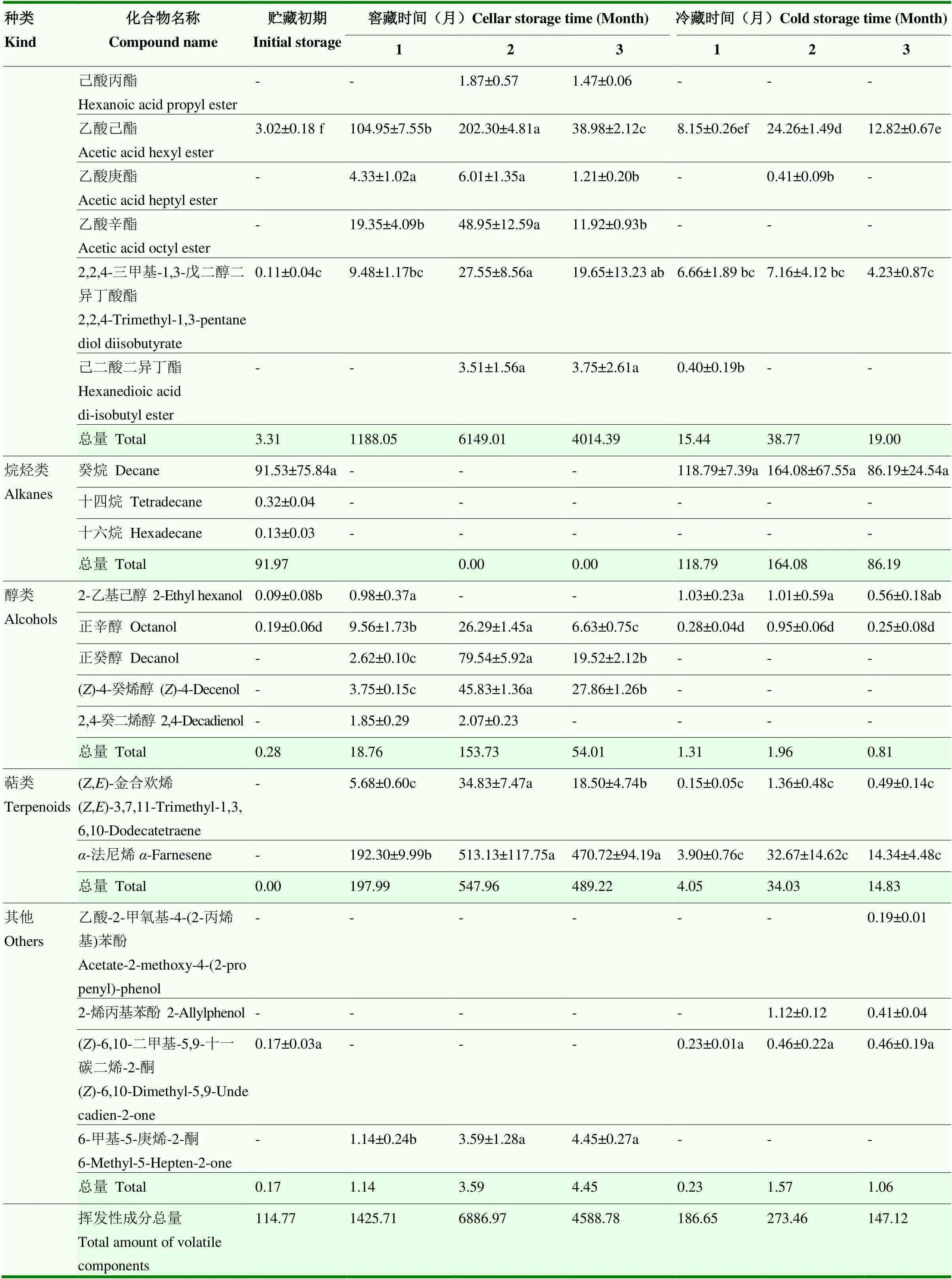
续表5 Continued table 5
2.6 香气物质合成相关基因的表达
贮藏初期,果皮中表达量高于果肉。随着贮藏时间延长,果皮中表达量呈下降趋势。同时,窖藏果肉的表达迅速提高,明显高于冷藏果肉。、表达量呈下降趋势。与冷藏相比,窖藏果实的表达量下调更为迅速。表达量在贮藏期呈升高趋势,并且以冷藏果肉的基因表达上调较为明显。
贮藏过程中,表达量以窖藏果肉上调表现明显。表达量与之不同,贮藏初期,窖藏果肉的表达量高于冷藏果肉;而贮藏后期,窖藏果皮的表达量高于冷藏的果皮。相对来说,鸭梨表达量变化较小。与冷藏相比,窖藏果皮的差别较小,但果肉的表达量低于果皮(图5)。
2.7 基因表达量之间的相关性分析
根据果实挥发性香气物质测定结果,、表达量与香气变化模式呈相似变化规律。因此,其表达可能是影响香气物质合成的主要原因。相关性分析表明(表6),与表达量呈显著正相关的基因有和,与表达量呈显著负相关的基因有、、和;与表达量呈显著正相关的基因有、、和;与的表达量呈显著负相关的基因有、和。因此,上述这些基因的表达在不同程度上影响香气的合成。
3 讨论
本研究表明,与冷藏相比,窖藏鸭梨果实的SSC变化较小,TA含量有所增加,但贮藏3个月时硬度明显下降,反映出窖藏鸭梨后熟衰老进程快于冷藏。因此,窖藏时间不宜太长。
研究表明,低温抑制梨果实香气物质的生成与积累[4,8-10,13,17]。本研究证明,窖藏温度始终高于冷藏。电子鼻分析结果表明,窖藏2个月时果实挥发性物质较多,其信号明显区别于其他时间,与GC-MS测得的挥发性物质总量变化相一致。窖藏鸭梨果实的挥发性物质种类和含量较多,其含量高峰出现在贮藏2个月时,尤其是代表性香气物质—酯类化合物的表现更为明显(表4、表5),其中主要酯类物质有己酸乙酯、辛酸乙酯、丁酸乙酯、(E,Z)2,4-癸二烯酸乙酯,这些是鸭梨果实的特征性香气成分,与前人的报道相近[18]。相对来说,冷藏鸭梨酯类香气物质较少,这是窖藏果实果香味浓郁的物质基础。
果实香气物质的形成与乙烯生成及作用有密切关系[2-3,5-6,16]。如‘苹香’梨酯类物质合成途径中的、、及与乙烯合成途径中的、、表达密切相关[3]。冷藏抑制‘南果’梨乙烯生物合成和信号转导能力,降低LOX、HPL、AAT活性及其基因表达,减少香气物质生成[10]。本研究发现,窖藏鸭梨乙烯释放高峰早于冷藏果实,且峰值高于冷藏果实(图1),此时期果实乙烯的大量生成,与表达量上调(图5)有关;同时,窖藏还刺激乙烯受体表达上调,但下调、的表达。这说明,窖藏和冷藏影响果实乙烯生成与信号转导过程。果实挥发性物质生成与、、等基因的表达有关[2]。本研究结果表明,乙酯是鸭梨窖藏过程中生成较多的酯类,并且鸭梨挥发性物质变化模式与、的基因表达规律类似(图5)。基于鸭梨的酯类总量与醇类物质总量呈显著正相关关系,由此推测,鸭梨果实的香气生成与脂肪酸代谢途径密切相关,经过脂肪酸酰基-CoA的作用,转化为短链酰基-CoAs,继而与醇在AAT催化作用下生成乙酯类等短链酯类[1,23]。因此,、可能是影响鸭梨果实香气形成的关键基因。进一步通过相关分析表明,表达量与的表达量呈极显著正相关,而、表达量与呈显著负相关,说明香气物质的产生与乙烯生成和信号转导具有密切关系。同时,、、、、表达量之间呈显著或极显著关系,这说明乙烯和挥发性物质生成相关基因的表达之间具有相关性,并一起关系到果实挥发性物质的生成。这些结果进一步证明,温度和乙烯在调控果实香气生成中发挥重要作用,乙烯具有正调控功能[24-27]。
此外,窖藏鸭梨果皮比冷藏时含有较高的-法尼烯和6-甲基-5-庚烯-2-酮(MHO)含量(表4)。尽管这两种物质参与了苹果和梨果皮的虎皮病发生[28-30],而本研究尚未发现虎皮病现象,但至少说明,窖藏条件刺激了-法尼烯和MHO的生成与积累。这种现象可能与窖藏时果皮衰老较快有关。

表6 窖藏和冷藏下鸭梨乙烯生成及其信号转导、香气物质合成相关基因表达量之间相关性分析
0.05=0.514,0.01= 0.641
4 结论
冷藏能更好地维持鸭梨果实硬度,保持较高的SSC,适合长期贮藏,以保持果实口感,但挥发性物质较少。相对冷藏而言,窖藏过程中,鸭梨容易软化,但生成更多酯类、醇类等香气物质,拥有较多的香气成分,香味浓郁。相关基因表达分析表明,鸭梨果实香气物质的生成与、、的表达呈正相关关系,而与呈负相关关系。
[1] EL HADI M A M, ZHANG F J, WU F F, ZHOU C H, TAO J. Advances in fruit aroma volatile research. Molecules, 2013, 18(7): 8200-8229.
[2] HEINZ D E, JENNINGS W G. Volatile components of Bartlett pear. Journal of Food Science, 2010, 31(1): 69-80.
[3] LI G P, JIA H J, LI J H, WANG Q, ZHANG M J, TENG Y W. Emission of volatile esters and transcription of ethylene- and aroma-related genes during ripening of ‘Pingxiangli’ pear fruit (Maxim). Scientia Horticulturae, 2014, 170: 17-23.
[4] ZHOU X, DONG L, LI R, ZHOU Q, WANG J W, JI S J. Low temperature conditioning prevents loss of aroma-related esters from ‘Nanguo’ pears during ripening at room temperature. Postharvest Biology and Technology, 2015, 100: 23-32.
[5] ZHOU X, DONG L, ZHOU Q, WANG J W, CHANG N, LIU Z Y, JI S J. Effects of intermittent warming on aroma-related esters of 1-methylcyclopropene-treated ‘Nanguo’ pears during ripening at room temperature. Scientia Horticulturae, 2015, 185: 82-89.
[6] LI G P, JIA H J, LI J H, LI H X, TENG Y W. Effects of 1-MCP on volatile production and transcription of ester biosynthesis related genes under cold storage in ‘Ruanerli’ pear fruit (Maxim.). Postharvest Biology and Technology, 2016, 111: 168-174.
[7] WEI S W, TAO S T, QIN G H, WANG S M, TAO J H, WU J, ZHANG S L. Transcriptome profiling reveals the candidate genes associated with aroma metabolites and emission of pear (cv. ‘Nanguoli’). Scientia Horticulturae, 2016, 206: 33-42.
[8] SHI F, ZHOU X, ZHOU Q, TAN Z, YAO M M, WEI B D, JI S J. Membrane lipid metabolism changes and aroma ester loss in low-temperature stored Nanguo pears. Food Chemistry, 2018, 245: 446-453.
[9] SHI F, ZHOU X, ZHOU Q, TAN Z, YAO M M, WEI B D, JI S J. Transcriptome analyses provide new possible mechanisms of aroma ester weakening of ‘Nanguo’ pear after cold storage. Scientia Horticulturae, 2018, 237: 247-256.
[10] SHI F, ZHOU X, YAO M M, ZHOU Q, JI S J, WANG Y. Low-temperature stress-induced aroma loss by regulating fatty acid metabolism pathway in ‘Nanguo’ pear. Food Chemistry, 2019, 297: 124927.
[11] CHERVIN C, SPEIRS J, LOVEYS B, PATTERSON B D. Influence of low oxygen storage on aroma compounds of whole pears and crushed pear flesh. Postharvest Biology and Technology, 2000, 19(3): 279-285.
[12] LARA I, MIRÓ R M, FUENTES T, SAYEZ G, LÓPEZ M L. Biosynthesis of volatile aroma compounds in pear fruit stored under long-term controlled-atmosphere conditions. Postharvest Biology and Technology, 2003, 29(1): 29-39.
[13] YAO M M, ZHOU X, ZHOU Q, SHI F, WEI B D, CHENG S C, TAN Z, JI S J. Low temperature conditioning alleviates loss of aroma- related esters of ‘Nanguo’ pears by regulation of ethylene signal transduction. Food Chemistry, 2018, 264: 263-269.
[14] ZLATI E, ZADNIK V, FELLMAN J, DEMŠAR L, HRIBAR J, CEJI Ž, VIDRIH R. Comparative analysis of aroma compounds in ‘Bartlett’ pear in relation to harvest date, storage conditions, and shelf-life. Postharvest Biology and Technology, 2016, 117: 71-80.
[15] SUN H J, LUO M L, ZHOU X, ZHOU Q, SUN Y Y, GE W Y, WEI B D, CHENG S C, JI S J. Exogenous glycine betaine treatment alleviates low temperature-induced pericarp browning of ‘Nanguo’ pears by regulating antioxidant enzymes and proline metabolism. Food Chemistry, 2020, 306: 125626.
[16] ZHANG B, YIN X R, LI X, YANG S L, FERGUSON I B, CHEN K S. Lipoxygenase gene expression in ripening kiwifruit in relation to ethylene and aroma production. Journal of Agricultural and Food Chemistry, 2009, 57(7): 2875-2881.
[17] ZHANG B, XI W P, WEI W W, SHEN J Y, FERGUSON I, CHEN, K S. Changes in aroma-related volatiles and gene expression during low temperature storage and subsequent shelf life of peach fruit. Postharvest Biology and Technology, 2011, 60(1): 7-16.
[18] CHEN J L , YAN S, FENG Z, XIAO L, HU X S. Changes in the volatile compounds and chemical and physical properties of ‘Yali’ pear (Reld) during storage. Food Chemistry, 2006, 97: 248-255.
[19] INFANTE R, FARCUH M, MENESES C. Monitoring the sensorial quality and aroma through an electronic nose in peaches during cold storage. Journal of the Science of Food and Agriculture, 2010, 88(12): 2073-2078.
[20] CHEN Y Y, YIN H, WU X, SHI X J, QI K J, ZHANG S L. Comparative analysis of the volatile organic compounds in mature fruits of 12 Occidental pear (L.) cultivars. Scientia Horticulturae, 2018, 240: 239-248.
[21] GASIC K, HERNANDEZ A, KORBAN S S. RNA extraction from different apple tissues rich in polyphenols and polysaccharides for cDNA library construction. Plant Molecular Biology Reporter, 2004, 22(4): 437-438.
[22] CHENG Y D, LIU L Q, ZHAO G Q, SHEN C G, YAN H B, GUAN J F, YANG K. The effects of modified atmosphere packaging on core browning and the expression patterns ofandgenes in ‘Yali’ pears during cold storage. LWT-Food Science and Technology, 2015, 60(2): 1243-1248.
[23] DEFILIPPI B G, KADER A A, DANDEKAR A M. Apple aroma: Alcohol acyltransferase, a rate limiting step for ester biosynthesis, is regulated by ethylene. Plant Science, 2005, 168: 1199-1210.
[24] YANG X T, SONG J, DU L N, FORNEY C, CAMPBELL-PALMER L, FILLMORE S, WISMER P, ZHANG Z Q. Ethylene and 1-MCP regulate major volatile biosynthetic pathways in apple fruit. Food Chemistry, 2016, 194: 325-336.
[25] DEFILIPPI B G, DANDEKAR A M, KADER A A. Relationship of ethylene biosynthesis to volatile production, related enzymes, and precursor availability in apple peel and flesh tissues. Journal of Agricultural and Food Chemistry, 2005, 53(8): 3133-3141.
[26] GÜNTHER C S, MARSH K B, WINZ R A, HARKER R F, WOHLERS M W, WHITE A, GODDARD M R. The impact of cold storage and ethylene on volatile ester production and aroma perception in ‘Hort16A’ kiwifruit. Food Chemistry, 2015, 169: 5-12.
[27] AUBERT C, BONY P, CHALOT G, LANDRY P, LUROL S. Effects of storage temperature, storage duration, and subsequent ripening on the physicochemical characteristics, volatile compounds, and phytochemicals of Western Red nectarine (L. Batsch). Journal of Agricultural and Food Chemistry, 2014, 62: 4707-4724.
[28] HUI W, NIU J P, XU X Y, GUAN J F. Evidence supporting the involvement of MHO in the formation of superficial scald in ‘Dangshansuli’ pears. Postharvest Biology and Technology, 2016, 121: 43-50.
[29] 惠伟, 牛瑞雪, 宋要强, 李德英. 1-MCP和DPA对砀山酥梨黑皮病的抑制效果. 中国农业科学, 2010, 43(6): 1212-1219.
HUI W, NIU R X, SONG Y Q, LI D Y. Inhibitory effects of 1-MCP and DPA on superficial scald of ‘Dangshansuli’ pear. Scientia Agricultura Sinica, 2010, 43(6): 1212-1219. (in Chinese)
[30] FARNETI B, BUSATTO N, KHOMENKO I, CAPPELLIN L, GUTIERREZ S, SPINELLI F, VELASCO R, BIASIOLI F, COSTA G, COSTA F. Untargeted metabolomics investigation of volatile compounds involved in the development of apple superficial scald by PTR-ToF-MS. Metabolomics, 2015, 11(2): 341-349.
Comparison Analysis on Volatile Compound and Related Gene Expression in Yali Pear During Cellar and Cold Storage Condition
YUE YingXiao1, 2, HE JinGang2, ZHAO JiangLi2, YAN ZiRu2, CHENG YuDou2, WU XiaoQi2, WANG YongXia1, GUAN JunFeng
1College of Life Science and Food Engineering, Hebei University of Engineering, Handan 056038, Hebei;2Institute of Biotechnology and Food Science, Hebei Academy of Agriculture and Forestry Sciences/Hebei Plant Genetic Engineering Center, Shijiazhuang 050051
【】The aim of this study was to compare the differences of fruit quality, respiration rate, ethylene production rate, electronic nose characteristics, volatile compounds and related gene expression in Yali pear between cold and cellar storage, and to further analyze the effects of two storage methods on the formation of aroma substances and its mechanism. 【】Postharvest Yali pear was stored in cold and cellar condition, and the fruit firmness, soluble solids content (SSC), titratable acid (TA) content, respiration rate and ethylene production rate were measured. The changes of volatile compounds during storage were measured by electronic nose, and the components and contents of volatile substances were determined by GC-MS. The expression of genes related to ethylene biosynthesis (and), signal transduction (,,,,and) and volatile compound synthesis (,,,,,and) was analyzed by real-time PCR. 【】During cold storage of Yali pear fruit, the firmness had no obvious variation, and the SSC increased, while the TA content decreased. During cellar storage, there was a remarkable decrement in firmness and increment in TA content, but there was no obvious variation in SSC. Compared with cold storage, the respiration rate was higher and the peak of ethylene production rate appeared one month earlier under cellar storage. The results showed that the electronic nose could effectively distinguish the volatile compounds of Yali pear in different storage methods. Four sensors, including W1W, W5S, W2W and W1S, played the critical role in the identification of volatile compounds, and there were more volatile substances in cellar storage. The volatile compounds, such as aldehydes, esters, alcohols, terpenes, alkanes, etc, were found in the peel and flesh of Yali pear, and which contents were higher in peel than that in flesh. 36, 33 and 28, 24 kinds of volatile compounds were detected in peel and flesh of fruit under celler, cold storage, respectively. There were more ester compounds in cellar storage than those in cold one, among which, ethyl caproate, ethyl octanoate, ethyl butyrate, (E, Z) 2,4-decadiene ester were the main aroma substances in the peel, ethyl caproate and ethyl butyrate were the main aroma substances in flesh. The analysis on expression of genes related to ethylene and aroma compound synthesis showed that the expression of ACC oxidase (), lipoxygenase () and alcohol acyltransferase () genes were significantly increased, and the expression of ethylene insensitive transcriptional regulator gene () was down regulated in cellar storage in contrast to cold storage. 【】Compared with cold storage, cellar storage condition promoted ethylene production and the expression of genes related to ethylene biosynthesis () and aroma compound synthesis (and), thus, made more kinds and contents of aroma substances, and exhibited more rich aroma in Yali pear.
Yali pear; quality; volatile compound; electronic nose; ethylene; gene expression

10.3864/j.issn.0578-1752.2021.21.013
2021-01-11;
2021-04-30
财政部和农业农村部:国家现代农业产业技术体系(CARS-28-23)、河北省农林科学院创新工程(2019-2-1)
岳盈肖,E-mail:yyingxiao@163.com。何近刚,E-mail:hejingang2000@163.com。岳盈肖和何近刚为同等贡献作者。通信作者王永霞,E-mail:wyxhd2004@126.com。通信作者关军锋,E-mail:junfeng-guan@263.net
(责任编辑 赵伶俐)

