鸡球虫多价多表位亚单位疫苗免疫原性分析及抗球虫感染的效果观察
陈思颖,黄剑梅,张杨,陈玉凤,丁文傒,刘佳斌,徐立新,严若峰,宋小凯,李祥瑞
(南京农业大学动物医学院动物健康与食品安全MOE联合国际研究实验室,江苏 南京 210095)
鸡球虫病是一种严重危害养禽业的原虫病。它可以导致鸡采食量减少、营养不良、饲料转换率下降甚至死亡[1]。目前,公认的鸡球虫有7种,分别为柔嫩艾美耳球虫(Eimeriatenella)、堆型艾美耳球虫(E.acervulina)、毒害艾美耳球虫(E.necatrix)、巨型艾美耳球虫(E.maxima)、和缓艾美耳球虫(E.mitis)、早熟艾美耳球虫(E.praecox)和布氏艾美耳球虫(E.brunetti)[2],前4种球虫临床上危害最为严重。
目前药物是控制球虫病的主要手段。然而抗球虫药物的使用存在诸多问题:球虫存在日益严重的耐药性,抗球虫药物残留易导致食品安全问题,新药研发昂贵,政府对于药物使用的限制等,这些问题迫使研究者探索新的球虫预防策略[3]。而传统球虫疫苗又存在强毒株易散毒、弱毒株易返强的风险[4],于是越来越多的学者将目光投向新型球虫疫苗。亚单位疫苗是一种通过原核、真核或植物表达系统获得重组抗原蛋白来免疫动物而诱导特异性免疫反应的疫苗,具有安全、成本较低、易规模化制备的优势[5]。
表面抗原在球虫入侵的过程中发挥重要作用。毒害艾美耳球虫子孢子表面抗原(NA4)是Karel等[6]从毒害艾美耳球虫中纯化得到的子孢子表面蛋白,该蛋白能够有效刺激机体产生免疫保护性,对毒害艾美耳球虫和柔嫩艾美耳球虫的感染起到交叉保护作用。柔嫩艾美耳球虫子孢子表面抗原(TA4)分布于柔嫩艾美耳球虫子孢子表面,在球虫入侵过程中起重要作用,TA4基因目前被视为鸡球虫DNA疫苗研发中最有效的候选抗原之一[7]。乳酸脱氢酶(LDH)在毒害艾美耳球虫和巨型艾美耳球虫上都有表达,其与鸡肠道上皮细胞构成的上皮细胞-球虫抗原复合物可能是引起免疫效应的靶点,且LDH蛋白在球虫的不同发育阶段(卵囊、子孢子、裂殖体和裂殖子)有不同程度的表达,这样能有效提高其对球虫感染的保护性,因此LDH是很有潜力的疫苗抗原[8]。从巨型艾美耳球虫中克隆的钙调节蛋白激酶(EmCDPK)、柔嫩艾美耳球虫的EtCDPK在球虫卵囊孢子化最后阶段表达量增加,在子孢子侵入宿主细胞的过程中,在宿主细胞膜上检测到EtCDPK,提示EtCDPK在子孢子入侵宿主细胞时起关键性的作用[9]。
本实验室前期已构建多价多表位DNA疫苗pVAX1-NA4-1-TA4-1-LDH-2-EMCDPK-1和串联细胞因子IL-2作为佐剂的pVAX1-NA4-1-TA4-1-LDH-2-EMCDPK-1-IL-2,试验证明这2个疫苗针对柔嫩、毒害、巨型和堆型4种艾美耳球虫感染均能起到免疫保护效力[10]。本试验在DNA疫苗基础上构建相应的原核表达载体,表达并纯化重组蛋白rN1T1L2E1和rN1T1L2E1I2,分析这2个重组蛋白的免疫原性并观察其抵抗多种球虫感染的免疫保护效果,为鸡球虫病疫苗的研制及应用提供参考。
1 材料与方法
1.1 材料
1日龄海兰白雏鸡,购自江苏省南通市某养鸡场,饲养于提前消毒的无球虫环境中。饲喂清洁的不含任何抗球虫药的水和饲料。柔嫩、毒害、巨型和堆型4个艾美耳球虫江苏分离株均由南京农业大学兽医寄生虫分子免疫学实验室分离并保存,动物试验开始前复苏,以保证卵囊活性。重组蛋白rN1T1L2E1和rN1T1L2E1I2由本实验室制备并保存。
1.2 试剂
氨苄青霉素、卡那霉素、尿素及咪唑购于生工生物工程(上海)股份有限公司;鼠抗鸡CD4、鼠抗鸡CD3和鼠抗鸡CD8购自美国Southern Biotech公司。鸡血清IFN-γ、IL-4、IL-17和TGF-β细胞因子试剂盒购自上海酶联生物公司。His标签蛋白纯化柱(His TrapTMFF crude)购自美国GE Healthcare公司。其他试剂均为国产分析纯。
1.3 引物设计和表达载体构建
参考GenBank的毒害艾美耳球虫TA4基因(GenBank ID:M21004)、堆型艾美耳球虫LDH基因(GenBank ID:FJ617009)、毒害艾美耳球虫NA4基因(GenBank ID:EU523548)、巨型艾美耳球虫EMCDPK基因(GenBank ID:Z71756)序列,使用Primer Premier 5.0设计特异性引物。将保存质粒作为模板进行PCR扩增,分别扩增出目的基因NA4-1-TA4-1-LDH-2-EMCDPK-1(1 296 bp)和目的基因NA4-1-TA4-1-LDH-2-EMCDPK-1-IL2(1 740 bp),引物序列见表1。

表1 PCR引物序列Table 1 Primer sequence for PCR
将经胶回收纯化的基因片段与pET-32a(+)载体分别用BamHⅠ和SalⅠ酶切后用Ligation Mix连接,将其转化EscherichiacoliBL21感受态细胞中,涂布带有氨苄青霉素抗性的琼脂平板。待平板长出单菌落后,挑取单菌落继续培养16 h,使用OMEGA质粒提取试剂盒(mini kit)按照说明书提取菌液质粒后,依次进行PCR后用BamHⅠ和SalⅠ双酶切对重组质粒鉴定。鉴定出的阳性样品送安徽通用生物公司测序。
1.4 重组蛋白的原核表达及纯化
将10 mL阳性菌转接至1 L含氨苄青霉素的LB溶液中,37 ℃条件下待菌液生长至对数生长期后加入 IPTG诱导3 h,高速离心(8 000 r·min-1,15 min)得到菌体沉淀,将菌体用上样缓冲液重悬。在-80 ℃反复冻融3次后用超声破碎细胞壁。8 000 r·min-1离心15 min,弃上清液,沉淀用包涵体上样缓冲液重悬,4 ℃静置过夜。取包涵体上样缓冲液使用His标签蛋白纯化镍柱HisTrap HP纯化重组蛋白,纯化后的蛋白保存在-80 ℃备用。用同样方法制备pET-32a标签蛋白。
1.5 重组蛋白的免疫原性分析
1.5.1 重组蛋白的Western blot分析将纯化后的重组蛋白与标签蛋白进行SDS-PAGE后,用半干的方式将蛋白转印PVDF膜。加5%脱脂奶37 ℃封闭2 h,PBS清洗后,加一抗后分别孵育感染柔嫩、毒害、巨型和堆型艾美耳球虫的鸡血清(1∶50稀释)。4 ℃过夜后,用PBS清洗。加二抗辣根过氧化物酶标记的兔抗鸡IgG抗体,37 ℃孵育1 h后,用PBS清洗。最后用ECL化学发光液显色,观察记录结果。
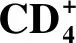
1.5.3 重组蛋白免疫后血清细胞因子和特异性IgG抗体水平变化分别在首免前、首免当天和二免后第7天取1.5.2节中各组雏鸡各3只,通过心脏采血分离血清。应用双抗体夹心法检测血清中IFN-γ、IL-4、IL-17和TGF-β水平[11]。IgG抗体检测按照本实验室前期建立的间接ELISA法进行[12]。
1.6 重组蛋白的抗球虫免疫保护效果评估
选取2周龄健康且体重接近的雏鸡,随机分为17组,每组20只鸡。免疫组每只雏鸡在腿部注射 0.4 mL(200 μg)重组蛋白,PBS对照组和pET-32a对照组分别注射0.4 mL的PBS溶液和pET-32a(200 μg)蛋白;3周龄时同样方式加强免疫;4周龄时每组经口感染相应的新鲜孢子化卵囊:柔嫩和毒害艾美耳球虫均每羽5×104,堆型和巨型艾美耳球虫均每羽1×105。5周龄时对所有鸡称重并剖杀,进行肠道病变计分(0~40)[13]。按公式(1)计算病变值;按公式(2)计算各组卵囊减少率(%)[14];按公式(3)计算各组的抗球虫指数(anticoccidiosis index,ACI),分析各组的抗球虫能力。
病变值=各试验组的平均病变记分(0~4)×10
(1)

(2)
ACI=(存活率+相对增重率)-(病变值+卵囊值)
(3)
1.7 试验数据的统计分析
采用 SPSS 21.0 软件的ANOVA单因素方差分析方法对试验数据进行方差分析和差异显著性检验。
2 结果与分析
2.1 重组原核表达载体的构建
重组质粒pVAX1-NA4-1-TA4-1-LDH-2-EMCDPK-1经BamHⅠ和SalⅠ双酶切后进行电泳。如图1-A所示:小片段为1 296 bp,与预期一致。重组质粒pVAX1-NA4-1-TA4-1-LDH-2-EMCDPK-1-IL2经BamHⅠ和SalⅠ双酶切后进行电泳。如图1-B所示:小片段为 1 740 bp,与预期一致。

图1 重组质粒pVAX1-NA4-1-TA4-1-LDH-2-EMCDPK-1(A)和pVAX1-NA4-1-TA4-1-LDH-2-EMCDPK-1-IL-2(B)的双酶切鉴定Fig.1 Identification of recombinant plasmid pVAX1-NA4-1- TA4-1-LDH-2-EMCDPK-1(A)and pVAX1-NA4-1-TA4- 1-LDH-2-EMCDPK-1-IL-2(B)M. DNA标准品DL5000 DNA standard DL5000;1. 重组质粒的双酶切产物Recombinant plasmid by double enzyme digestion.
2.2 rN1T1L2E1和rN1T1L2E1I2重组蛋白的纯化
将包涵体裂解液和上清液上样缓冲液分别制样后进行SDS-PAGE,重组蛋白rN1T1L2E1和rN1T1L2E1I2完全表达在包涵体中(图2-A、B)。使用His标签蛋白纯化镍柱HisTrap HP纯化重组蛋白,经SDS-PAGE检测,纯化效果良好(图2-C、D)。

图2 重组蛋白 rN1T1L2E1和rN1T1L2E1I2 的表达(A,B)与纯化(C,D)Fig.2 Expression(A,B)and purification(C,D)of recombinant protein rN1T1L2E1 and rN1T1L2E1I2M. 蛋白质标准品 Protein standard marker;1. 全菌体蛋白Whole cell protein;2. 诱导菌超声裂解后上清液Supernatant after ultrasonic lysis;3. 诱导菌超声裂解后包涵体Inclusion body after ultrasonic lysis;4. 纯化前的蛋白Protein before purification;5. 纯化后的蛋白 Protein after purification.
2.3 重组蛋白的Western blot分析
纯化后的重组蛋白经SDS-PAGE后转移至PVDF膜上然后进行Western blot分析。结果(图3)显示:rN1T1L2E1可分别被感染柔嫩、毒害、巨型和堆型艾美耳球虫的鸡血清所识别,在片段大小为65×103处有1条蛋白质印迹带;rN1T1L2E1I2也可被这4种球虫感染鸡血清识别,在片段大小为82×103处有1条蛋白质印迹带。
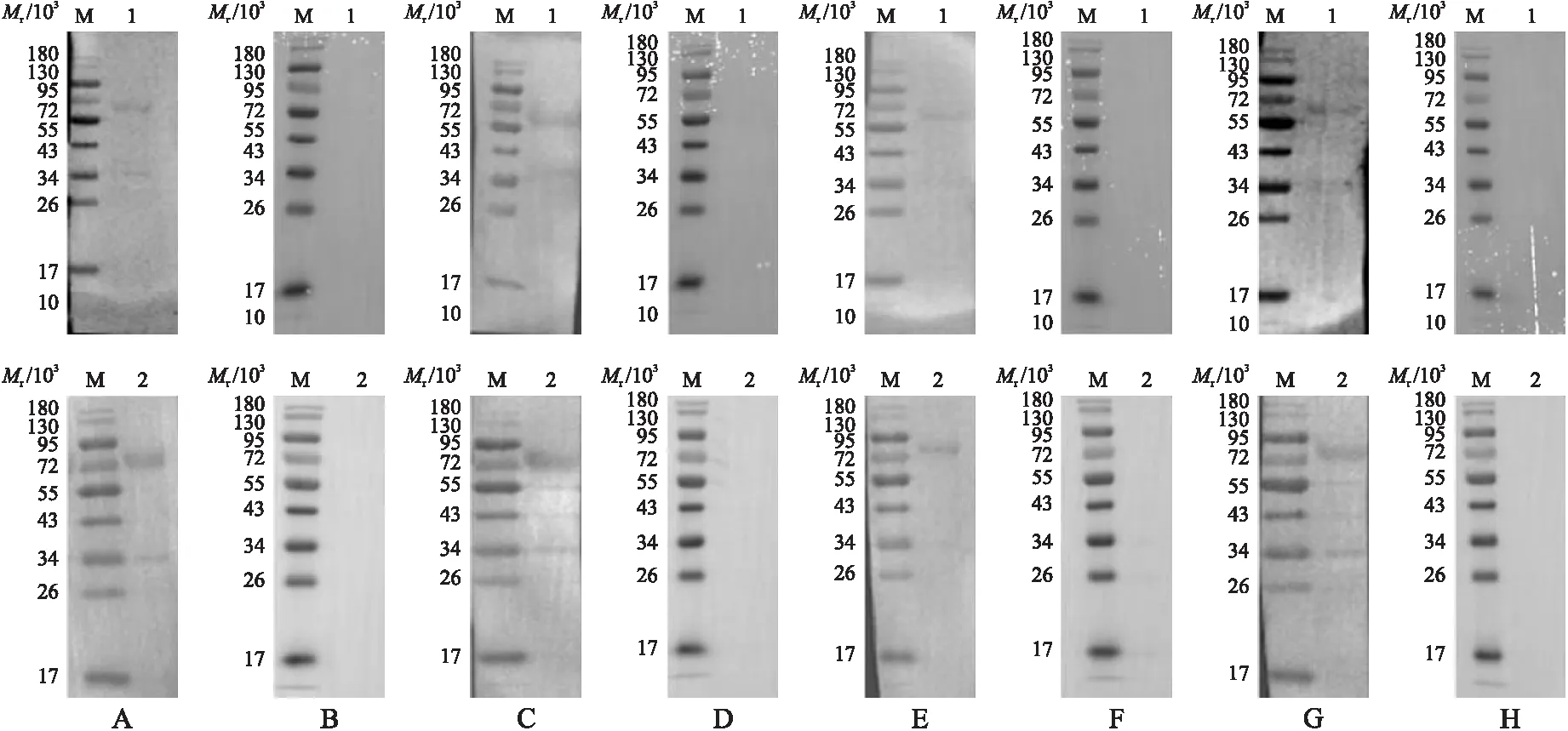
图3 Western blot分析rN1T1L2E1(上)和rN1T1L2E1I2(下)蛋白的抗原性Fig.3 The analysis of antigenicity of rN1T1L2E1(above)and rN1T1L2E1I2(below)protein by Western blotA,C,E,G. 一抗分别被柔嫩、毒害、巨型和堆型艾美耳球虫感染的鸡血清E.tenella,E.necatrix,E.maxima,E.acervulina infected chicken serum as the primary antibody;B,D,F,H. 一抗为健康鸡的鸡血清Healthy chicken serum as the primary antibody.M. 蛋白标准品Protein marker;1. rN1T1L2E1;2. rN1T1L2E1I2.
2.4 重组蛋白免疫后脾脏T细胞亚类比例的变化
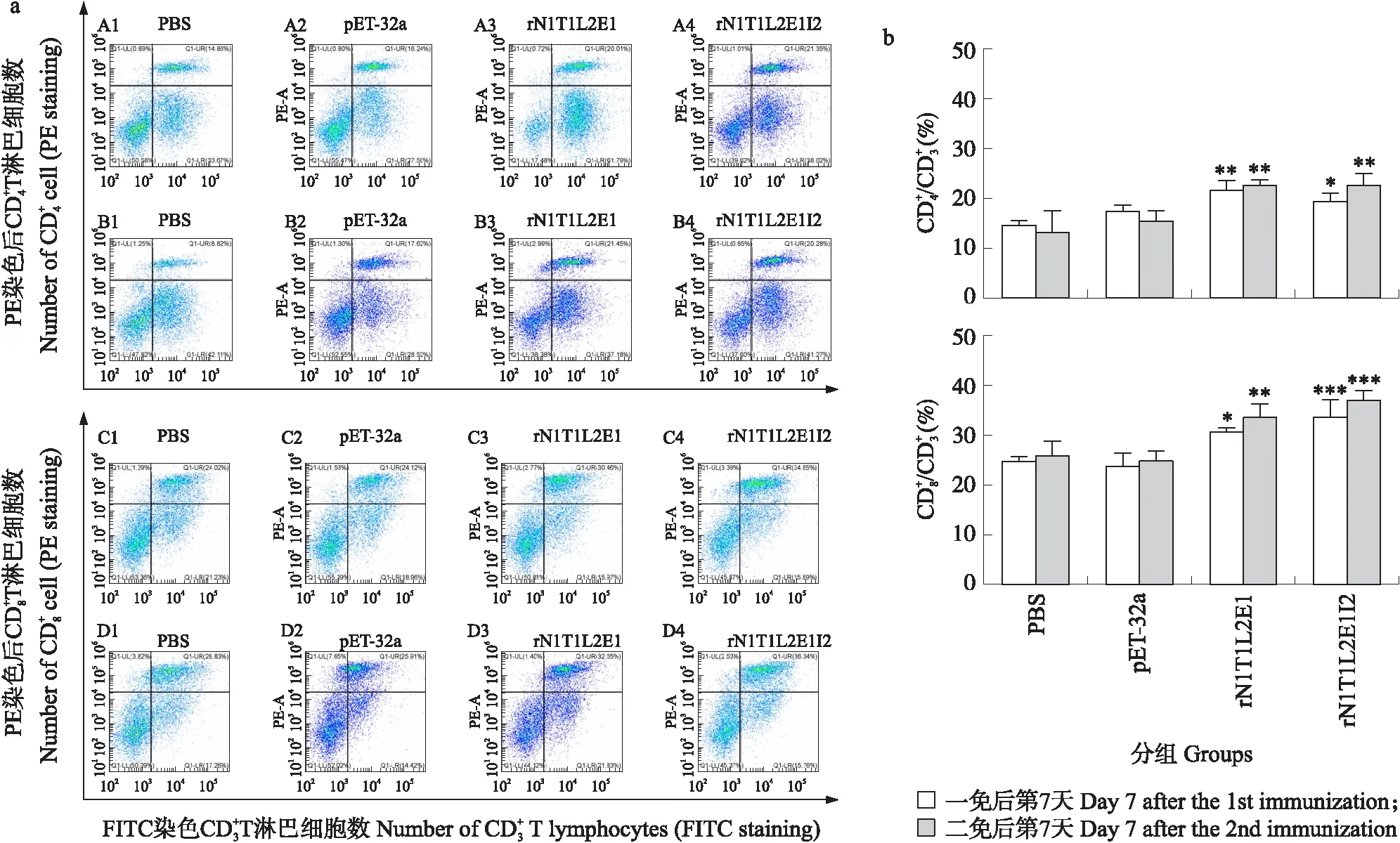
图4 重组蛋白免疫后试验鸡脾脏淋巴细胞亚类变化的流式图(a)和统计图(b)Fig.4 Flow chart(a)and histogram(b)of lymphocytes subtype in spleen of chickens immunized with recombinant proteinPBS:PBS对照组PBS control group;pET-32a:pET-32a对照组pET-32a control group;rN1T1L2E1:rN1T1L2E1试验组rN1T1L2E1 test group;rN1T1L2E1I2:rN1T1L2E1I2试验组rN1T1L2E1I2 test group. The same below.a. 表示免疫后鸡脾脏T淋巴细胞亚类变化流式图(A、B和C、D分别表示一免和二免后和 T淋巴细胞数)Flow cytometry of T lymphocyte subsets in chicken spleen after immunization(A,B and C,D mean number of T lymphocytes after the first and second immunization);b. 免疫后鸡脾脏淋巴细胞亚类变化柱形图Histogram of lymphocyte subsets in spleen of chickens after immunization.*P<0.05,**P<0.01,***P<0.001. The same below.
2.5 重组蛋白免疫后雏鸡血清细胞因子水平的变化
用间接ELISA方法对重组蛋白免疫诱导的鸡血清中细胞因子水平进行检测。如图5所示:免疫前各试验组间及与PBS对照组和pET-32a蛋白对照组之间的IgG水平无显著差异(P>0.05)。一免后,与PBS组和pET-32a蛋白对照组相比,免疫组血清TGF-β、INF-γ、IL-4和IL-17的细胞因子水平显著升高(P<0.05)。二免后,4种细胞因子继续上升的趋势不明显。
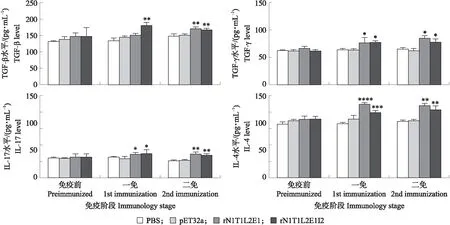
图5 鸡血清中各细胞因子水平Fig.5 Levels of cytokines in chicken serum
2.6 重组蛋白免疫后雏鸡血清IgG水平变化
用间接ELISA方法对重组蛋白免疫诱导的鸡血清中IgG水平进行检测。如图6所示:首免后,与对照组相比,rN1T1L2E1I2试验组血清中IgG水平显著升高(P<0.05),而rN1T1L2E1试验组IgG水平变化不显著(P>0.05)。二免后2个试验组IgG水平继续提升,相比对照组差异更加显著(P<0.05)。
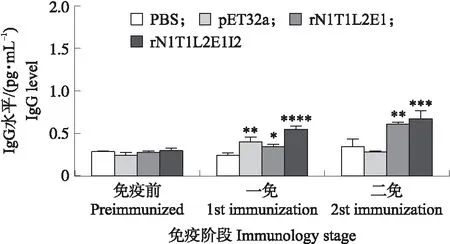
图6 鸡血清中IgG水平Fig.6 IgG level in chicken serum
2.7 重组蛋白对球虫感染雏鸡的免疫保护作用评估
本试验中,各组雏鸡的存活率均为100%。由表2可知:与非免疫攻虫对照组和pET-32a蛋白对照组相比,rN1T1L2E1和rN1T1L2E1I2抗柔嫩、毒害、巨型和堆型艾美耳球虫感染试验组的相对增重率、病变计分、盲肠内容物卵囊数均差异显著(P<0.05)。对于艾美耳球虫不同种的攻击,2个试验组在ACI值上有所差异。对于柔嫩艾美耳球虫,rN1T1L2E1试验组在相对增重率上有优势,ACI值略高于rN1T1L2E1I2试验组;对于毒害艾美耳球虫,rN1T1L2E1与rN1T1L2E1I2试验组的ACI值持平,rN1T1L2E1试验组相对增重率略高;对于巨型艾美耳球虫,rN1T1L2E1I2组在相对增重率和病变计分减轻方面占优势,其ACI值高于rN1T1L2E1组;对于堆型艾美耳球虫,rN1T1L2E1组ACI值略高于rN1T1L2E1I2组。综上所述,未串联IL-2基因的重组疫苗rN1T1L2E1抗球虫效力优于串联IL-2基因作为佐剂的重组疫苗rN1T1L2E1I2。

表2 重组蛋白rN1T1L2E1和rN1T1L2E1I2对柔嫩、毒害、巨型和堆型艾美耳球虫感染的保护效果Table 2 Protective effect of recombinant protein rN1T1L2E1 and rN1T1L2E1I2 against E.tenella, E.necatrix,E.maxima and E.acervulina
3 讨论

rN1T1L2E1和rN1T1L2E1I2诱导血清中IFN-γ、IL-4和TGF-β的水平显著高于对照组,说明其能激活以Th1和Th2类细胞因子诱导的免疫反应。虽然部分学者认为抗体在抗球虫感染过程中发挥作用有限[18],但也有学者认为体液免疫也可以发挥一定的免疫保护效果[19]。Wallach[20]研究表明,用巨型艾美耳球虫配子体抗原免疫母鸡后可以激发母鸡的母源抗体,借此保护雏鸡抵抗球虫感染;另外用特异性IgG对鸡进行被动免疫的策略也起抗球虫的效果[21]。本试验中,相较PBS对照组,rN1T1L2E1和rN1T1L2E1I2能够显著提高鸡血清中IgG水平,加强免疫后,试验组IgG水平进一步提高。说明这2个重组蛋白均能有效激发机体的体液免疫。Western blot结果证明这2个重组蛋白具有针对4种球虫的免疫原性和抗球虫活性,说明rN1T1L2E1和rN1T1L2E1I2具有良好的免疫原性。
球虫的多价多表位疫苗是指针对多种球虫均有抵抗作用,同时携带多个目标抗原上表位或辅助性表位的疫苗[22]。多价多表位亚单位疫苗表达重组的抗原表位,选择的表位多来自抗原分子的保守氨基酸序列[23],这样能够有效应对球虫基因的高频突变带来的免疫逃避问题。在本文抵抗4种球虫感染的动物试验中,试验组相对增重率显著增高,表明 rN1T1L2E1和rN1T1L2E1I2能够缓解因4种球虫感染造成的体重损失和饲料转化率下降的问题;试验组病变计分显著下降,说明重组蛋白能够减轻由于球虫感染带来的盲肠壁肥厚、肠芯或盲肠肿大、小肠黏膜损伤、肠管充气、肠道充血等肠道症状;试验组盲肠内容物卵囊数显著下降,表明重组蛋白能够减少感染鸡的球虫卵囊数,抑制球虫在肠道内的发育和生活史。试验组抗球虫指数ACI值明显高于对照组,表明重组蛋白可对4种球虫感染提供交叉免疫保护力,可作为抵抗多种球虫感染的候选抗原。
IL-2是目前应用最广泛的细胞因子佐剂,IL-2能够增强单核细胞与NK细胞的杀伤活性,同时能促进T细胞和B细胞的增殖分化,在免疫调节、肿瘤、感染性疾病的治疗上起着重要的作用[24]。研究表明,鸡IL-2和IL-7共表达能够增强鸡VP2 DNA疫苗针对IBDV的保护效果[25]。TA4基因和鸡IL-2串联的DNA疫苗对鸡球虫病具有良好的免疫保护作用[26]。而柔嫩艾美耳球虫5401基因与IL-2串联型DNA疫苗能够增强抗鸡球虫效力[27]。但在本试验中,表达IL-2基因的rN1T1L2E1I2与未表达IL-2基因的rN1T1L2E1的抗球虫能力相当。这可能与鸡IL-2重组蛋白的空间结构变化和蛋白活性变化有关。这提示下一步试验中,鸡IL-2重组蛋白应单独表达,与候选抗原共同免疫以进一步观察抗球虫效力是否得到提升。
本试验使用不添加任何佐剂的重组亚单位疫苗,相比任喆[9]构建的DNA疫苗抗球虫指数略有下降。这可能因为重组亚单位疫苗是在体外表达纯化的病原体蛋白,难以保持蛋白的天然构象表位,诱导的免疫反应强度减弱导致的。相对传统疫苗,其存在难以穿过细胞膜、在细胞微环境容易被迅速降解等缺点。另外重组蛋白疫苗通常要求多次接种,因此联合安全有效的免疫佐剂对于诱导足够水平的免疫保护具有重要作用[28]。重组亚单位疫苗优化了抗原基因的免疫原性,可规模化生产,其成分单纯,避免了减毒疫苗或灭活疫苗的免疫抑制原和反应原。另外,重组亚单位疫苗是在无致病性和无害的微生物中表达,保证生物安全性[29]。因此它是一种更有潜能的新型疫苗。本试验中重组蛋白表达量大,纯化效果良好,证明其具有规模化生产的潜能。后续工作将围绕最适佐剂选择、最适免疫途径、最适免疫剂量逐步展开。

