姜黄素对非酒精性脂肪肝大鼠肝11β-HSD1表达及胰岛素抵抗的影响
孙红爽李鹏霖刘永双乜春城高玲娜
(哈励逊国际和平医院药学部,河北 衡水 053000)
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是临床上常见的慢性肝病之一,与2型糖尿病、肥胖、高血压、高脂血症等疾病密切相关[1]。NAFLD的发病机制尚不完全明确,但“二次打击”理论已被普遍认同,胰岛素抵抗、氧化应激、炎症反应和脂质代谢紊乱在其疾病进展过程中发挥了重要作用[2]。姜黄素(curcumin)是中药材姜黄的主要有效单体组分,具有抗炎、抗氧化、调节血脂、保护肝细胞、抗肿瘤等多种药理作用[3]。本研究自2019年3月至2020年3月,通过高热量饲料喂养建立非酒精性脂肪肝大鼠模型,观察姜黄素对非酒精性脂肪肝大鼠肝11β-羟基类固醇脱氢酶1(11β-hydroxysteroid dehydrogenase,11β-HSD1)表达及胰岛素抵抗的影响,为姜黄素治疗NAFLD提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
36只8周龄清洁级雄性Wistar大鼠,体重180~220 g,由河南实验动物中心提供【SCXK(豫)2017-0001】,饲养于中国药科大学药理教研室【SYXK(苏)2018-0018】。饲养条件:温度21~25℃,湿度50%~60%,光照控制保证12 h明、暗条件,自由饮水摄食。适应性喂养1周后开始实验。本研究经哈励逊国际和平医院伦理委员会审核批准(批件号:2018-3-015)。
1.1.2 主要试剂与仪器
姜黄素(Sigma公司,美国);全自动生化分析仪(7600-020,日立公司,日本);两步法RT-PCR试剂盒(TaKaRa公司,日本);11β-HSD1抗体(Santa Cruz公司,美国);实时定量PCR仪(MJ Research公司,美国);Mini-Protean 3电泳槽、半干式转膜槽、Power PacTM Basic电源(Bio-Rad公司,美国)。
1.2 方法
1.2.1 动物分组与给药
36只大鼠随机分为4组:对照组8只、模型组12只、姜黄素低剂量组(C1组)8只姜黄素高剂量组(C2组)8只。对照组喂给普通饲料,其他3组喂给自制高热量饲料(配方:22%猪油+8%糖+2%胆固醇+2%食盐+66%基础饲料),饮用自来水。8周后,模型组处死4只,确定造模是否成功。造模成功后,C1组、C2组分别灌胃给以姜黄素200 mg/(kg·d)和400 mg/(kg·d)。连续给药8周。
1.2.2 胰岛素耐量试验
末次给药后,进行胰岛素耐量试验,试验方法参照文献[4]。
1.2.3 样本采集及处理
实验结束时,大鼠禁食12 h,称体重,麻醉后颈动脉插管取血,3500 r/min离心10 min,分离血清,于-20℃保存待测。取大鼠肝,称重,计算肝指数(hepatic index,HI):HI(mg/g)=肝重量(g)/体重(g)×1000。制作肝石蜡切片,苏木精-伊红染色法(HE)染色,光学显微镜下观察,参照非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)临床研究评分系统[5]评分,评分标准参照文献[6]。
1.2.4 血液指标测定
采用全自动生化分析仪检测各组血清丙氨酸转氨酶(alaninne aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、总胆固醇(Totalcholesterol,TC)、甘油三酯(triglycerides,TG)、高密度脂蛋白(high density lipoprotein,HDL)、游离脂肪酸(free fatty acid,FFA)及血糖。采用DFM-96型16管放射γ免疫计数器检测血清肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)和胰岛素。并计算胰岛素抵抗指数(homeostasis model assessmentinsulin resistance,HOMA-IR):HOMA-IR=(空腹胰岛素×空腹血糖)/22.5。
1.2.5 肝组织生化指标测定
取新鲜肝组织200 mg,制成10%的组织匀浆,3000 r/min离心15 min,取上清液,测定肝组织TC、TG、FFA及TNF-α含量,检测方法同血液指标测定。
1.2.6 肝组织11β-HSD1基因表达
11β-HSD1引物上游5’-GCAGAGCGATTTG TTGTT-3’,引物下游5’-TGTCTATGAAGCCGAGGA-3’;β-actin上游5’-CATCACCATGGCAATGAGCGG-3’,下 游5’-TGCGGTCCACGATGGAGGGGCC-3’。PCR反应条件为94℃预变性30 s,然后94℃变性4 min,48℃退火1.5 min,72℃延伸2 min,运行30个循环,最后72℃延伸10 min。PCR产物于2%琼脂糖凝胶电泳,全自动凝胶成像分析系统进行灰度扫描,计算各组相对灰度。
1.2.7 肝组织11β-HSD1蛋白表达
提取肝组织蛋白进行Western Blot检测。14.7%分离胶、5%浓缩胶,60 V电泳后转膜2 h,室温封闭2 h,以兔抗小鼠11β-HSD1多克隆抗体为一抗(1∶200稀释)4℃过夜,以羊抗兔IgG-HRP抗体为二抗(1∶800稀释)室温作用2 h,ECL检测。Bandscan软件对结果进行定量分析,并用自身β-actin灰度值校正。
1.3 统计学分析
结果以平均值±标准差(±s)表示,统计学处理采用SPSS 13.0软件。多重组间比较采用单因素方差分析(Oneway ANOVA)及LSD检验,P<0.05表示具有统计学意义。
2 结果
2.1 胰岛素耐量试验
与对照组(4.28±0.28)mmol/L比较,模型组基础血糖值(5.18±0.39)mmol/L显著升高。腹腔注射胰岛素30 min后,对照组、模型组、C1组和C2组血糖分别下降了44.15%、13.53%、28.14%、32.58%。与对照组(11.76±0.70)mmol*h/L比较,模型组AUC值(16.89±1.36)mmol*h/L显著升高(P<0.01);与模型组比较,C1组(14.98±0.88)mmol*h/L和C2组(12.96±0.51)mmol*h/L AUC值均显著下降(P<0.01),且C2组下降更明显(见图1)。
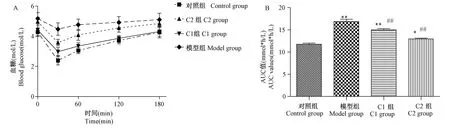
图1 胰岛素耐量试验中不同时间点的血糖值和AUC值(±s,n=8)Note.Compared with the control group,*P<0.05,**P<0.01.Compared with the model group,##P<0.01.Figure 1 Blood glucose values at different time points and AUC values in Wistar rats(±s,n=8)
2.2 血液生化指标
与对照组比较,模型组大鼠AST、ALT、血糖、血脂、胰岛素及炎症因子TNF-α水平均显著性升高(P<0.05);与模型组比较,C1组和C2组以上各项指标均有不同程度的好转,且C2组变化更为明显;其中TG只有下降趋势,无显著性差异(P>0.05),其余各项指标均有显著性差异(P<0.05)(见表1)。
表1 各组大鼠血液生化指标(±s,n=8)Table 1 Serum parameters of Wistar rats(±s,n=8)
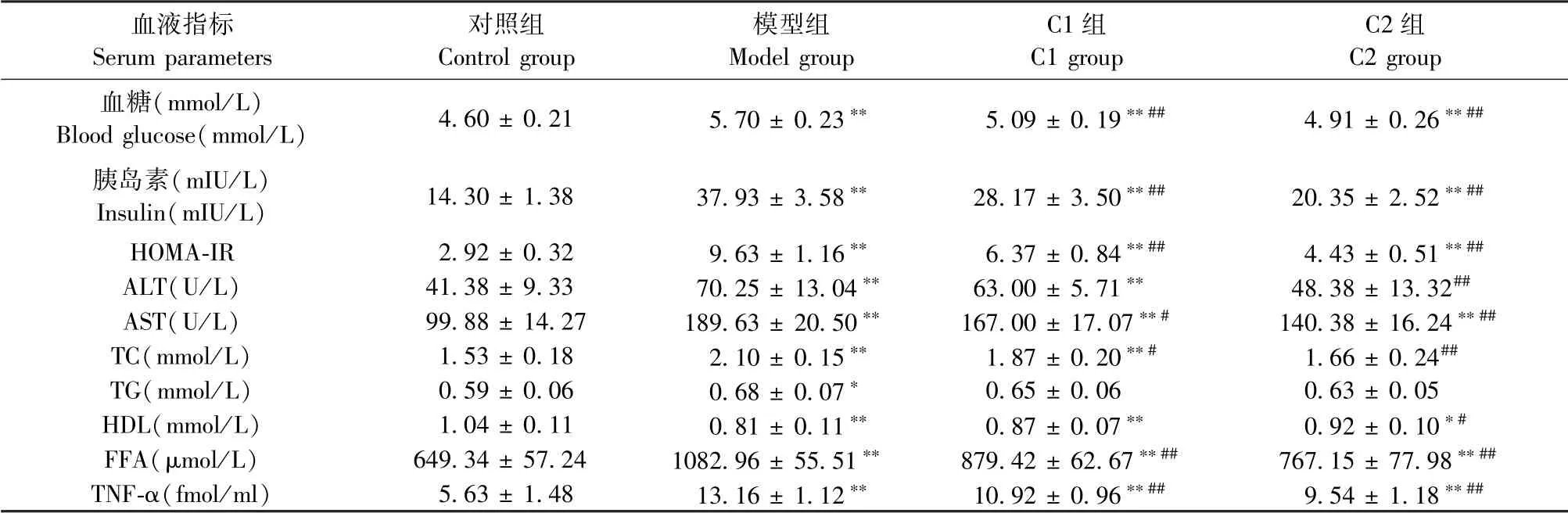
表1 各组大鼠血液生化指标(±s,n=8)Table 1 Serum parameters of Wistar rats(±s,n=8)
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。(下表同)Note.Compared with the control group,*P<0.05,**P<0.01.Compared with the model group,#P<0.05,##P<0.01.(The same in the following table)
血液指标Serum parameters对照组Control group模型组Model group C1组C1 group C2组C2 group血糖(mmol/L)Blood glucose(mmol/L) 4.60±0.21 5.70±0.23** 5.09±0.19**## 4.91±0.26**##胰岛素(mIU/L)Insulin(mIU/L) 14.30±1.38 37.93±3.58** 28.17±3.50**## 20.35±2.52**##HOMA-IR 2.92±0.32 9.63±1.16** 6.37±0.84**## 4.43±0.51**##ALT(U/L) 41.38±9.33 70.25±13.04** 63.00±5.71** 48.38±13.32##AST(U/L) 99.88±14.27 189.63±20.50** 167.00±17.07**# 140.38±16.24**##TC(mmol/L) 1.53±0.18 2.10±0.15** 1.87±0.20**# 1.66±0.24##TG(mmol/L) 0.59±0.06 0.68±0.07* 0.65±0.06 0.63±0.05 HDL(mmol/L) 1.04±0.11 0.81±0.11** 0.87±0.07** 0.92±0.10*#FFA(μmol/L) 649.34±57.24 1082.96±55.51** 879.42±62.67**## 767.15±77.98**##TNF-α(fmol/ml) 5.63±1.48 13.16±1.12** 10.92±0.96**## 9.54±1.18**##
2.3 肝指数和肝生化指标
与对照组比较,模型组大鼠肝指数明显增大,出现明显的肝脂质沉积,且肝TNF-α含量明显升高(P<0.01);与模型组比较,C1组和C2组以上各项指标均显著下降(P<0.05),且C2组下降更为明显(见表2)。
表2 各组大鼠肝生化指标(±s,n=8)Table 2 Hepatic tissue biochemical parameters of Wistar rats(±s,n=8)
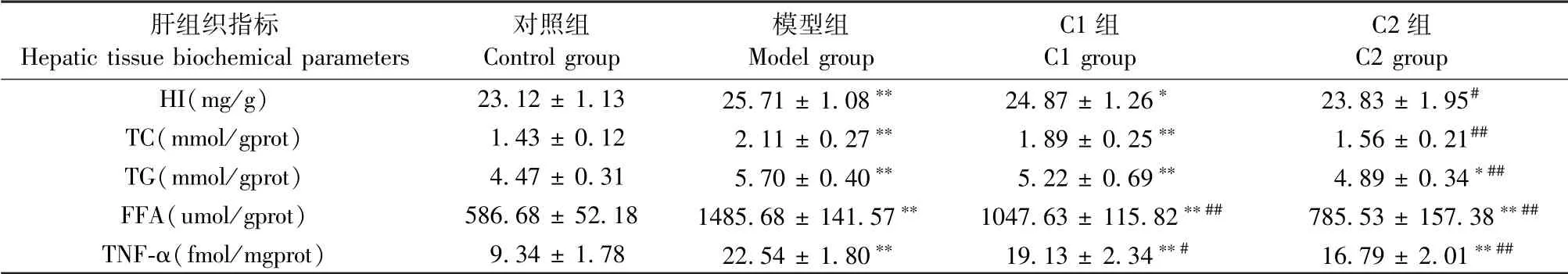
表2 各组大鼠肝生化指标(±s,n=8)Table 2 Hepatic tissue biochemical parameters of Wistar rats(±s,n=8)
肝组织指标Hepatic tissue biochemical parameters对照组Control group模型组Model group C1组C1 group C2组C2 group HI(mg/g) 23.12±1.13 25.71±1.08** 24.87±1.26* 23.83±1.95#TC(mmol/gprot) 1.43±0.12 2.11±0.27** 1.89±0.25** 1.56±0.21##TG(mmol/gprot) 4.47±0.31 5.70±0.40** 5.22±0.69** 4.89±0.34*##FFA(umol/gprot) 586.68±52.18 1485.68±141.57** 1047.63±115.82**## 785.53±157.38**##TNF-α(fmol/mgprot) 9.34±1.78 22.54±1.80** 19.13±2.34**# 16.79±2.01**##
2.4 肝组织11β-HSD1基因及蛋白表达
与对照组0.052±0.008、0.102±0.024比较,模型组0.264±0.015、0.477±0.074肝组织11β-HSD1 mRNA及蛋白表达明显升高(P<0.01);与模型组比较,C1组0.157±0.013、0.264±0.062和C2组0.091±0.009、0.191±0.021肝组织11β-HSD1 mRNA及蛋白表达均显著降低(P<0.05,P<0.01),且C2组变化更为明显(见图2)。
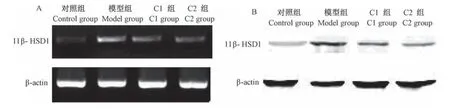
图2 各组大鼠肝组织11β-HSD1基因及蛋白表达Note.A.The expression of 11β-HSD1 mRNA in liver.B.Western Blot analysis of 11β-HSD1 in liver.Figure 2 Expression of 11β-HSD1 mRNA and protein in liver of Wistar rats
2.5 肝组织病理学观察与评分
对照组大鼠肝细胞结构完整,肝小叶清晰,所有动物均未显示有肝组织病变迹象;模型组8只动物均存不同程度的脂肪变性,7只存在汇管区炎症,6只存在轻度或中度肝细胞气球样变,4只出现肝纤维化;C1组6只存在轻度脂肪变性,4只出现汇管区炎症,5只存在轻度肝细胞气球样变,2只出现肝纤维化;C2组3只存在轻度脂变,2只出现汇管区炎症,2只存在轻度肝细胞气球样变(图3,表3)。
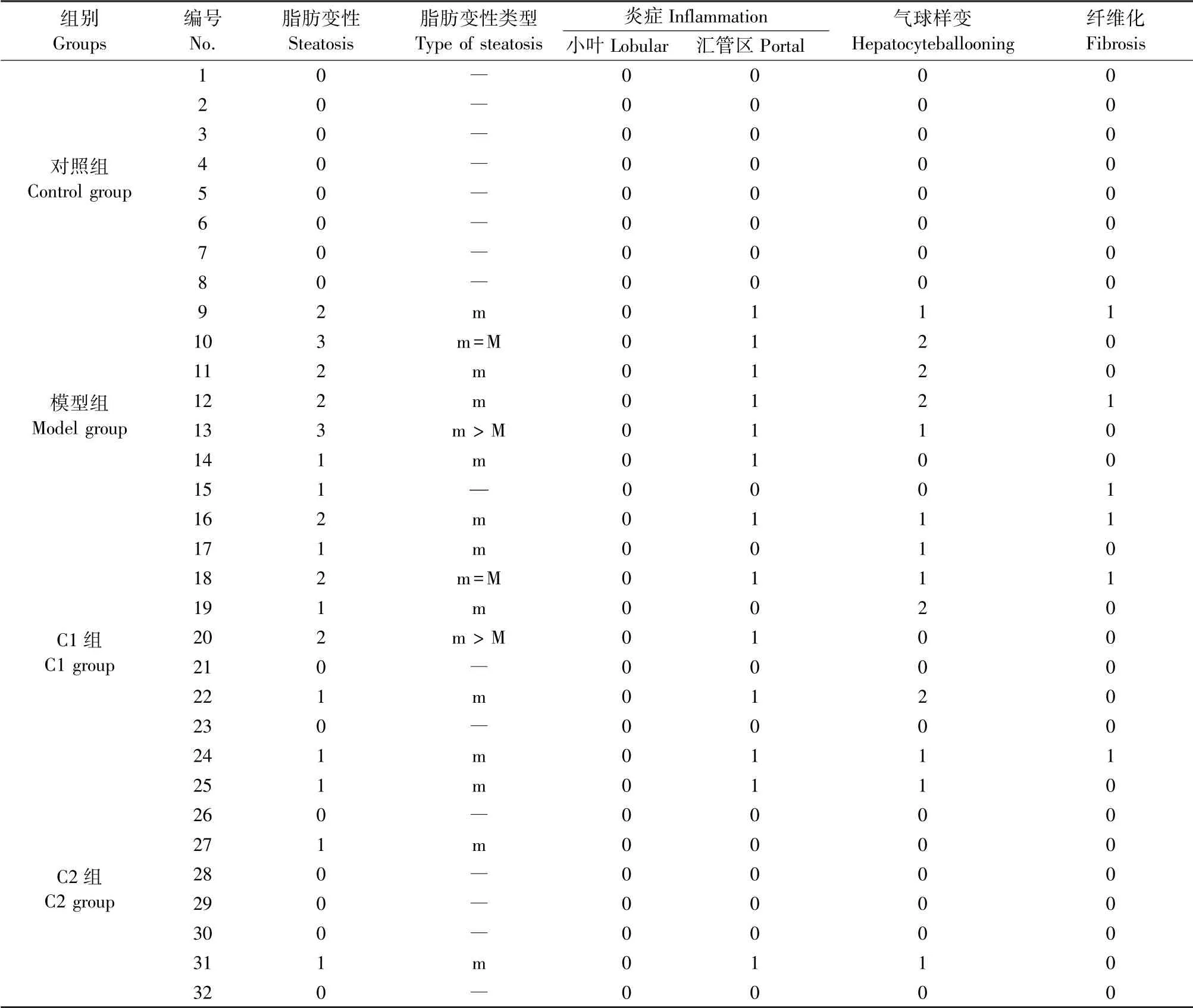
表3 肝组织切片评分结果Table 3 Histopathological assessment of steatosis,lobular inflammation,hepatocyte ballooning,portal inflammation and fibrosis
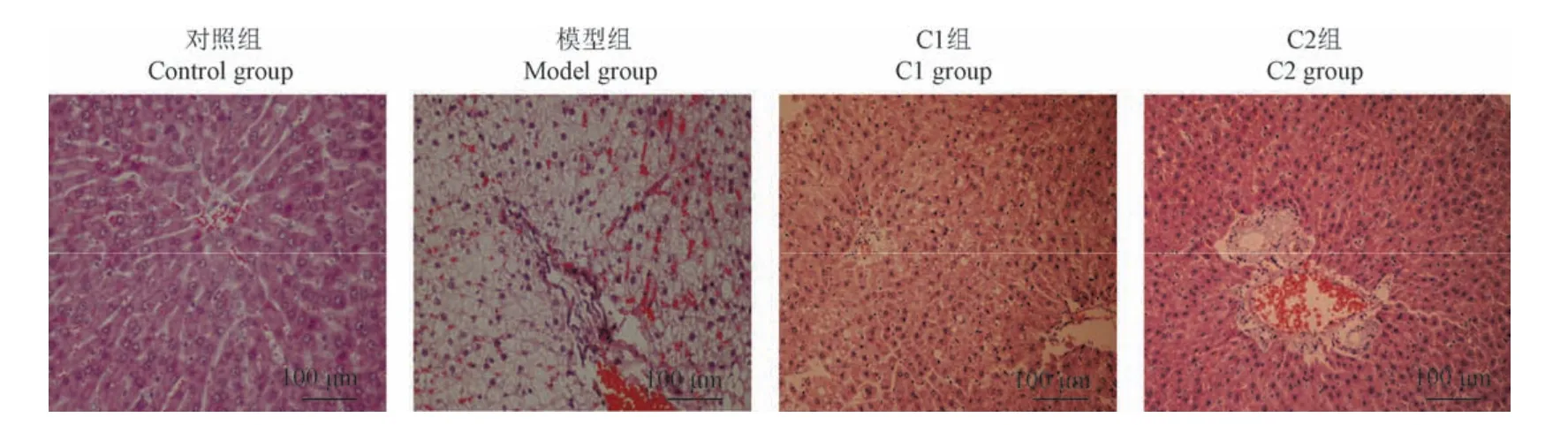
图3 大鼠肝病理切片Figure 3 Representative histopathological findings in the liver of Wistar rats
3 讨论
NAFLD是代谢综合征疾病谱中的重要一员,其发病机制尚未完全阐明,但现已证实其发病过程与胰岛素抵抗密切相关[5]。本研究通过高热量饲料喂养的方式成功复制了大鼠NAFLD模型,表现为:肝指数增大、肝功能损伤、血脂紊乱、肝脂质沉积等病理改变,同时胰岛素耐量试验结果及HOMA-IR显示大鼠处于胰岛素抵抗状态,这也进一步证实了胰岛素抵抗在NAFLD发病机制中的重要作用。截至目前,并没有针对NAFLD的特效治疗药物,多采用改善饮食结构、运动等行为方式改变,结合降脂药物、胰岛素增敏剂、抗氧化剂、保肝药物等对症治疗[7-8]。
姜黄素是从中药姜黄根茎中提取的活性成分,具有广泛的药理活性,可用于治疗炎症、糖尿病、心血管疾病、代谢综合征、肿瘤等[9]。近年来,文献报道了关于姜黄素治疗非酒精性脂肪肝的实验研究,但治疗效果及作用机制尚不明确。舒泳翔等[10]研究发现,姜黄素干预可改善氧化应激水平,抑制炎症因子释放,同时降低肝细胞凋亡水平,从而有效治疗高脂饮食所致的大鼠NAFLD。吴鹏波等[11]认为姜黄素可通过上调自噬相关蛋白表达水平,减轻NAFLD大鼠肝组织脂质沉积和炎症反应。另外,也有学者认为姜黄素是一种天然的11β-HSD1抑制剂,可通过选择性的抑制11β-HSDl活性,从而有效改善胰岛素抵抗和肝脂肪性病变[12-13]。11β-HSD1是一种低亲和力、NADPH依赖的微粒体酶,主要在肝、脂肪、骨骼肌和胰腺中表达,在体内可以催化无活性的17-羟-11脱氢皮质酮转化为有活性的皮质醇,从而调节内循环中糖皮质激素水平来发挥生理效应[14]。11β-HSDl与代谢综合征、2型糖尿病等密切相关,11β-HSDl基因敲除后可改善动物胰岛素抵抗,11β-HSDl抑制剂有类似效果[15-16]。本次研究结果显示,姜黄素治疗对高热量饲料引起的大鼠NAFLD有显著改善作用,可以降低肝指数,改善肝功能,降低血脂及肝脂质沉积,减少炎症因子的释放,肝组织切片观察结果与指标检测结果吻合。模型组大鼠肝组织11β-HSD1基因及蛋白表达量均显著升高,姜黄素治疗可有效抑制肝组织内的11β-HSD1基因和蛋白表达,改善胰岛素抵抗,且姜黄素高剂量组以上改善作用更为明显。
综上所述,推测姜黄素作为一种选择性11β-HSD1抑制剂,可有效抑制肝组织内的11β-HSD1基因和蛋白表达,增加胰岛素敏感性,进而发挥对NAFLD的治疗作用。