新西兰兔全膝关节置换术后假体周围感染模型的建立
王勇平张怀斌谢瑞敏陶贵彦侯卫华刘小荣
(1.兰州大学第一医院骨科,兰州 730000;2.西北民族大学,兰州 730000)
人工关节置换术(joint replacement)是治疗终末期关节疾病(疼痛、畸形及功能障碍)最有效的手段,可显著改善患者生活质量。然而,关节假体周围感染(peri-prosthetic joint infection,PJI)是关节置换术常见的并发症,也是导致关节置换手术失败的常见原因之一[1-4]。目前,关节假体周围感染的诊断和治疗仍然是骨科的一大难题,其主要原因是关节假体周围感染的病原菌会形成细菌生物膜,建立合适的动物模型是深入研究人工关节置换术后感染的基础[5-6]。PJI动物模型最初是由Schurman等[7]在1975年提出和设计的,将不锈钢颗粒和金黄色葡萄球菌植入兔髌骨上囊,而不是植入骨中,此方法无法模拟骨-水泥-假体界面。1985年Petty等[8]把不同种类的细菌(金黄色葡萄球菌、大肠杆菌)注射到狗的股骨远端髓腔,分别用不锈钢合金、钴铬合金、高密度聚乙烯、聚甲基丙烯酸甲酯聚合等材料假体进行实验。尽管像狗这样的大型动物拥有与人类相似的肌肉骨骼和免疫系统,可以很好地模拟人类膝关节的环境,但由于伦理、经济成本等条件限制,在以后的PJI模型中,研究人员更倾向于选择兔子、大鼠和小鼠等。2010年Bernthal等[9]采用了同样的方法,将不锈钢克氏针逆行插入小鼠股骨远端建立PJI模型。髓腔内植入物最初是为了模仿TKA术后的PJI,但实际上混淆了骨髓炎模型和PJI模型。然而由于其操作的简单性和可重复性,许多研究人员仍然使用该方法进行PJI建模。但是与目前TKA中常用的钛合金材料相比,不锈钢承重能力有限,而且没有使用骨水泥固定假体;虽然最小感染剂量很低,但它不能完全复制假体周围的环境,这些因素都影响了假体表面生物膜的形成。Bernthal等[9]也认为术中未切除的股骨和胫骨软骨可能与致病菌相互作用。在2005年Craig等[10]在兔膝关节外侧副韧带前侧股骨髁钻孔,依次植入0.1 mL骨水泥、全螺纹不锈钢空心钉和超高分子量聚乙烯(UHMWPE)垫圈,材料位于膝关节外侧,只能承受垂直方向的压应力,不能承受旋转应力;此外该实验没有分离髓腔和关节腔,术中没有移除关节软骨,这些都限制了其在未来的进一步应用。2017年Carli等[11]首次将钛合金3D打印胫骨假体应用于PJI小鼠模型,描述了一种基于由关节底板和髓内茎组成的压贴合钛胫骨种植体的小鼠模型,在手术时使用金黄色葡萄球菌关节内接种。虽然该模型具有植入物负重表面的优点,但可能不能准确代表延迟发病、低水平PJI的临床特征,血液培养仍为阴性,全身炎症标志物通常在正常范围内[12]。
利用钛合金假体行新西兰兔全膝关节置换术,更类似于目前在TKA中使用的材料和技术,更利于手术膝关节局部低水平PJI的建立和持续,为诊治人工关节置换术后假体周围感染提供实验基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
48只健康清洁级成年新西兰兔,体重3.0~3.5 kg,购于中国农业科学院兰州兽医研究所,实验动物设施许可证【SYXK(甘)2020-0009】,动物生产许可证【SCXK(甘)2020-0001】,动物饲养条件:温度20~26℃,湿度40%~70%,光照周期12 h/12 h,动物自由采食和饮水。本研究符合兰州大学第一附属医院实验动物伦理委员会所制定的伦理学标准(伦理审批号:LDYYLL2020-40);实验过程中按照2006年中华人民共和国科学技术部《关于善待实验动物的指导性意见》进行[13]。
1.1.2 分组
将48只新西兰兔随机分成3组,实验组(假体周围感染组)、对照组(假体未感染组)及空白对照组(假手术组),每组各16只。实验组行左膝关节全膝关节置换术后7 d于新西兰兔关节腔内注射0.5 mL金黄色葡萄球菌液;对照组行左膝关节全膝关节置换术后7 d于新西兰兔关节腔内注射0.5 mL生理盐水;空白对照组只进行左膝关节囊切开缝合术,未植入假体,术后7 d未进行任何处理。
1.1.3 主要试剂与仪器
3%胰蛋白胨大豆肉汤琼脂培养皿(北京路桥公司),3%胰蛋白胨大豆肉汤培养基(北京路桥公司),0.4%结晶紫染料(武汉Servicebio公司),盐酸氯胺酮注射液(福建古田药业有限公司),盐酸塞拉嗪(吉林省华牧动物保健品有限公司),注射用青霉素钠(每支800 000 U,山东鲁抗医药股份有限公司),DR成像系统(荷兰Philips数字化X线成像系统)。
1.1.4 细菌及菌液配置
实验用菌株为金黄色葡萄球菌ATCC25923,由甘肃省第二人民医院检验科提供。将细菌接种于血琼脂培养皿中,放于37℃温箱培养24 h后,挑取单个菌落用无菌0.8%Nacl溶液配置浓度为1×107CFU/mL的菌悬液,用此浊仪确定其浓度。
1.2 方法
1.2.1 全膝关节置换术
术前1 d 10%硫化钠溶液脱毛备皮,术前4 h禁食、禁水,术中用盐酸塞拉嗪(4 mg/kg)和氯胺酮(8 mg/kg)肌肉注射麻醉[14]。
本系统的开发软件为Delphi 7.0;数据库管理系统为oracle 9i;辅助处理系统为office2003Photoshop 6.0。计算机操作系统选用:Windows9x2000NTXP或更高级的操作系统都可以安全运行本系统。
麻醉平稳后常规消毒铺巾,取左膝正中纵切口长约3 cm,逐层切开皮肤及皮下组织,髌旁内侧纵行切开髌旁组织及关节囊,显露关节腔,外翻髌骨并屈曲膝关节,切除内外侧半月板、前交叉韧带,依次对胫骨、股骨进行截骨和适度扩髓后植入关节假体,最后冲洗切口逐层缝合,包扎固定患肢,l周后随意活动。空白对照组在相同的条件下行左膝关节囊切开,不植入假体,缝合关节囊(图1)。
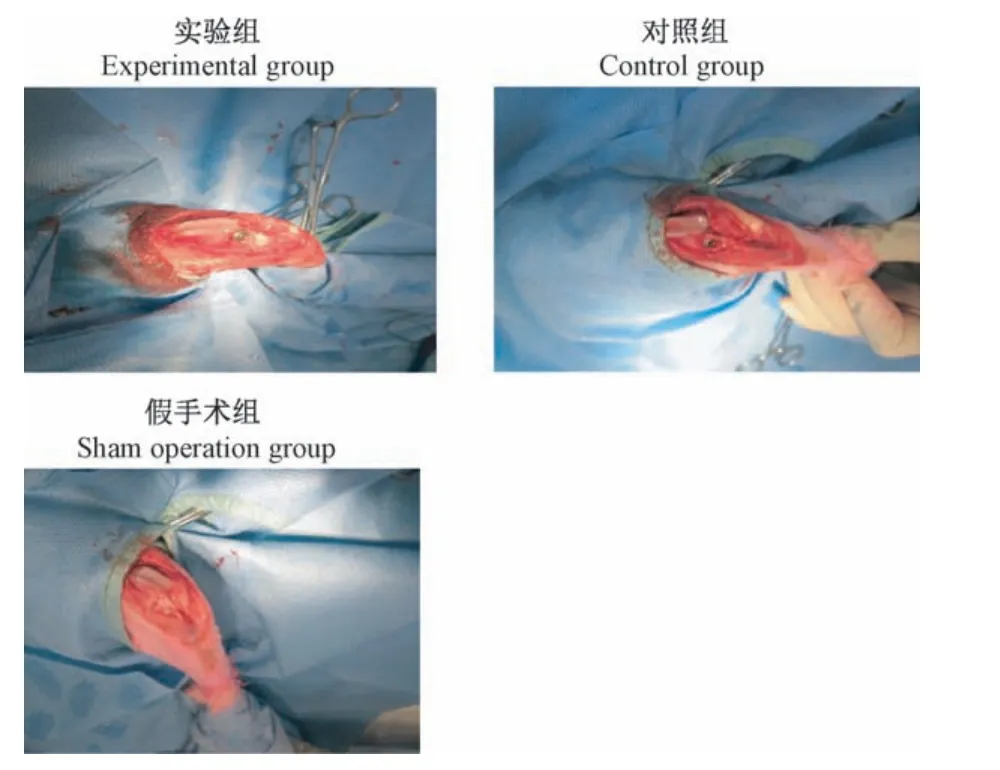
图1 假体植入Figure 1 Prosthesis implantation
术后预防性使用40万单位青霉素,肌肉注射,每天1次共3 d,术后每3 d换药1次,14 d拆除伤口缝线。
1.2.2 细菌接种
术后7 d,实验组于手术侧膝关节经髌韧带外侧缘,紧贴髌骨下极向内、后进针,触及假体后向腔内注射0.5 mL金黄色葡萄球菌液(1×107CFU/mL),对照组以相同的方法于手术侧膝关节腔内注射0.5 mL生理盐水,空白对照组未做任何处理。
1.2.3 观察指标
(1)一般情况观察:术后每天观察新西兰兔体温、体重、精神状态、步态及伤口愈合。
(2)影像学检查:3组新西兰兔于术后14、21 d,用盐酸塞拉嗪(4 mg/kg)和氯胺酮(8 mg/kg)肌肉注射麻醉后进行左侧膝关节X线检查。
(3)血液学检查:分别于手术当天及术后1、7、21 d,经耳缘静脉取血5 mL,行白细胞计数(WBC)、C反应蛋白(CRP)及血沉(ESR)检测。
(5)病理学检查:术后21 d处新西兰兔,取左侧膝关节,通过肉眼、光镜观察膝关节局部病理变化。
1.3 统计学分析
各组数据采用平均值±标准差(±s)表示,利用SPSS 13.0软件对各组实验结果进行统计分析。同组内不同时间点比较采用单因素方差,组间两两比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 一般情况观察
实验组新西兰兔术后21 d存活14只,1只于术后14 d死亡,1只于术后16 d死亡,存活率为87.5%;对照组及空白对照组新西兰兔均无死亡。术后3 d 3组新西兰兔精神状态差;术后14 d实验组新西兰兔精神状态差、体重稍降低,对照组及空白对照组新西兰兔精神状态可、无体重降低;术后21 d实验组新西兰兔术侧膝关节红肿、皮温较高,对照组及空白对照组新西兰兔术侧膝关节无红肿、皮温正常(见图2)。
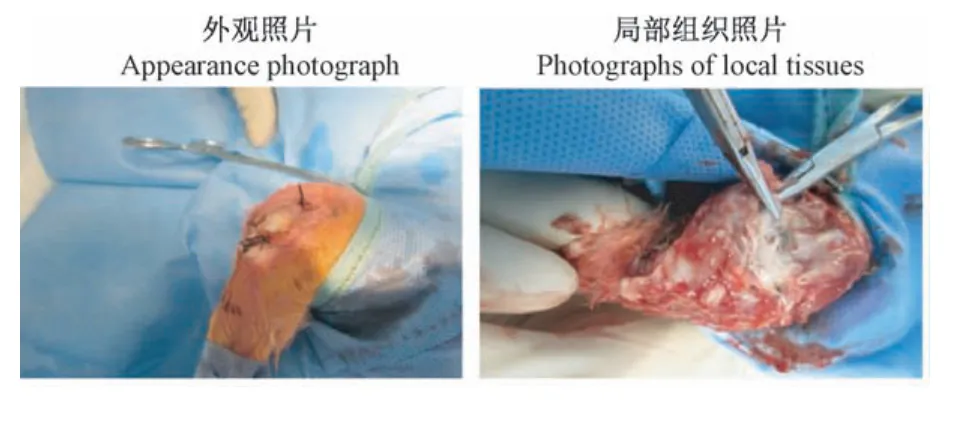
图2 关节腔注射细菌后2周Figure 2 2 weeks after injecting bacteria into the joint cavity
2.2 影像学检查
实验组及对照组新西兰兔术后14、21 d X线片均显示关节假体稳定在位,未见假体松动,术后21 d实验组可见关节周围软组织肿胀,对照组及空白对照组关节周围软组织无明显肿胀(见图3)。

图3 假体植入后3周X线Figure 3 X ray 3 weeks after prosthesis implantation
2.3 血液学检查
各组新西兰兔手术当天及术后1、7、21 d WBC、ESR、CRP结果进行比较,结果显示术后21 d实验组WBC较对照组及空白对照组高(图4A),具有显著性差异(P<0.05);实验组ESR较对照组及空白对照组高(图4B),具有显著性差异(P<0.05);实验组CRP较对照组及空白对照组高(图4C),具有显著性差异(P<0.05)。

图4 不同时期血液学指标测定结果Note.A.Results of white blood cells at different stages before and after operation in each group.B.Results of erythrocyte sedimentation rate before and after operation in each group.C.C-reactive protein results of each group at different stages before and after operation.Compared with control group,a P<0.05.Figure 4 Results of hematological indexes in different periods
2.4 细菌学检查
术后21 d实验组培养结果均为阳性;对照组细菌培养阳性1例,阴性15例;空白对照组细菌培养均为阴性(图5)。
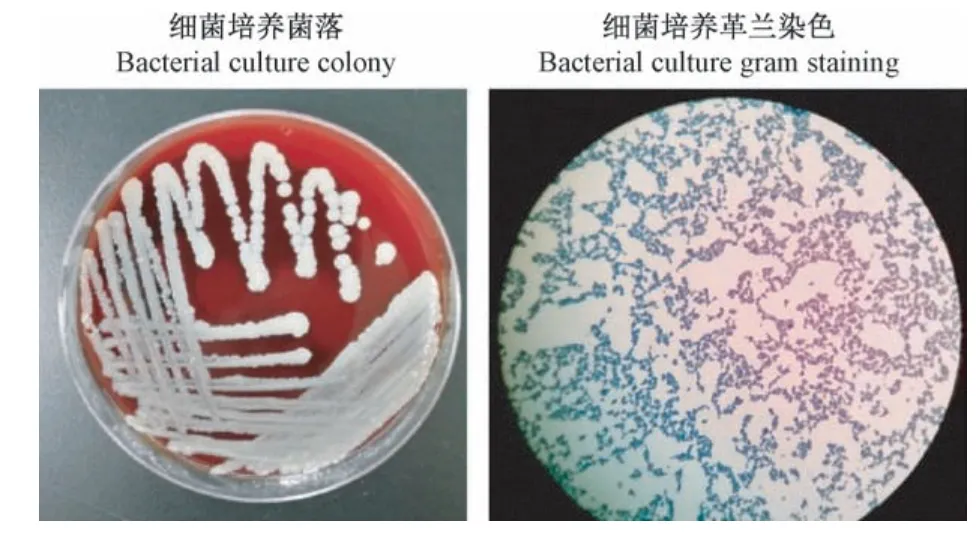
图5 关节腔注射细菌后2周细菌培养菌落及细菌培养革兰染色(×100)Figure 5 2 weeks after intracavitary injection of bacteria,bacterial culture colonies and Gram staining were observed(×100)
2.5 病理学检查
术后21 d实验组新西兰兔术侧膝关节滑膜肿胀,关节腔内及假体周围可见大量脓液,行HE染色:关节假体周围组织见大量炎性细胞浸润,假体周围纤维组织增生较明显,可见扩张、充血的小血管;对照组及空白对照组新西兰兔术侧膝关节腔内及假体周围可见少许透明液体,行HE染色:假体周围可见轻度纤维组织增生,未见炎性细胞浸润。
3 讨论
关节假体周围感染是关节置换术常见的并发症,也是关节置换手术失败的常见原因之一[1-4]。目前,关节假体周围感染的诊断和治疗仍然是骨科的一大难题,其主要原因是关节假体周围感染的病原菌会形成细菌生物膜[5-6]。
细菌生物膜是以细菌为生态群落,被包裹在其自身分泌的多聚物中所形成的一种膜状菌落结构[17],其形成过程主要包括4个阶段,即:定植阶段、聚集阶段、成熟阶段、脱落与再定植阶段,其中细菌生物膜形成最关键的阶段是定植阶段,在此阶段多糖蛋白复合物首先将细菌包裹形成膜状物,然后牢固附着在假体表面[18];当细菌以固着形定植在假体表面时,生物膜便进入聚集与成熟阶段,此时细菌生长繁殖的同时分泌大量胞外聚合物聚集细菌,成熟的细菌生物膜表面存在一些通道,表层细菌通过这些通道容易获得营养物质和排除代谢废物,对抗菌药敏感,拥有活跃的代谢状态,而里层细菌与外层细菌相反,不易获得营养物质和排除代谢废物,代谢缓慢,处于“休眠状态”,对抗菌药不敏感[19];成熟的细菌生物膜在内在机制或外部冲刷力等的作用下部分脱落或者释放成为浮游状态,在新的部位定植形成新的细菌生物膜,导致感染的扩散与复发。由于细菌生物膜形成过程的周而复始,使关节假体周围感染的病原学诊断及治疗面临极大的困难。
目前认为导致关节假体周围感染的病原菌可通过2种途径入侵,即直接浸润或血源传播,其中经血源性传播导致假体周围感染者约占20%,而手术中细菌直接进入伤口导致假体周围感染者高达63%[20]。尽管人工关节置换术后假体周围感染动物模型细菌接种方法包括静脉接种、即刻局部接种和延期局部接种,但本研究根据上述研究结果后选取术后7 d于关节腔内直接注射适量致病菌模拟病原菌直接进入关节腔导致关节置换术后假体周围感染。
几乎所有的细菌都可引起假体周围感染。人工关节假体植入后,可发生单一细菌感染,也可发生复合细菌感染。Fulkerson等[21]对146例THA和TKA翻修术后(共194个关节,其中髋关节110个,膝关节84个)的临床样本进行细菌培养,其中金黄色葡萄球菌最常见(35%),其次是表皮葡萄球菌(31%)和链球菌(11%),故本实验使用金黄色葡萄球菌作为致病菌,建立人工关节置换术后早期感染细菌模型。
由于关节腔注射的细菌浓度过高会引起模型动物脓毒血症,死亡率较高,若关节腔注射的细菌浓度过低则达不到假体周围感染的目的,因此,研究者有不同的探索,Southwood等[22]在股骨的髓质部分注入l×103CFU的金黄色葡萄球菌,THA术后所有兔的假体周围感染;王子明等[23]利用1×l06CFU和1×l08CFU两种剂量的MRSE进行关节腔注射,1×l06CFU的细菌可造成兔股骨头置换术后75%感染,而1×l08CFU的细菌可造成兔股骨头置换术后100%感染;吴宇黎等[24]在关节腔内接种1×104CFU的MRSE SL-76,导致TKA术后全部大鼠假体周围感染;王志酬等[16]在关节腔内接种5×105CFU的MRSA,TKA术后全部兔发生假体周围感染;丛锐军等[25]在关节腔内接种1×105CFU的金黄色葡萄球菌,成功构建稳定的兔TKA术后假体周围感染模型。
影像学检查、血液学检查、细菌学检查及病理学检都是诊断假体周围感染的方法,其中细菌培养是判断感染是否存在的金标准。X线检查是骨科最常用的检查手段之一,然而在假体周围感染早期缺乏典型的X线改变,不能准确反映感染的病理过程,因此X线对早期假体周围感染诊断意义不大。血液学检查简单、快速,是目前临床上最常用的检测方法[26]。假体周围感染最常用的血液学实验室检查是WBC、ESR、CRP和白细胞介素6(IL-6)等,其中WBC、CRP及ESR对感染诊断虽然有帮助,但都是非特异性的指标,WBC一般只对急性感染和引起全身症状时比较敏感,而在亚急性感染、慢性感染和低毒性感染时无意义;CRP和ESR常在关节置换术后即快速升高,ESR一般迟于CRP达到其峰值,其可能持续数个月,而在术后2个月内CRP则可降到正常[27];如果术前CRP正常,术后3个月CRP仍高于正常或者下降后又上升,表明该患者存在关节假体周围感染的可能,一般情况下CRP正常提示不存在感染,但也可能是由于抗菌药物的应用或低毒性细菌感染导致的假阴性;IL-6峰值出现在关节置换术后6~12 h,在术后48~72 h恢复正常[28],由于血液学指标的非特异性,因此本研究采用多项血液学指标测定,旨在探讨利用血液学指标检测新西兰兔全膝关节置换术后感染模型的效果[12]。本研究中将细菌培养作为判断感染的唯一标准,在实验中,将不同组织样本放置于营养肉汤中,放入37℃恒温箱孵育24 h后接种于血琼脂培养皿,继续于37℃恒温箱培养24~48 h,这样大大降低了培养结果的假阴性率。
总之,细菌生物膜影响假体周围感染的诊断和治疗,往往存在临床提示感染但是细菌培养阴性的情况,使临床医生无法早期诊断并及时使用敏感抗生素治疗[29]。因此,正确诊断引起假体周围感染的病原菌是假体周围感染治疗成功与否的关键步骤之一。本研究结果表明新西兰兔全膝关节置换术后7 d接种0.5 mL 1×107CFU的金黄色葡萄球菌可成功构建假体周围感染模型,为人工关节置换术后感染的诊断及治疗提供了实验依据,并为进一步研究人工关节置换术后感染以及生物膜形成的机制提供理论依据和基础。

