糖尿病视网膜病变动物模型研究进展
王娇娇李苗史平玲张贝贝魏圆梦王艳歌宋宗明
(河南省人民医院,河南省立眼科医院,郑州 450003)
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病(diabetes mellitus,DM)最常见的微血管并发症之一,是成年人低视力和致盲的主要原因[1-3]。我国是世界上II型糖尿病患者最多的国家,成年人糖尿病患病率约为10.9%~11.6%[3-4],其中约27.9%发展成DR[5]。DR的发病机制复杂,具体机制尚不明确[6],研究表明DR病理改变涉及视网膜缺血,异常新生血管,视网膜炎症,血管渗透性增加[7],神经元和神经胶质异常等诸多表现[8],给DR的临床诊治及研究带来不便。受临床标本来源及伦理学限制,围绕DR发病机制的临床研究极难开展。DR动物模型不仅能帮助人们更加全面地了解DR的病因病机,同时也能更好地进行新型药物和干预手段的筛选,更重要的是动物模型具有可控性、易得性及预知性等特点,具备了优于人体研究的优势。因此,选择可靠、可行和适当的动物模型是探索DR病因病机的关键。近年来随着DR发病率及危害性的持续升高,诸多DR动物模型被学者筛选并建立。其中啮齿类动物以其成本较低,造模时间短,取材方便,重复性好等优势成为建立DR模型的首选。目前,国际上围绕DR的动物模型主要有药物诱导型、高脂高糖饮食型和遗传型动物模型。为全面了解DR动物模型的优劣势,为实验研究提供参考,特将当前主流DR动物模型综述如下,以资参考。
1 药物诱导型
DR根据眼底血管损伤程度分为非增生型糖尿病视网膜病变(nonproliferative diabetic retinopathy,NPDR)和增生型糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)两类。NPDR以血管迂曲、视网膜出血、微血管瘤和脂质渗出为特点,当出现异常新生血管增殖时发展为PDR。DR另一个重要病理特征为糖尿病黄斑水肿,主要由液体积聚在神经视网膜中导致视网膜增厚和黄斑囊样改变引起[9]。能否较好模拟DR临床病理特征,是判断模型成功与否的重要标志。药物诱导模型因建模便捷,病理改变模拟性强等特点是当前DR常用动物模型。药物诱导型主要包括链脲佐菌素(streptozocin,STZ)及四氧嘧啶诱导(alloxan,AXL)模型。
STZ是诱发糖尿病最常用的药物,其药效机制主要通过破坏胰岛β细胞导致高血糖[10-13]。STZ诱导的糖尿病大鼠,2~4周出现血-视网膜屏障(blood-retinal barrier,BRB)破坏,4~6周时神经胶质细胞的凋亡增加,同时伴随视网膜外核层厚度的变薄和神经细胞的减少,紧接着出现感光细胞的死亡[14]。基底膜的增厚、周细胞的丢失是DR的基本病理改变,且周细胞和内皮细胞结构和功能的完整性对维持视网膜毛细血管的稳定性具有十分重要的作用,STZ诱导的糖尿病可出现上述一系列病理改变,成为DR早期病理改变的理想动物模型。研究显示,STZ可诱导兔出现视网膜出血、血管病变、静脉血栓形成和增殖性视网膜病变,并可诱导猴子出现带有棉絮斑和高荧光斑的缺血性视网膜病变,STZ可诱导猪的视网膜BRB通透性增加,INL和神经节细胞层(GCL)变薄,毛细血管基底膜增厚[15]。STZ诱导动物模型所致DR在病理改变上能够较好模拟临床常见DR病理特征,能够为DR发病机制研究及治疗提供预测性,在DR研究中应用广泛。
此外,在STZ诱导DR模型中,由于胰岛β细胞的损伤程度取决于STZ的剂量,因此STZ诱导的糖尿病可能因剂量的不同,成模效果有所差别[16]。唐东红等[17]使用单次大剂量(60 mg/kg,45 mg/kg)和多次小剂量(30 mg/kg)的STZ静脉注射恒河猴,结果发现实验猴均出现不同程度的视网膜病,分别显示早期眼底微血管动脉扩张、视网膜出血瘤、微血管瘤、新生血管及晚期白内障等。但是,单次大剂量注射倾向于造成胰岛素依赖性糖尿病,而多次小剂量注射倾向于造成慢性持续性高血糖症,后者诱发的DR模型与人类极为相似,表现为胰岛β细胞受到损害导致的糖代谢紊乱,损伤视网膜上的微血管,发生纤曲、变形,甚至破裂,进而形成微血管瘤。有文献表明单次大剂量注射STZ可快速导致大量的胰岛β细胞坏死,而多次小剂量注射可造成部分胰岛β细胞损伤,激发炎症反应,从而导致胰岛β细胞迅速失活[18]。因此,在实验研究中需要选择合适的剂量,既要保证DR的发生,又要避免胰岛素合成和分泌功能的衰竭,且尽量减少STZ对其它组织的损害。基于当前DR模型的病理结果研究,STZ诱导DR模型以采取小剂量多次诱导方法更为适宜。
AXL和STZ机理类似,目前AXL广泛用于小鼠、大鼠、狗、兔子、猪等多种动物中诱导DR。大鼠给药AXL一周内出现糖尿病[19],2个月时出现光感受器的破坏和间质水肿,且视网膜的厚度减小,伴随脉络膜血管数量减少,内皮细胞和血管壁紊乱[20]。另外,四氧嘧啶可诱发幼犬糖尿病,每周给药1次,持续5周,诱导的视网膜病变与人类的DR非常相似。综合而论,药物诱导DR动物模型能够不同程度上模拟DR临床病理改变特征,其中以STZ诱导模型与临床符合度最高。在实验研究中,学者可以根据对DR病理改变的研究侧重选择相应动物模型。
2 高脂高糖饮食型
高脂高糖饮食诱发的啮齿类视觉疾病动物模型已经有50年的历史[21-22]。小鼠在高脂高糖饮食6周时出现高血糖,15个月后,观察到视网膜内皮细胞减少,21个月后,可观察到微动脉瘤和视网膜增厚的病变[15]。而使用高脂高糖饲料喂养大鼠4周后,大鼠的视锥细胞感光器对光的敏感度下降[23]。然而,此种模型的缺点是视网膜病变的发展需要更长的时间,发病较慢,但其优点是比其他模型的小鼠活得更久,可以观察更长时间。因此,目前比较常用的是高脂高糖饮食联合STZ注射来诱导的DR模型,通过高脂高糖饮食诱导胰岛素抵抗之后,再注射低剂量STZ损伤胰岛功能,引起血糖的升高,模拟II型糖尿病的发病过程[24]。研究表明此种方法可导致视网膜变薄和结构的紊乱,和血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达升高[25-26]。因此,单纯使用高脂高糖饮食诱导DR动物模型常见于对DR的长期研究观察及药物筛选中,常规实验研究中应用较少。
3 遗传性动物模型
DR成因复杂,主要观点认为糖尿病病程和血糖控制情况是DR出现的核心诱因,但临床研究发现部分患者即使血糖控制良好,糖尿病病程持续时间短,也可能短期内出现DR。而部分患者血糖控制较差,糖尿病病程持续时间较长,但也可能不会发展为DR,表明DR的发生发展存在异质性[26]。且基于人群研究显示,DR呈现一定的种族发病特征,表明遗传因素是DR发病的重要诱因[27]。为探索DR遗传病因及机制,遗传性DR动物模型被大量建立。I型和II型糖尿病诱发的DR都存在遗传性动物模型,常用的实验动物模型包括小鼠、大鼠和斑马鱼等。由于啮齿类动物具有简便易得、操纵性强、经济高效等的特点,因此啮齿类动物常被用作DR的遗传模型。
3.1 小鼠遗传模型
DR的遗传小鼠模型主要包括Ins2Akita、非肥胖糖尿病(non-obese diabetic,NOD)、db/db(Leprdb)、Kimba和Akimba共5种,它们在遗传模式、疾病病因学、病理学和疾病进展方面各不相同。Ins2Akita小鼠是I型糖尿病的模型,主要是由于胰岛素基因Ins2突变,导致胰岛素蛋白的构象变化,引起的细胞死亡[28-29]。该模型可表现为血管通透性增加,周细胞丢失和新生血管的形成[30]。因此,Ins2Akita小鼠较适合于研究DR的早期进展和神经保护作用类药物药效评价[31]。NOD小鼠I型糖尿病的动物模型,小鼠在12周龄发生自发型高血糖,血糖升高4周后就开始出现周细胞、内皮细胞和RGCs凋亡,视网膜毛细血管基底膜增厚[32],约4个月可检测到大血管收缩和退行性变,微血管异常[33]。db/db(Leprdb)小鼠是美国Jackson实验室发现的自发型基因突变小鼠,为II型糖尿病的成熟模型,其瘦素受体发生突变,在4~8周大时,出现肥胖和高血糖,持续6周后,可观察到RGCs数量减少,中央视网膜厚度增加,15个月后,这些小鼠表现出BRB的严重破坏、周细胞丢失、RGCs细胞凋亡、胶质细胞激活[34]。Kimba小鼠是一种增殖性视网膜病变的非糖尿病模型,用纯合子Kimba小鼠和Ins2Akita小鼠交配培育出Akimba小鼠,Akimba小鼠的表现兼有Kimba小鼠和Ins2Akita小鼠的特征[35]。主要包括是周细胞和血管缺失,视网膜新生血管和弥漫性血管渗漏,随着疾病的进展可以观察到视网膜厚度的减少及视网膜持续水肿甚至视网膜脱离[36-37]。
3.2 大鼠遗传模型
DR的遗传大鼠模型主要包括Zucker大鼠(zucker diabetic fatty,ZDF)、Long-Evans大鼠(otsuka long-evans tokushima fatty,OLETF)、BB 大鼠(biobreeding,BB)、WBN/Kob大鼠、GK大鼠(goto kakizaki,GK)和Torii大鼠(spontaneously diabetic torii,SDT)。ZDF大鼠是一种自发性II型糖尿病模型大鼠,该模型在3个月时出现稳定的高血糖,高血糖8个月后,表现出类似DR的毛细血管基底膜增厚,毛细血管核密度增加等病理改变[38]。OLETF大鼠亦是一种自发性II型糖尿病和肥胖的模型,由于G蛋白偶联受体GPR10的起始密码子发生突变,导致肥胖[39-40],约在12周可表现为轻度肥胖,直到18周时才出现高血糖,27周时可观察到视网膜神经纤维层变薄[41]。据报道OLETF大鼠的视网膜毛细血管超微结构的形态学变化以及视网膜电图的变化与DR患者相似。因此,不同于I型糖尿病小鼠模型和STZ诱导的动物模型,OLETF大鼠表现为高血糖、胰岛素抵抗和病理特征类似于人类的II型糖尿病[42]。BB大鼠模型被广泛应用于I型糖尿病所致DR的研究,该模型在8~11个月时出现视网膜病变、周细胞丢失、毛细血管变性和微动脉瘤,以及由于自身免疫反应导致的胰腺小细胞凋亡[43]。WBN/Kob大鼠模型的特点是具有新生血管形成和腔内血管透明化的病变,这使其成为了解DR新生血管的理想模型[44]。GK大鼠和SDT大鼠均属于非肥胖II型糖尿病大鼠模型。52周龄的GK大鼠可表现为脉络膜厚度增加,内层脉络膜血管密度降低,视网膜内VEGFR2免疫反应性增强等[45]。SDT大鼠的一个显著特征是在视盘周围出现巨大的视网膜皱襞,并有广泛的渗漏,类似于在人类中观察到的视网膜脱离[46]。
3.3 斑马鱼遗传模型
除了啮齿类动物,最新研究表明斑马鱼也是DR的常用模型。Vhl斑马鱼的von Hippel-Lindau肿瘤抑制基因发生突变,导致血管形成增加,同时,缺氧诱导因子上调,触发VEGF的mRNA高表达,该模型的特点是玻璃样血管增多并伴有血管渗漏、黄斑水肿、视网膜脱离和严重的新生血管形成[47]。
为系统了解各种DR动物模型在模拟病理改变上的特征,特将当前主要动物模型所表现的病理改变总结如下,见表1。
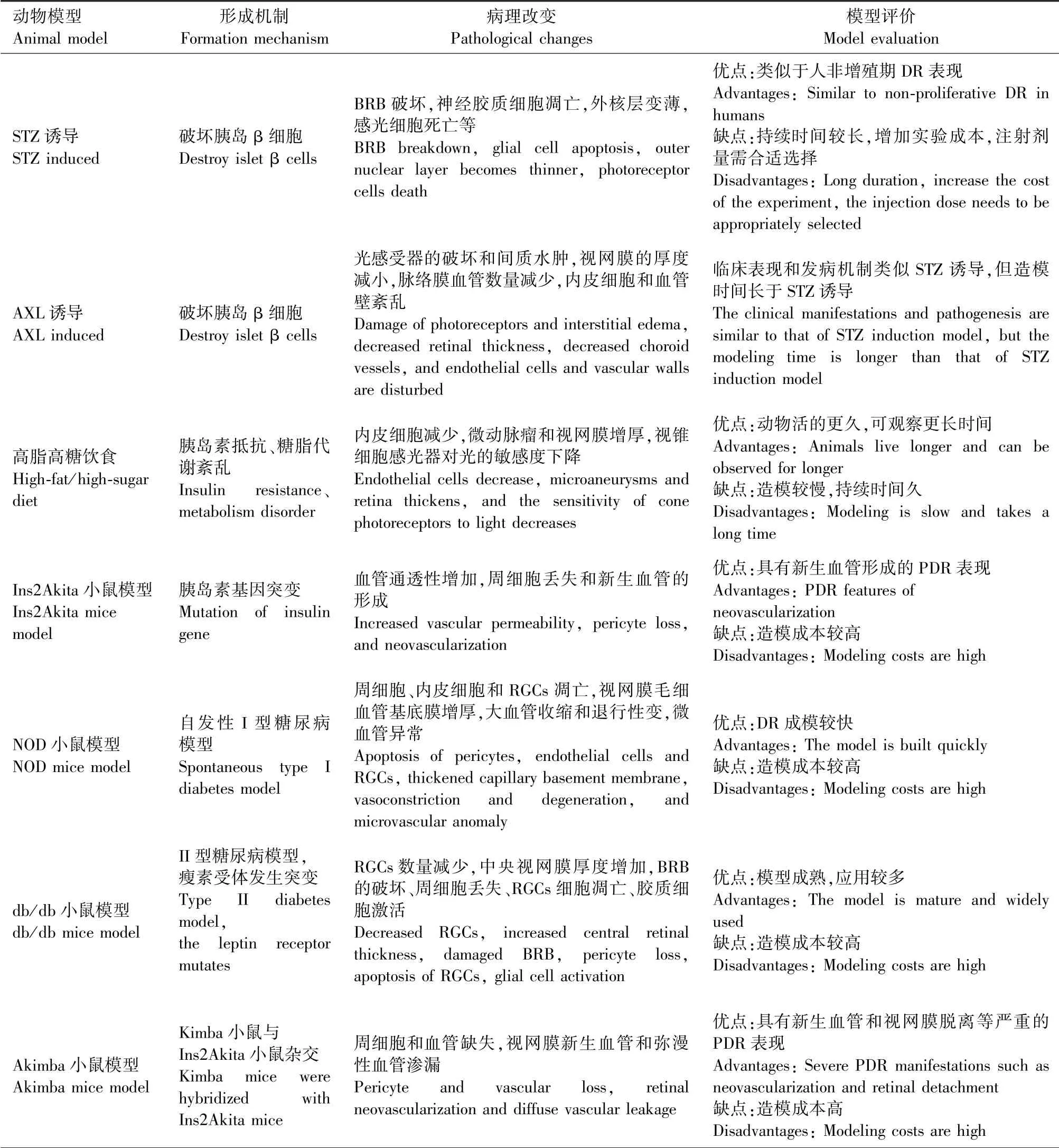
表1 研究DR的动物模型Figure 1 Animal model of DR

续表1
4 展望
动物模型是实验研究的基础,高度还原DR的临床特征和发病状态的动物模型是研究DR的理想对象。目前围绕DR的病因及发病机制而研发的动物模型不断增多,一方面显示了学术界对本病的不断重视,同时模型的多样化也体现了对DR病因及发病机制的研究缺乏明确的结论,表现出一定的局限性。目前针对动物模型优劣的评价,国际上多从表面效度、结构效度及预测效度三个维度进行评价。表面效度,即模型能够模拟疾病的典型特征;结构效度,即模型要符合一定的理论假说且病理生理改变应与假说或理论相一致;预测效度,即模型的药理学反映及非药理学反应与临床治疗表现相一致,并能够为远期的治疗及发病机制研究提供预测性[48]。基于评价三维度,结合模型制备的难易程度及经济效应进行评价,当前DR主要动物模型中,STZ诱导模型能够较好模拟DR临床病理表现及临床特征,且STZ诱导模型在细胞因子、胶质细胞增生等发病机制上能够为DR发病机制研究提供一定的方向预测,具有一定的预测效度,故STZ诱导DR模型为目前较理想动物模型,且建模成本低,操作方便。对于其他药物诱导DR模型,均能够模拟DR临床症状及对疾病发病机制进行一定的模拟,均有较好的表面效度及预测效度,而在模拟DR临床病例特征是不能够较全面与临床相吻合,结构效度不足。高脂高糖诱导动物模型结构效度、预测效度较差,且建模时间长,经济效益一般,元气淘汰可能性较大,除非进行长期药理观察,目前选择性较低。对于基因遗传模型,其建模目的围绕模拟疾病遗传发病机制而设立,本身具有较药物诱导模型更好的预测效度,但在模拟DR病理改变及临床症状时,遗传模型具有特定针对性,其结构效度及表面效度弱于药物诱导DR模型。遗传型动物模型的优点是能够自发形成I型或II型糖尿病,减少化学诱导方法可能带来的器官损害,但是该类模型造模成本高,繁殖力低,某些模型只有纯合子或者单一性别的鼠才能自发形成糖尿病,因此增加了动物的饲养数量[49]。
此外,尽管STZ诱导模型具有较好的表面效度、结构效度及预测效度,STZ诱导大鼠或小鼠糖尿病是目前比较公认的经典模型。但有一点需要指出,PDR是以新生血管的形成为主要标志的糖尿病微血管并发症,如果研究PDR必然涉及到新生血管,而STZ诱导模型出视网膜新生血管非常困难,有研究表明糖尿病大鼠成模3个月后HE染色显示视网膜组织出现水肿,成模6个月时视网膜各层结构不清晰,周围水肿更加明显,毛细血管明显扩张,但是并未看到明显的PDR表现[50]。因此,对于PDR的研究,STZ诱导模型的应用受限,在造模剂量、方法上需要继续探索。目前,由于糖尿病性新生血管模型建立困难,目前,非糖尿病性氧诱导视网膜病变(oxygen-induced retinopathy,OIR)模型已经成为研究视网膜新生血管的经典模型,被广泛使用。OIR模型利用了小鼠出生时只有部分发育的血管系统和后天对氧气浓度的控制可以影响血管行为这一特点,用于评估视网膜新生血管和中央血管闭塞。另外,往兔玻璃体腔内注射DL-α-氨基己二酸(DLAAA),可造成持续性视网膜新生血管,可导致长达48周的持续性血管渗漏[51]。但是这些模型终究不是高血糖引起的视网膜新生血管模型,结合DR疾病本身的复杂性,难以开发出一种和人类具有相同的所有的表型和基因型特征的“完美”模型,还没有一个单一的模型能够显示出在人类身上看到的DR的所有临床特征。
目前,已经建立的各种动物模型各具优点及缺点,都只能模拟人类DR的早期特征,并没有一种动物模型可以代表人DR的所有特征。因此,在选取DR的动物模型时,应认识到模型的优势和劣势,结合自己的实验设计和目的选择合适的动物模型。未来仍然需要大量的实验研究结合先进的检测技术开发出更加合适的DR模型,探索一种完美模拟DR的动物模型已成为本研究领域最大的挑战。