两种肥胖型多囊卵巢综合征伴胰岛素抵抗大鼠模型的构建及评价
徐海燕杜青徐琳本黄建华王红梅丁正香
(湖南省中医药研究院,长沙 410006)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种以慢性无排卵、高雄激素血症(多毛、痤疮、雄激素性脱发)以及卵巢多囊样改变为主要特征的内分泌代谢紊乱疾病,影响着12%~18%的女性[1]。长期的内分泌紊乱可导致不孕、肥胖、糖脂代谢异常,并带来一系列远期并发症,严重影响患者的生存质量[2]。其中,肥胖是促进PCOS病情发生发展的重要因素之一,肥胖型PCOS约占总发病率的一半,体内还存在明显的胰岛素抵抗(insulin resistance,IR)[3]。胰岛素抵抗和高胰岛素血症是PCOS病理生理的主要特征,约50%~65%PCOS患者存在胰岛素抵抗[4]。IR不仅是导致PCOS患者生殖障碍和代谢异常的主要原因,还可增加2型糖尿病、心脑血管疾病、代谢综合征等风险,严重影响患者身心健康[5]。
PCOS-IR由于发病机制复杂,临床组织样本获取困难,已成为目前研究的热点和难点,现有可供研究的实验动物模型众多,但与临床PCOS-IR特征的符合程度仍存在一定的差异[6-7],建立理想的PCOS-IR动物模型在实验研究中显得尤为重要。PCOS的动物造模方法主要包括经典Poresky法、雄激素联合HCG法、孕激素联合HCG法、雌激素法、芳香花酶抑制剂法等[8-10]。尽管造模方法多样,但仍有不尽完美之处,如雄激素大多属于油剂,长期皮下注射,药物不易吸收,容易导致造模不理想;孕激素法可能会影响促排卵药物的疗效,不适合促排卵药物研究;雌激素法对模型下丘脑-垂体轴有一定的损害,不适合后期治疗研究[4]。筛选并建立一种更贴近临床病理生理特征的PCOS-IR的实验动物模型对于临床防治具有重要意义。本实验采用两种不同方式分别联合高糖高脂饮食建立肥胖型PCOS-IR动物模型,通过比较两种模型不同时间节点生殖、内分泌和代谢指标差异,以期筛选出更符合临床特征的动物模型。
1 材料与方法
1.1 材料
1.1.1 实验动物
36只6周龄SPF级雌性SD大鼠,体重180~220 g,购于湖南斯莱克景达实验动物有限公司【SCXK(湘)2019-0004】,在湖南省中医药研究院实验动物中心【SYXK(湘)2020-0008】饲养,允许大鼠在恒定温度、湿度和光暗循环((22±2)℃;55%±10%;7:00~19:00光照循环)下自由饮用水和食物。本研究经湖南省中医药研究院动物伦理委员会批准(伦理审批号IACUC2019-0029),按照与湖南省中医药研究院实验动物中心的有关协议进行,所有程序均按照中国科学技术部制定的“实验动物护理和使用指导意见”进行。
1.1.2 主要试剂与仪器
来曲唑片(规格:每片2.5 mg,批号:190426KF,江苏恒瑞医药股份有限公司);胰岛素注射液(规格:每支400 IU,批号:21801204,江苏万邦生化医药集团有限责任公司);注射用绒促性素HCG(每支1000 U,批号:190303,丽珠集团丽珠制药厂);快速革兰氏染色液(批号MA0391-Jun-20E),购于大连美仑生物;卵泡刺激素(FSH,批号JM-01972R1)、促黄体生成素(LH,批号JM-02030R1)、雌二醇(E2,批号JM-01475R1)、总睾酮(T,批号JM-10537R1)、白细胞介素-1β(IL-1β,批号JM-01454R1)和肿瘤坏死因子-α(TNF-α,批号JM-10494R1)、胰岛素(INS,批号JM-01993R1)酶联免疫吸附试剂盒(ELISA),购于江苏晶美生物技术有限公司。IL-1β和TNF-α RT-PCR上下游引物(上海生物工程技术服务有限公司);逆转录反应试剂盒(TaKaRa)。血糖仪及血糖试纸(艾科,美国);Olympus生物显微镜(OLYMPUS公司,日本);TrilogyII型生化分析仪(Drew Scientific,美国);envision2105型酶标仪(PerkinElmer,美国);生物组织切片机(Thermo Scientific,美国);水平琼脂糖电泳槽(北京六一,中国);实时荧光定量PCR仪(Thermo Scientific,美国)。
1.2 方法
1.2.1 动物分组与造模
将36只SD大鼠按体重随机分为3组:对照组,每日灌胃0.5%羧甲纤维素钠溶液;Letrozole组,每日灌胃来曲唑溶液(1 mg/kg),HCG+INS组,颈背部皮下注射逐渐增量的胰岛素注射液,第1天(每天1次、每次0.5 U),第2、3天(每天1次、每次1.5 U),第4天(每天1次、每次2 U),第5天(每天1次、每次2.5 U),第6天(每天1次、每次3 U),第7、8天(每天1次、每次4 U),第9、10天(每天1次、每次5 U),第11~30天(每天1次、每次6 U),并加用HCG每天1次、每次3.0 U。其中对照组给予普通饲料和纯净水,Letrozole组和HCG+INS组皆给予高脂饲料(基础维持饲料61.5%、猪油12%、蔗糖5%、奶粉5%、花生5%、鸡蛋10%、麻油1%、食盐0.5%)和5%葡萄糖溶液饲养,连续30 d。
1.2.2 一般状态观察
每天观察记录各组动物活动、进食、粪便等,每周进行体质量监测。在造模第18天开始进行阴道涂片,连续10 d,判断大鼠动情周期变化。每天固定时间,抓住大鼠腰背部皮肤,腹部朝上,露出阴道口,将沾有生理盐水的无菌棉棒轻置于阴道内,转动4~5圈,将粘液均匀涂在载玻片上、风干、采用快速革兰氏染色法进行染色,风干后显微镜下观察排卵情况。分别在第23、30天挑选各组动物的一半进行以下处理。
1.2.3 样本采集
动物禁食不禁水12 h,腹腔麻醉后,腹主动脉取血,离心(3000 r/min,15 min),收集上清,-80℃保存待用。实施安死术后取子宫、卵巢,称取重量。将左侧卵巢保存在4%多聚甲醛固定液中,右侧卵巢液氮速冻,-80℃保存待用。
1.2.4 代谢指标和性激素检测
取上述保存的血清,采用生化仪检测空腹血糖(FBG)、血清总胆固醇(TC)和甘油三酯(TG)水平;采用酶联免疫吸附法,按照试剂盒说明操作,检测血清胰岛素(INS)、卵泡刺激素(FSH)、促黄体生成素(LH)、雌二醇(E2)、总睾酮(T)水平变化。并计算胰岛素抵抗指数(HOMA-IR=FBG(mmol/L)×INS(mIU/L)/22.5)。
1.2.5 卵巢病理形态学检测
取固定的各组大鼠卵巢组织,使用70%、90%、95%乙醇,二甲苯进行常规脱水,石蜡包埋、切4μm薄片,以及苏木素-伊红(HE)染色,脱水,封片,显微镜下观察卵巢病理形态学变化。
1.2.6 血清和卵巢炎症因子检测
按照ELISA试剂盒说明操作,检测血清肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)水平变化。采用实时荧光定量PCR法,检测冻存的卵巢组织中TNF-α和IL-1βmRNA表达水平,取约20 mg卵巢组织,加入1 mL TRIzol,充分研磨,裂解5 min,提取样本总RNA,核酸蛋白测定仪测定260/280 nm处A值,进行定量。按照逆转录反应试剂盒说明书将定量的RNA逆转录合成cDNA,反应体系为2X SYBGREEN PCR Master Mix 15μL,ddH2O 11 μL,上下游引物(10μmol/L)各1μL,cDNA 1μL。扩增条件为95℃预变性15 min,95℃变性15 s,60℃退火30 s,共40个循环。以β-actin为内参,反应结束后以2-ΔΔCt法计算分析目的基因TNF-α和IL-1β相对表达水平,以基因/内参吸光度比值的(±s)表示。引物序列见表1。

表1 TNF-α和IL-1β引物序列Table 1 TNF-αand IL-1βprimer sequences
1.3 统计学分析
数据分析采用统计软件SPSS 17.0,所有计量资料以平均值±标准差(±s)表示,组间采用单因素方差分析(One-way-ANOVA),不服从正态分布用非参数检验,P<0.05为差异具有统计学意义。
2 结果
2.1 体重变化
每周体重监测发现,各组大鼠体重逐渐增长,与对照组比,Letrozole组大鼠在第4周,体重显著增加(P<0.05),HCG+INS组无显著性差异(见图1)。
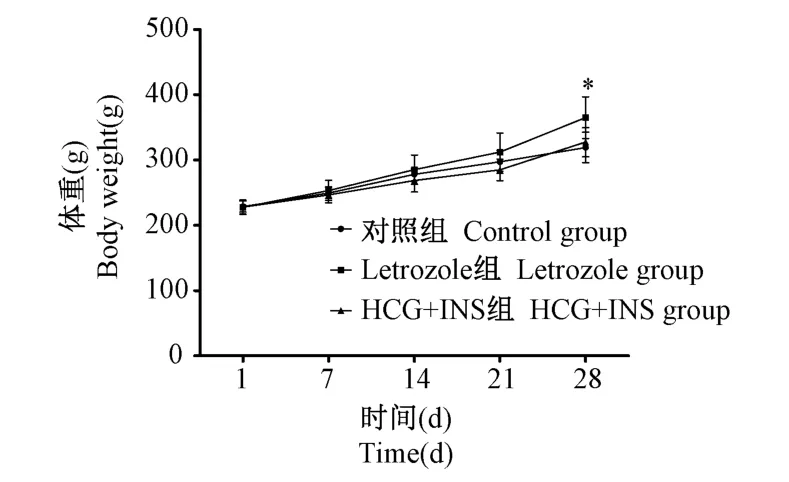
图1 各组大鼠体重增长曲线Note.Compared with control group,*P<0.05.Figure 1 Growth curve of rat body mass in each group
2.2 阴道涂片观察
于造模第18天,开始进行阴道涂片,共10 d,每5 d为一个动情周期,一共两个动情周期,观察大鼠动情周期的变化。对照组大鼠的阴道涂片显微镜下观察可见规律的排卵周期,在动情期可见大量的角质化鳞状上皮细胞(见图2);Letrozole组大鼠阴道涂片未观察到规律性周期,在第二个动情周期多数表现为大量的白细胞和有核上皮细胞,未见角化细胞;HCG+INS组偶见大片不规则角质化鳞状上皮细胞,大部分表现为白细胞和有核上皮细胞共存,提示有偶发排卵的情况存在(见图2)。

图2 各组大鼠阴道脱落细胞涂片观察Figure 2 Smears observation of vaginal exfoliated cell of rats in each group
2.3 脏器湿重比较
称量各组大鼠子宫和双侧卵巢重量,与对照组大鼠比较,在第23天和第30天,Letrozole组来曲唑给药大鼠子宫湿重皆显著性降低,卵巢湿重明显增加(P<0.05或P<0.01);第30天,HCG+INS组注射给药大鼠在卵巢湿重明显增加(P<0.05),子宫湿重增加但无显著性差异(见图3)。
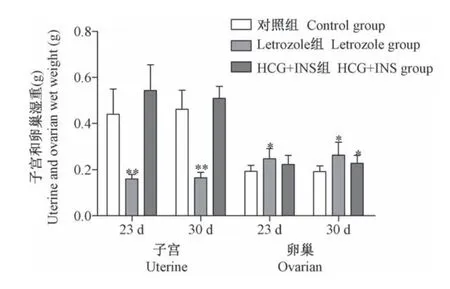
图3 各组大鼠子宫和卵巢的湿重比较Note.Compared with control group,*P<0.05,**P<0.01.(The same in the following figures)Figure 3 Comparison of wet weight of uterus and ovary of rats in each group
2.4 卵巢形态学变化
光镜下观察发现,对照组大鼠卵巢皮质区卵泡数目较多,处于不同发育阶段,黄体清晰,可见卵丘和卵母细胞,颗粒细胞层大多呈现8~9层,紧密排列,成熟卵泡结构完整,无充血、水肿等现象;Letrozole组大鼠卵巢囊性改变,卵泡囊性扩张明显,闭锁较多,颗粒细胞层数量减少,黄体数量减少;HCG+INS组大鼠各级未发育成熟的小卵泡数较Letrozole组稍少,黄体较大,颗粒细胞层减少,排列疏松(见图4)。其中,在实验第23天和第30天各组大鼠卵巢形态学差异不明显。

图4 各组大鼠不同时间节点卵巢HE染色Figure 4 Hematoxylin-eosin staining of the ovary of rats at different time points in each group
2.5 空腹血糖、胰岛素和血清总胆固醇、甘油三酯变化
与对照组比较,第23天,Letrozole组和HCG+INS组空腹胰岛素和胰岛素抵抗指数升高,TG水平明显增加(P<0.05或P<0.01);第30天,两组空腹血糖、空腹胰岛素和胰岛素抵抗指数皆明显高于对照组,TC、TG水平皆显著升高(P<0.05或P<0.01)(见图5)。

图5 各组大鼠空腹血糖、胰岛素含量、胰岛素抵抗、血清总胆固醇、甘油三酯比较Figure 5 Comparison of fasting blood glucose,insulin content,insulin resistanceserum total cholesterol and triglyceride of rats in each group
2.6 血清性激素浓度变化
在第23天,与对照组比较,Letrozole组T水平升高,E2水平降低(P<0.05),HCG+INS组LH增加,E2降低(P<0.05);在第30 d,两组FSH、LH水平均显著上调,E2水平下调,且Letrozole组T水平最高,具有统计学意义(P<0.05)(见图6)。

图6 各组大鼠血清性激素水平比较Figure 6 Comparison of serum sex hormone levels in rats in each group
2.7 各组大鼠血清TNF-α和IL-1β水平和卵巢TNF-α和IL-1βmRNA比较
在第23天,与对照组比,Letrozole组血清TNF-α水平和卵巢TNF-α和IL-1βmRNA表达显著上调(P<0.05或P<0.01),HCG+INS组血清TNF-α、IL-1β水平和卵巢IL-1βmRNA表达显著增加(P<0.05或P<0.01);在第30天,两组血清TNF-α和IL-1β水平皆显著增加(P<0.05或P<0.01)(见图7)。

图7 各组大鼠血清TNF-α、IL-1β水平和卵巢TNF-α、IL-1βmRNA表达变化Figure 7 Changes of serum TNF-αand IL-1βlevels and ovarian TNF-αand IL-1βmRNA expression in rats in each group
3 讨论
PCOS是育龄期女性最常见的内分泌疾病之一,也是累及全身多系统的疾病。其诊断通常基于临床指标月经失调、Ferriman-Gallwey得分、超声检查、肥胖症(BMI)及生化相关指标,如性激素六项、空腹血糖、空腹胰岛素等[11]。目前,可以用来制备PCOS的动物模型主要有大鼠、小鼠、家兔和猴,根据模型的经济性、稳定性、标准性以及重复性原则,大鼠被选为常用动物[4]。PCOS模型建立以无排卵或偶发性排卵、性激素分泌紊乱、糖脂代谢异常、胰岛素抵抗、卵巢多囊性病理改变等为主要评价指标。本研究以近年来研究发现的胰岛素抵抗致PCOS代谢异常特征为主要关注点,并比较众多PCOS造模方法的实施难易程度、可复制性及与临床症状的吻合程度,从中优选了比较常用和适合的PCOS-IR造模方法:来曲唑法和经典的Poresky法。
来曲唑是一种新型芳香化酶抑制剂,其通过抑制体内雄激素向雌激素转化,导致体内雄激素增加,高雄激素血症不仅可以导致IR,更是形成PCOS的基础[12]。经典的Poresky法是胰岛素联合HCG法,利用外源性胰岛素刺激卵泡膜细胞和间质细胞合成雄激素,造成高雄激素血症;同时HCG是一种LH的类似物,能促使LH水平增加,阻碍卵泡颗粒细胞的正常有丝分裂,并且与胰岛素有协同作用,共同加重高雄激素血症,导致排卵障碍,卵巢多囊样改变[13]。因PCOS-IR患者大多表现为肥胖,相较非肥胖型PCOS患者,肥胖型PCOS患者胰岛素抵抗表现更为严重[14]。但是,单纯的来曲唑灌胃给药和胰岛素联合HCG注射给药难以造成动物肥胖,因此,本研究采用5%葡萄糖液和高脂饲料饲养,促使动物肥胖,形成了更符合临床肥胖型PCOS特征的动物模型。文献调研发现,PCOS-IR动物模型造模时长难以选择,蔡云等[12]发现,30 d来曲唑联合高脂饲料喂养可成功诱导出PCOS-IR大鼠模型;魏巍等[15]研究表明,21 d胰岛素联合HCG法和来曲唑法均可成功诱导大鼠PCOS-IR模型,且大鼠模型其生殖及代谢指标的变化前者更具优势;王丽珍等[13]发现,8周胰岛素联合HCG法联合高脂饲料才可成功诱导大鼠PCOS-IR模型。因造模时间长短不一,PCOS-IR动物模型与临床特征吻合程度也存在差异,故本实验对两种不同方法和不同时间PCOS-IR动物模型各主要评价指标进行比较探讨。
研究结果显示,在造模第23天,来曲唑联合高脂饮食法和经典Poresky法联合高脂饮食基本能够诱导出PCOS-IR动物模型。在造模第30天,两种综合评价指标诱导PCOS-IR动物模型更接近PCOS临床特征,出现排卵障碍、LH、FSH升高。与经典Poresky法相比,虽然来曲唑组大鼠血脂TC水平无显著变化,但体重明显增加,并出现显著的排卵障碍,无偶发排卵现象,卵巢多囊性改变明显,性激素分泌更加紊乱,伴高雄激素血症。因此,来曲唑造模联合高脂饲料法在第30天更加符合临床肥胖型PCOS-IR特征。相比前人的研究,进一步丰富了肥胖型PCOS-IR动物造模方法的评价及选择,为后续药物研究模型的选择上提供更加有效的参考。
由于PCOS患者处于长期的慢性低度炎症状态,炎症反应目前被认为是PCOS性激素失衡和胰岛素抵抗的关键环节,体内升高的促炎性因子(TNF-α和IL-1β等)可进一步加剧胰岛素抵抗,加重代谢紊乱和卵巢功能障碍,形成恶性循环[16-17]。临床研究显示,相比非肥胖型PCOS-IR患者,肥胖型PCOS-IR患者体内炎性因子TNF-α和IL-1β等显著升高[18-19]。因此,本实验对各组大鼠血清中TNF-α和IL-1β的含量和卵巢中TNF-α和IL-1β mRNA表达进行了检测,发现这些炎症因子水平均明显升高,这与临床报道一致。该实验通过对不同PCOS-IR动物模型的筛选与炎症机制的初探,为后续临床诊断和药物开发奠定良好的实验基础。

