预电针对阿尔茨海默病样病理大鼠早期病理及认知功能的影响*
余超超,孔立红,杜艳军,王雪松,郑 清,王 丽,林远方△
(1.深圳市中医院,广东 深圳 518000;2.广州中医药大学第四临床医学院,广东 深圳 518000;3.湖北中医药大学,湖北 武汉 430061;4.针灸治未病湖北省协同创新中心,湖北 武汉 430061)
中国人口老龄化已进入高速发展期,呈现“低起点-高增长”模式特点[1]。据2019年国家统计局数据显示,我国65周岁以上人口已突破2.5亿,占总人口比重的18.1%[2]。人口老龄化给我国公共医疗卫生带来极大挑战。衰老是多种神经退行性疾病如阿尔茨海默病(Alzheimer’s disease,AD)、帕金森病的高风险因素[3]。其中,AD是威胁老年人群健康的主要疾病之一。AD的高致残率、高医疗成本及家庭负担使得探索、开发有效的AD防治策略成为业界关注的焦点。虽然国家药监局有条件批准甘露特纳胶囊用于治疗轻、中度AD患者,但仍需进一步的实验和临床研究证明其长期安全性和有效性。由于AD发病隐匿、病情进展难以扭转,因此研究AD发病的早期病理靶点及早期防治策略具有重要的临床意义。一系列基础[4]和高质量临床研究[5]表明针灸可改善AD模型鼠及AD患者的认知障碍,表明针灸在防治AD中极具潜力。
AD的发病机制复杂,其主要病理特征包括老年斑沉积和tau蛋白过度磷酸化形成的神经原纤维缠结(Neurofibrilary tangles,NFTs)。占总数5%~10%的早发型AD与基因突变相关,而占总数90%~95%的晚发型AD与衰老异常密切相关[6]。研究证实,突触结构可塑性损伤是AD重要的早期病理改变之一[6-7]。众多研究亦证明中缝背核的NFTs沉积早于其他认知相关脑区,并可跨神经元向其他脑区扩散传播[8-9]。另外,中缝背核NFTs沉积与AD前期非记忆障碍相关症状如抑郁、情绪激惹和睡眠紊乱等症状密切相关[8]。因此,早期干预减轻突触结构可塑性损伤及中缝背核NFTs沉积病理可能有助于早期防治AD。本研究基于衰老与AD病理发生发展的高度相关性,以针灸“治未病”理论为指导,研究预电针对D-半乳糖诱导的AD样病理大鼠早期病理改变及认知功能的影响,以期为临床推广针灸防治AD提供实验依据。
1 材料与方法
1.1 动物
36只3月龄SPF级雄性Sprague Dawley大鼠,体质量(330±20)g,购于三峡大学实验动物中心,由湖北省疾病预防控制中心进行质量检测[合格证号:syxk(鄂)2017-0067]。实验动物自购入后于湖北中医药大学针灸研究所屏障环境动物房饲养,室温(20±2)℃、湿度50%±10%、12 h循环昼夜光照(8:00—20:00)。大鼠每4只合一笼饲养,自由进食及水。本实验通过湖北中医药大学实验动物伦理委员会审查(HUCMS201712001)。
1.2 主要试剂及仪器
1.2.1 试剂 D-半乳糖(Biosharp,BS022);兔单克隆PHF-1抗体(Abcam, ab184951);小鼠GSK-3β单克隆抗体(Abcam,ab93926);山羊抗小鼠IgG H&L(Cy3®);预吸附二抗(Abcam,ab970356);抗荧光淬灭剂封片剂(Thermo Fisher Scientific, P36961);DAPI(武汉碧云天生物技术有限公司,C1002);免疫组化试剂盒(中杉金桥,SPN-9001);FD快速高尔基染色试剂盒(FD Neuro Technologies, PK401)。
1.2.2 仪器 针灸针(北京中研太和医疗器械有限公司,0.22 mm×25 mm);韩式电针仪(北京华运安特科技有限公司,HANS-100A);Morris水迷宫视频追踪系统及分析软件(成都泰盟科技有限公司,Watermaze 2.0);透射电镜(FEI, Tecnai G2 20 TWIN);电子显微镜(Olympus,BX-53);激光共聚焦荧光显微镜(Leica,TCS SP8)。
1.3 实验分组及造模、针刺干预
采用随机数字表法将36只大鼠随机分为正常组、模型组和预电针组,每组12只。模型组及预电针组大鼠予D-半乳糖连续腹腔注射7周(剂量标准:120 mg·kg-1·d-1)[10],每周日重新称量体质量。预电针组大鼠自造模开始每日予电针治疗,腧穴选用百会、肾俞,取穴以“十三五”规划教材《实验针灸学》指定的《常用实验动物穴位定位图》为标准,选择0.22 mm×25 mm一次性不锈钢针灸针。百会穴向前平刺3~5 mm,肾俞穴向脊柱方向斜刺3~5 mm,接上HANS-200A型电针治疗仪。一对导线分别接百会和肾俞穴,左右侧肾俞隔日交替使用。选用连续波,频率50 Hz,电流1 mA,以穴位局部颤动为佳,留针20 min,每日1次,共治疗7周。正常组、模型组大鼠在预电针组干预时进行相同的抓取捆绑,1次/d,20 min/次,共计7周。
1.4 Morris水迷宫实验
Morris水迷宫实验实施操作同前[11]。记录各组大鼠定位航行实验中120 s内的逃避潜伏期及第5天的运动轨迹,以及空间探索实验中目标象限的探索时间,评价大鼠的空间学习记忆能力。
1.5 取材及石蜡切片制备
行为学实验结束后从各组随机选取3只大鼠,腹腔注射水合氯醛(400 mg/kg)麻醉,采用心脏灌流法灌注固定,取脑并置于4%多聚甲醛中4 ℃后固定72 h。经脱水、透明、透蜡和包埋、切片和贴片操作后制成脑石蜡切片。
1.6 透射电镜观察
从每组各随机选取3只大鼠,水合氯醛(400 mg/kg)麻醉,断头,于冰面上快速取出大脑并剥离海马。于左侧海马CA1区切取米粒样大小组织置于电镜固定液中,4 ℃冰箱固定3 d。之后行漂洗、1%锇酸后固定、脱水、浸透、包埋、切片和染色等处理制备电镜标本,透射电镜下观察海马CAI区突触后致密带厚度、突触间隙的变化。参照体视学方法测量突触后致密带厚度和突触间隙宽度,计算公式为τ=L/2(τ为PSD的平均厚度或突触间隙的平均宽度,L为正方格测试线与PSD或突触间隙相交所截取的截线的平均截距)[12]。
1.7 高尔基染色
另从每组各随机选取3只大鼠,水合氯醛(400 mg/kg)麻醉,断头,于冰面上快速取出大脑,参照试剂盒步骤进行树突棘染色。将各组大鼠脑组织置入A、B混合液中,室温下浸泡14 d,注意避光。后将脑组织置于试剂C中,室温浸泡4 d,注意避光。在-20 ℃条件下将海马切取为厚度150 μm的冰冻切片,避光晾干24 h。将试剂D、E和蒸馏水按5 mL∶5 mL∶15 mL的比例制成混合液,并将晾干的脑片置入混合液中15 min,蒸馏水漂洗3次,然后再依次进行脱水、二甲苯透明和树胶封片,室温晾干后于显微镜下观察海马CA1区树突棘、拍照,运用Image-Pro Plus 6.0计算树突棘密度。
1.8 免疫组化检测
从各组随机选取石蜡切片后,脱腊、微波热修复抗原、阻断内源性过氧化物酶、山羊血清(1∶9)37 ℃封闭1 h、4 ℃过夜孵育一抗PHF-1(1∶200)、孵育二抗生物素标记山羊抗兔IgG聚合物工作液(1∶100)、滴加辣根酶标记链霉卵白素工作液(1∶100)并37 ℃孵育30 min、DAB显色、苏木素复染及1%盐酸分化,最后脱水、透明、封片并采集图像,每张切片随机选取6个×400视野并用Image-Pro Plus 6.0软件分析光密度值。
1.9 免疫荧光检测
从各组随机选取石蜡切片后,脱腊、微波热修复抗原、山羊血清(1∶9)37 ℃封闭1 h、4 ℃过夜孵育荧光一抗GSK-3β(1∶200)、滴加荧光二抗Cy3(1∶700)并37 ℃孵育1 h、漂洗、DAPI染核、漂洗和滴加抗荧光淬灭剂封片,并采集图像,每张切片随机选取6个×400视野并计算分析阳性神经元率。
1.10 统计学处理
使用GraphPad 6软件进行统计分析,计量资料以均数±标准差表示,对符合正态分布的数据,组间比较采用单因素方差分析,组间多重比较采用LSD检验(方差齐时)或Dunnnett’s T3检验(方差不齐时);若不符合正态分布,组间比较采用秩和检验(Kruskal-Wallis)。以P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结果
2.1 大鼠一般情况
实验开始前各组大鼠毛色光白,进食量及活跃性正常。造模及干预结束后,除正常组大鼠外其余各组大鼠出现明显掉毛、毛色发黄粗糙且无光泽等衰老征像,且进食量和活跃性下降。
2.2 Morris水迷宫实验结果
定位航行实验的前2 d,各组大鼠主要围绕水池壁游泳,几乎不或很少接近平台。从第3天开始各组大鼠依靠空间标记线索的逃避潜伏期逐渐降低,并处于下降趋势,且其在目标象限的游泳轨迹也逐渐密集,或主要分布在与平台象限相邻的象限中。由图1、表1~2结果可知,模型组、预电针组大鼠的逃避潜伏期较正常组大鼠延长,差异具有统计学意义(P<0.01),目标象限停留时间较正常组缩短,差异具有统计学意义(P<0.01);与模型组比较,预电针组大鼠的逃避潜伏期显著缩短,差异具有统计学意义(P<0.01),目标象限停留时间显著延长,差异具有统计学意义(P<0.01)。

图1 Morris水迷宫实验中各组大鼠运动轨迹
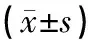
表1 干预结束后定位航行实验各组大鼠不同时间点逃避潜伏期比较
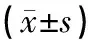
表2 干预结束后空间探索实验各组大鼠目标象限停留时间比较
2.3 透射电镜结果
由图2、表3可知,模型组海马CA1区突触后致密带厚度较正常组显著下降,差异具有统计学意义(P<0.01),预电针组和正常组大鼠海马CA1区突触后致密带厚度之间差异无统计学意义(P>0.05);与模型组比较,预电针组大鼠海马CA1区突触后致密带厚度显著升高,差异具有统计学意义(P<0.01)。各组大鼠海马CA1区突触间隙宽度比较差异无统计学意义(P>0.05)。
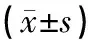
表3 干预结束后各组大鼠海马CA1区突触超微结构比较
2.4 高尔基染色结果
由图3、表4可知,模型组、预电针组大鼠海马CA1区树突棘密度较正常组显著下降,差异具有统计学意义(P<0.01或P<0.05);与模型组比较,预电针组大鼠海马CA1区树突棘密度显著升高,差异具有统计学意义(P<0.01)。
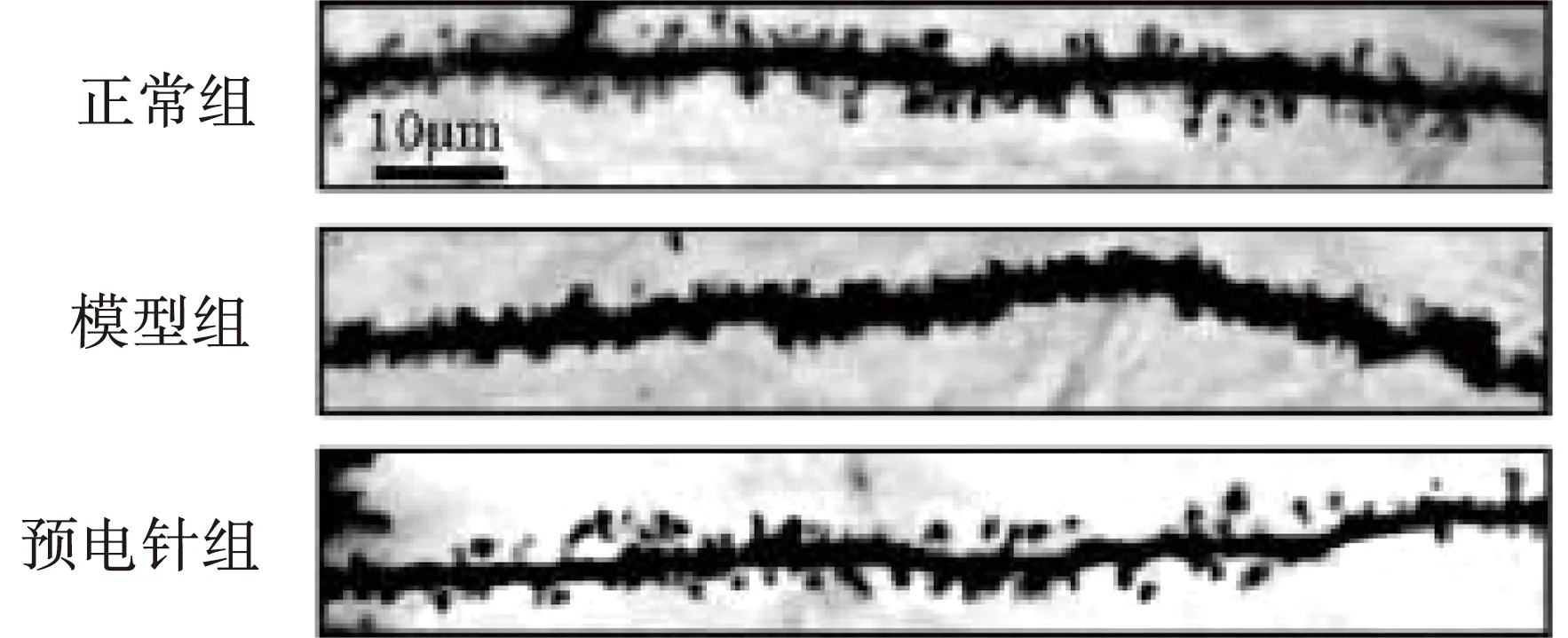
图3 各组大鼠海马CA1区树突棘密度比较
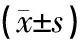
表4 干预结束后各组大鼠海马CA1区树突棘密度比较
2.5 免疫组化结果
由图4、表5可知,模型组、预电针组大鼠中缝背核区PHF-1表达水平较正常组显著升高,差异具有统计学意义(P<0.01);与模型组比较,预电针组大鼠中缝背核区PHF-1表达水平显著降低,差异具有统计学意义(P<0.01)。
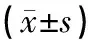
表5 干预结束后各组大鼠中缝背核区PHF-1相对表达量
2.6 免疫荧光结果
由图5、表6可知,模型组、预电针组大鼠中缝背核区GSK-3β表达水平较正常组升高,差异具有统计学意义(P<0.01或P<0.05);与模型组比较,预电针组大鼠中缝背核区GSK-3β表达水平显著降低,差异具有统计学意义(P<0.01)。
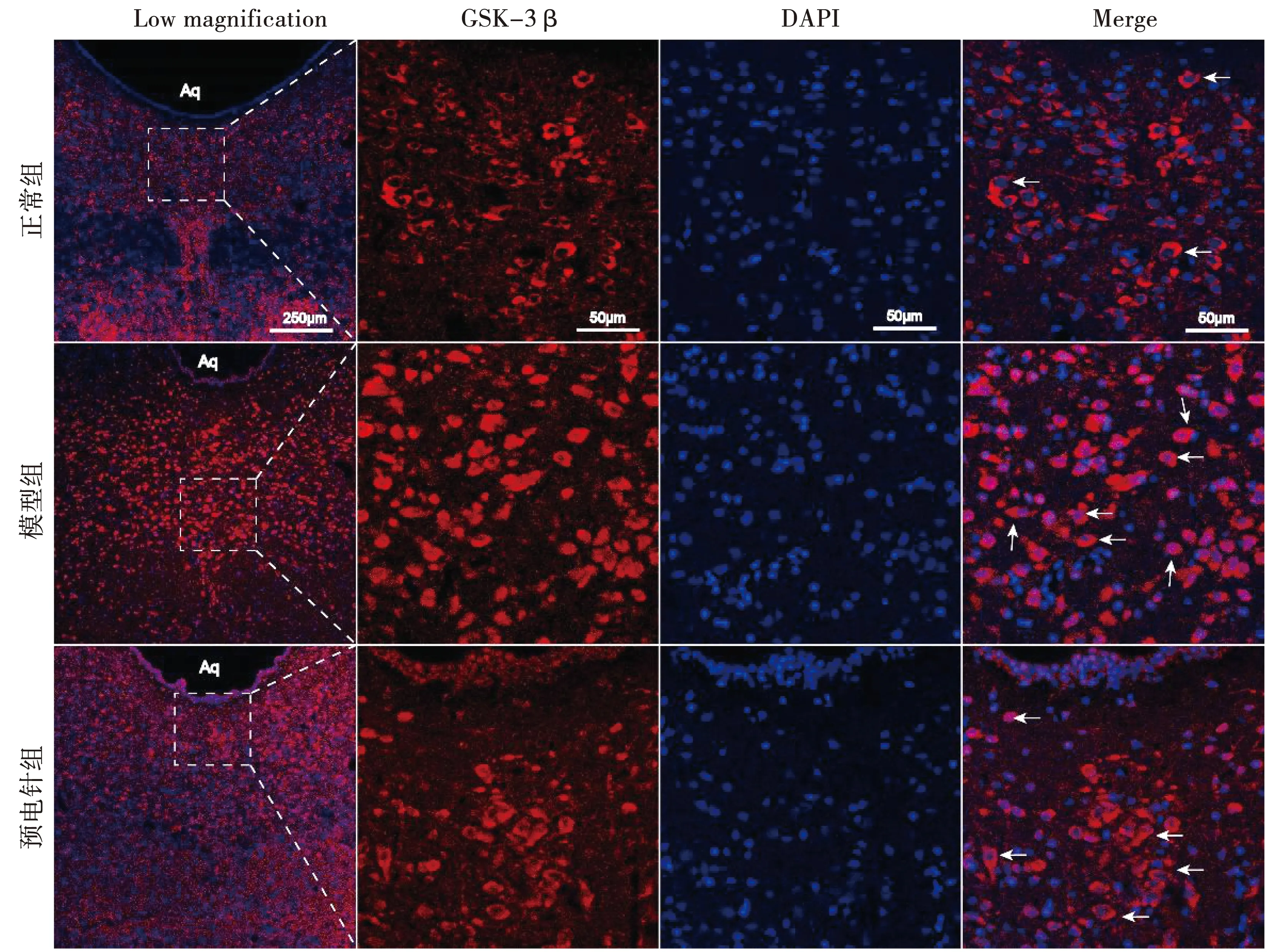
图5 各组大鼠中缝背核区GSK-3β表达水平(400×)
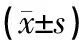
表6 干预结束后各组大鼠中缝背核区GSK-3β表达水平
3 讨论
本实验基于衰老与AD发病的高度相关性,研究预电针干预对D-半乳糖诱导的阿尔茨海默病样病理大鼠早期病理及认知功能的影响。本研究发现,D-半乳糖诱导的阿尔茨海默病样病理大鼠的空间学习记忆能力出现损伤,与前人研究结果相一致[13-14]。预电针干预能显著改善大鼠的空间学习记忆能力损伤,且与改善海马突触结构可塑性损伤、降低中缝背核区PHF-1和GSK-3β的表达水平有关。
突触后致密带厚度、突触间隙宽度、树突棘形态及密度等突触超微结构参数可反映突触传递效能的变化,是学习记忆和情感认知神经环路的结构基础[15-16]。研究发现,AD患者和AD模型鼠海马区的树突棘大量缺失[17-19],树突棘丢失抑制长时程增强(Long-term potentiation,LTP),造成突触可塑性损伤,从而引起学习记忆认知障碍。而当升高树突棘密度后能显著增强LTP,改善认知损伤[20-21]。突触后致密带是突触后膜电子密度增厚的区域,富含众多蛋白质如谷氨酸受体、N-甲基-D-门冬氨酸受体、黏附分子和相关信号分子蛋白等,这些突触后相关蛋白在介导信息传递、调控突触可塑性和维持突触功能稳态中具有重要作用[22]。另外,突触间隙变窄也有利于突触前膜释放的神经递质的传递。 AD早期即存在突触超微结构及功能的损害,包括突触后致密带厚度减小、树突形态简单化和树突棘密度降低等[23]。本研究发现D-半乳糖诱导的阿尔茨海默病样病理大鼠海马CA1树突棘密度和突触后致密带厚度显著降低,预电针早期干预可改善大鼠海马CA1去突触结构可塑性损伤,从而改善认知功能障碍。

注:A.正常组;B.模型组;C.预电针组。图4 各组大鼠中缝背核区PHF-1表达水平(400×)
中缝背核(Dorsal raphe nucleus,DRN)是位于脑干的异质性核团。DRN神经元的轴突可向内嗅皮层、前额叶皮层、海马、杏仁核和基底前脑等脑区投射,同时也可接受大脑皮层、基底前脑和边缘系统等脑区的投射。DRN神经元的这种投射特点使得DRN参与调控诸多功能,如学习记忆能力、情绪调控、感觉和运动调控、奖赏信号调控等[24]。近年来众多研究表明,DRN是AD NFTs病理沉积的早期脑区,同时与临床症状的进展加重密切相关[25-26]。AD前期的非症状如抑郁、焦虑、昼夜节律异常等与DRN神经元退变有关[27]。随着DRN中NFTs病理的进展,NFTs会跨神经元扩散到与DRN间有神经投射联系的其他脑区[9]。因此,抑制DRN区NFTs的病理沉积可能是早期防治AD的途径之一。
双螺旋细丝(Paired helical filaments,PHFs)由过度磷酸化的tau蛋白形成,是构成NFTs的主要成分[28]。一系列研究证明PHFs和NFTs有着相同的抗原决定部位[29-30],PHF-1可识别tau-Ser396/404磷酸化位点。Tau蛋白异常过度磷酸化会导致微管的解崩,引起轴浆运输障碍,从而影响神经递质的合成、运输、释放和摄取等,进而导致突触可塑性损伤和神经退行性病变[31]。糖原合酶激酶3β(Glycogen synthase kinase 3β,GSK-3β)是调控tau蛋白磷酸化的主要蛋白激酶[32]。研究发现,当激活GSK-3β后可导致海马区tau蛋白过度磷酸化,同时引起突触传递减弱、海马CA3区树突棘密度和蘑菇型树突棘数量降低以及PSD95、synapsin I和NR2A/B等突触相关蛋白水平降低,大鼠出现空间学习记忆障碍[33]。前人研究发现,长期腹腔注射高浓度D-半乳糖可导致海马区GSK-3β表达水平及tau蛋白磷酸化水平升高[10]。本研究发现中缝背核区GSK-3β表达水平亦升高,且预电针能够抑制其表达。笔者前期研究亦发现50 Hz高频电针可抑制Aβ1-42诱导的AD模型大鼠海马区GSK-3β的表达,从而改善大鼠的认知障碍[11, 34-35]。
针灸“治未病”是中医“治未病”理论体系的重要组成部分。《素问·四气调神大论》记载:“是故圣人不治已病治未病,不治已乱治未乱。”《灵枢·八正神明论篇》道:“上工救其萌芽。”强调中医“治未病”在防病保健中的关键作用。《灵枢·逆顺》曰:“上工刺其未生者也;其次,刺其未盛者也;其次,刺其已衰者也。”体现了“未病先防”的针灸“治未病”思想内核。《针灸聚英》亦载:“无病而先针灸曰逆。逆,未至而迎之也”,是“未病先防”理念指导下针灸“治未病”的重要体现。人至老年,肾气渐衰,肾精亏于下,髓海失于充养。髓海不得充,脑失濡养则萎,继而元神失养,痴呆渐成,说明肾精亏虚是老年痴呆发病的关键病机。基于大样本、多中心的老年痴呆人群的中医证候学研究表明,肾虚髓亏是老年痴呆的主要证候类型[36]。因此,补肾益精生髓亦是中医治疗老年痴呆的主要治疗原则[37-38]。百会归督脉,居头之巅顶,为“三阳五会”之所。肾俞属足太阳膀胱经,膀胱经“从巅入络脑”。《灵枢·本神》曰:“肾藏精,精舍志。”肾主骨生髓,通于脑窍。督脉为“阳脉之海”“入属于脑”“贯脊属肾”。《医学衷中参西录》记载:“脑为髓海,究其本源,是由肾中真阴真阳之气,蕴酿化合而成,缘督脉上升而贯注于脑。” 因此,本研究选取百会、肾俞穴于衰老进程中进行预针刺干预,二穴相配,共奏益肾调督、生髓充脑和益智开窍之效。
其他学者发现,早期预电针百会、大椎和肾俞穴可降低海马tau蛋白磷酸化水平并改善SAMP8小鼠的学习记忆能力[39]。本研究发现预电针能够改善D-半乳糖诱导的AD样病理大鼠的认知损伤,在另一动物模型中验证了预电针防治AD认知障碍的疗效。然而本研究尚有以下不足。第一,本研究发现预电针可降低AD样病理大鼠中缝背核PHF-1水平,且与抑制GSK-3β有关,但未对其他调控tau蛋白磷酸化的关键酶如CDK5、ERK1/2、P38 MAPK信号通路及PKA信号通路[40]进行研究,有待进一步拓展深入研究;第二,本研究未对中缝背核-海马神经环路异常在导致AD突触可塑性损伤、NFTs沉积等早期病理中的作用及预电针的干预效应进行研究。在未来研究中,应考虑应用化学遗传学技术深入研究预电针对中缝背核-海马神经环路的影响。
综上,通过抑制中缝背核GSK-3β表达、降低PHF-1水平和改善突触超微结构可塑性损伤可能是预电针早期干预防治AD样病理大鼠认知损伤的作用机制。

