从趋化因子调节疼痛视角探讨针刺镇痛新机制*
刘兴星,尚秀葵,苑功名,杨 蓝,李 威,李艳伟,郭永明,,徐 媛,△
(1.天津中医药大学实验针灸研究中心,天津 301617;2.天津中医药大学,天津 301617)
疼痛,是一种以损害健康为主伴随一系列经济和社会问题的疾病或者疾病的伴随症状,已成为患者就医的主要原因之一,严重影响患者的生活质量[1],且目前对于疼痛的发病机制仍不十分清楚,给临床治疗带来极大挑战。普遍认为,疼痛与神经系统关系密切:有害刺激作用于疼痛受体后转换为电信号,这种冲动信号由神经纤维传导至脊髓,然后传导至大脑产生疼痛感觉[2],因此外周神经、脊髓和脑各环节都可对疼痛信号进行调节;随着对神经-免疫认识的不断深入,研究发现免疫细胞与神经元存在交互作用,其可增强神经元的兴奋性或激活的胶质细胞介导的炎症反应导致疼痛[3-4]。尤其是近年来发现的趋化因子,其与神经、免疫系统均密切相关,在疼痛调节中发挥重要作用,成为疼痛的研究热点[5]。针刺镇痛疗效确切,对多种疼痛性疾病具有治疗作用,如神经痛、炎性痛和癌痛等[6-9]。随着研究不断深入,针刺镇痛机制也在不断更新完善中;如经典阿片肽机制、腺苷机制和香草酸瞬时受体1(Transient receptor potential vanilloid 1,TRPV1)机制[10-12]。近年来,不断有研究发现趋化因子参与针刺镇痛作用,本研究通过对趋化因子参与疼痛调节及趋化因子介导针刺镇痛的相关研究进行综述,提出趋化因子介导针刺镇痛的作用机制,为针刺镇痛机制提供最新的科学依据。
1 趋化因子及受体
趋化因子是由小分子蛋白组成的一个家族,其相对分子质量约为 8~14 kDa,因最初发现其具有刺激细胞迁移的能力,命名为趋化因子。从20世纪80年代开始趋化因子陆续被发现,1988年Valente AJ等发现第一个趋化因子CC配体2[The chemokine (CC motif) ligand 2,CCL2]以来[13],趋化因子及其受体的结构、功能及在体内的作用已经成为众多学者研究的热点。目前已经发现的趋化因子约有50余种,根据参与其分子构成的半胱氨酸数目及结构,可分为CC、CXC、CCL和CX3C共4种类型。趋化因子通过配体与受体结合的方式发挥其功能,目前已经发现的趋化因子受体有近20种,分为CR、CCR、CXCR和CX3CR共4种类型[14]。最初人们对趋化因子的认识,仅仅停留在白细胞趋化性这一方面,随着研究不断深入,发现趋化因子的作用并不单一,趋化因子对细胞增殖、分化、细胞因子分泌以及脱颗粒等多种功能都具有调控作用;同时发现神经元、胶质细胞表面均可表达趋化因子受体[15]。
2 趋化因子及受体与疼痛
2.1 趋化因子及受体导致疼痛
2.1.1 趋化因子及受体与神经元的作用 趋化因子及受体通过增加感觉神经元兴奋性,导致疼痛发生和发展。如Zhao等[16]研究发现趋化因子CCL2,促进背根神经节中神经元电压门控通道Nav1.8的磷酸化及其表达,诱导Nav1.8电流密度的升高,从而增加神经元兴奋性促进疼痛产生。Wu等[17]发现,由外周炎症上调的趋化因子CXC配体13[The chemokine (CXC motif) ligand 13,CXCL13]作用于背根神经节神经元上的趋化因子受体CXC受体5[The chemokine (CXC motif) receptor 5, CXCR5]并激活p38,从而增加与感觉神经元兴奋性密切相关的电压门控钠通道Nav1.8电流密度,维持炎性疼痛。Luo等[18]发现趋化因子CCL2通过增强细胞钠通道活性,从而增加初级感觉神经元的兴奋性,促进疼痛产生。
2.1.2 趋化因子及受体与神经元-胶质细胞相互作用 研究表明,疼痛状态下,神经元或胶质细胞释放趋化因子,趋化因子促使胶质细胞或神经元活化,从而产生致痛因子,这些致痛因子作用于感觉神经元,导致疼痛。具体表现为以下两方面:①神经元-星形胶质细胞交互作用,如Souza等[19]研究发现在炎症性疼痛中趋化因子CX3C配体1[The chemokine (CX3C motif) ligand 1,CX3CL1]激活背根神经节神经元周围的卫星神经胶质细胞,从而促进其释放肿瘤坏死因子-α(Tumor necrosis factorα,TNF-α)、白介素-1β(Interleukin-1β,IL-1β)和前列腺素并作用于神经元,产生炎性疼痛。Wu等[20]研究发现在脊神经结扎模型中,脊髓星形胶质细胞中趋化因子CXC配体10[The chemokine (CXC motif) ligand 13,CXCL10]表达增加,通过受体CXC受体3[The chemokine (CXC motif) receptor 3, CXCR3]诱导神经元细胞外信号调节激酶(Extracellular signal-regulated kinase,ERK)活化,并导致疼痛产生。Cao 等[21]研究发现在佐剂性关节炎小鼠中脊髓星形胶质细胞上调并释放趋化因子CXC配体1[The chemokine (CXC motif) ligand 1,CXCL1]作用于脊髓神经元CXC受体2[The chemokine (CXC motif) receptor 2, CXCR2],以增加脊髓背角神经元中的ERK激活、突触传递和COX-2表达,导致疼痛。Jiang等[22]研究显示脊髓神经结扎模型中脊髓神经元中CXCL13表达增加,并作用于CXCR5从而激活星形胶质细胞,促进神经病理性疼痛;单纯鞘内注射CXCL13也可引起星形胶质细胞活化并产生疼痛反应;给小鼠鞘内注射活化星形胶质细胞(由CXCL13体外激活)同样引起机械性异常性疼痛,说明神经元产生CXCL13激活星形胶质细胞是产生神经性疼痛的关键。②神经元-小胶质细胞交互作用,如Gu等[23]在周围神经损伤引起神经性疼痛的研究中发现趋化因子CX3CL1的受体CX3C受体1[The chemokine (CX3C motif) receptor 1, CX3CR1]与脊髓小胶质细胞增殖导致疼痛作用相关,在CX3CR1基因敲除的小鼠中小胶质细胞增殖减少,疼痛减弱。Pevida等[24]研究显示紫杉醇诱发的神经痛中,脊髓中CCL2蛋白水平和小胶质细胞水平都升高,给予CCL2或者小胶质细胞抑制剂均能抑制神经痛作用,说明紫杉醇诱发的神经痛与CCL2激活小胶质细胞相关。同样,Jin等[25]研究骨癌痛发现,脊髓CCL2与疼痛相关,通过抑制CCL2可减弱骨癌导致的疼痛,其机制可能为CCL2通过磷脂酰肌醇-3激酶/蛋白激酶B(phosphoinositide‐3‐kinase/protein kinase B,PI3K/Akt)途径激活脊髓小胶质细胞介导骨癌痛。Yan等[26]研究也得到相同的结论,在癌症诱导的骨痛模型中,CCL2上调脊髓小胶质细胞嘌呤受体P2X4(P2X4 receptor,P2X4R)的表达,通过PI3K / Akt途径介导脊髓小胶质细胞活化,诱发疼痛超敏反应。
2.1.3 趋化因子通过趋化免疫细胞产生致痛作用 于疼痛状态下,趋化因子通过募集淋巴细胞、中性粒细胞等免疫细胞到疼痛局部,释放炎性因子,促进疼痛产生。如Ceyhan等[27]发现在慢性胰腺炎患者中,CD45+淋巴细胞的浸润面积与趋化因子CX3CL1蛋白和mRNA表达均呈正相关,同时也与疼痛正相关,提示CX3CL1可能通过其受体CX3CR1作用于CD45+淋巴细胞参与内脏痛。Manjavachi 等[28]发现在小鼠的坐骨神经结扎所致的神经性疼痛模型中,坐骨神经中趋化因子CXCL1表达增加与疼痛相关;单独在坐骨神经中注射CXCL1可引起中性粒细胞向坐骨神经迁移,同时IL-1β、白介素-6(Interleukin-6,IL-6)等炎性因子水平也升高;将中性粒细胞耗竭后,则显著降低了CXCL1引起的机械性痛觉过敏,说明CXCL1募集中性粒细胞参与了坐骨神经结扎引起的神经痛。
2.2 趋化因子及受体的镇痛作用
自趋化因子被发现以来,一直被认为是致痛因子,然而近几年最新文献报道,某些趋化因子也具有镇痛作用。较早发现具有镇痛作用的趋化因子是CXCR2的配体CXCL2/CXCL3。Rittner 等[29]认为CXCR2的配体诱导了多形核粒细胞中Ca2+调节的阿片样物质释放,从而抑制了炎症性疼痛。随后Cao等[30]研究指出CXCL1在周围神经损伤引起的神经性疼痛中具有减轻伤害感受的作用,而其作用机制可能与CXCL1募集的中性粒细胞有关。Garcia-Dominguez等[31]关于趋化因子CCL4的研究发现,体外给予低剂量CC配体4[The chemokine (CCmotif) ligand 4,CCL4]能产生抗伤害镇痛作用,其作用机制可能与CCL4促进CD4+淋巴细胞释放脑腓肽有关。趋化因子CC配体5[The chemokine (CCL motif) ligand 5,CCL5]也具有相同的特性,Gonzalez-Rodriguez等[32]发现在小鼠足底内给予低剂量(3~10 ng) CCL5产生痛觉过敏,但在稍高的剂量(17~100 ng)下会激活代偿性抗伤害感受机制,这种机制也与阿片肽有关。从已有研究来看,趋化因子发挥镇痛作用的关键在于募集含有阿片肽类物质的免疫细胞。Guo等[33]研究发现,下行抑制系统延髓头端腹内侧核群(RVM)中趋化因子CCL4、CXCL1及其受体CXCR2参与了骨髓间充质干细胞(Bone Marrow Stromal Cells ,BMSCs)产生的抗伤害镇痛作用。
3 针刺通过趋化因子及其受体参与疼痛调节
针刺对体内多种趋化因子具有调节作用,如CCL2、CXC配体12[The chemokine (CXCL motif) ligand12,CXCL12]、CXCL10、CXC配体8[The chemokine (CXCL motif) ligand 8,CXCL8]、CC配体1[The chemokine (CCL motif) ligand 1,CCL1]等[34-41],近年来针刺通过趋化因子参与疼痛调节的研究受到广泛关注,研究表明针刺可通过调节趋化因子表达和募集免疫细胞释放阿片肽类物质产生镇痛作用:①针刺抑制致痛趋化因子的表达产生镇痛作用,如Gao等[42]在电针治疗大鼠颈部切口疼痛模型中发现,电针能够下调脊髓背角CX3CL1/ CX3CR1信号,减少神经元-小胶质细胞相互作用,达到镇痛的目的,同时Li C等发现CX3CR1与术后疼痛相关,Li等[43]也发现电针能够降低脊髓中CX3CL1从而抑制p38 MAPK激活,产生镇痛作用;Lee等[44]研究显示,坐骨神经结扎后,趋化因子CCL2、CCL4和CC配体20[The chemokine (CC motif) ligand 20,CCL20]通过JNK途径在脊髓星形胶质细胞中表达上调,促进神经病理性疼痛的发展,而电针能抑制CCL2、CCL4及CCL20的表达,抑制星形胶质细胞Jun-N端激酶(JNK)的激活而减轻神经病理性疼痛;②针刺通过上调趋化因子表达产生镇痛作用,如Xu等[45]研究发现针刺能有效的刺激血液中趋化因子参与免疫应答,增强机体整体免疫调节,缓解佐剂性关节炎大鼠的炎症和疼痛。Wang等[46]研究电针镇痛的机制中,发现CXCL10是电针镇痛的关键因子,针刺可增加炎症部位(足爪)CXCL10,向足爪部位募集含有阿片肽的巨噬细胞,释放阿片肽(与内啡肽、强啡肽和脑啡肽均有关),产生镇痛作用;而直接给予佐剂性关节炎大鼠局部注射CXCL10同样会触发阿片类药物介导的抗伤害镇痛作用并增加表达CXCR3(趋化因子CXCL10的受体)的巨噬细胞。由此,针刺可能通过趋化因子这一中间媒介与炎性细胞、因子产生联系,而发挥抗炎镇痛作用。针刺的镇痛作用是多维度的,同时镇痛机制也是多方面的,趋化因子在外周和中枢中均能发挥作用,可能成为阿片肽、腺苷和TRPV1等之外新的针刺镇痛机制。
4 小结
趋化因子在疼痛中发挥重要作用,而且具有双面性:既能发挥致痛作用,又发挥镇痛作用。其中致痛作用研究较多,其致痛作用机制主要有:①趋化因子直接激活神经元,促进外周与中枢敏化;②趋化因子介导的神经元-胶质细胞相互作用,神经元释放趋化因子,激活胶质细胞并释放伤害性介质,引起疼痛;③趋化因子募集免疫细胞释放炎性介质,产生疼痛。其镇痛作用机制主要是趋化因子募集含有阿片肽的免疫细胞释放阿片肽,缓解疼痛。另外趋化因子发挥致痛和镇痛作用机制还可能与其浓度有关,如CCL4低浓度发挥镇痛作用,高浓度发挥致痛作用,而CCL5正好相反,在低浓度发挥致痛作用,高浓度发挥镇痛作用,这种相反的机制还缺乏进一步的研究来找到一种普适性的规律。
在趋化因子介导针刺镇痛作用中,其机制可能与针刺降低致痛性趋化因子表达,减少神经元-胶质细胞相互作用,调节神经元的突触传递逆转中枢敏化,减轻伤害性刺激传导有关;或与针刺增加镇痛性趋化因子表达,募集免疫细胞到损伤局部,释放阿片肽,产生镇痛作用有关,如图1。由现有研究而言,镇痛作用机制主要是抑制疼痛信号传导,阻断疼痛产生,这种抑制作用可在外周到中枢脑的各级发生。趋化因子能够参与各级疼痛信号的传导,产生疼痛调节作用。在外周,趋化因子与感觉神经元的兴奋性相关,通过调节感觉神经元兴奋性而产生疼痛调节作用,如背根神经节中神经元的兴奋性。而在低级中枢脊髓部位,趋化因子调节疼痛作用则与神经元-胶质细胞相互作用密切相关,趋化因子与胶质细胞(小胶质细胞、星形胶质细胞)激活、疼痛信号神经传递密切相关。在高级中枢脑中,趋化因子与下行抑制系统的重要组成部分RVM相关,RVM接受伤害性信息传入,对伤害性信息进行调制,而趋化因子在RVM中介导了BMSC产生的抗伤害镇痛作用,说明趋化因子发挥镇痛作用可能与下行抑制系统相关。趋化因子能够在疼痛传导的各级层面调节疼痛信号,而针刺镇痛作用机制同样涉及到外周到中枢的各级层面,两者的广泛调节作用能够对应上,然而目前关于趋化因子介导针刺镇痛作用的研究还未涉及中枢大脑这一层面,针刺调节大脑中趋化因子镇痛可能作为针刺镇痛新的研究方向;同时趋化因子在外周以及低级中枢脊髓介导针刺镇痛的研究也并不详细,期待进一步的研究。虽然大量研究已经证实,趋化因子在疼痛中发挥重要作用,但是趋化因子还有许多待研究的地方,例如趋化因子在不同浓度下发挥不同作用(镇痛和致痛作用)的机制还不太清楚。综上所述,趋化因子介导针刺镇痛具有巨大的研究潜力,需要进一步的研究以逐渐完善趋化因子参与针刺镇痛机制,同时从新的科学角度阐释针刺镇痛机制,使得针刺镇痛机制进一步完善。
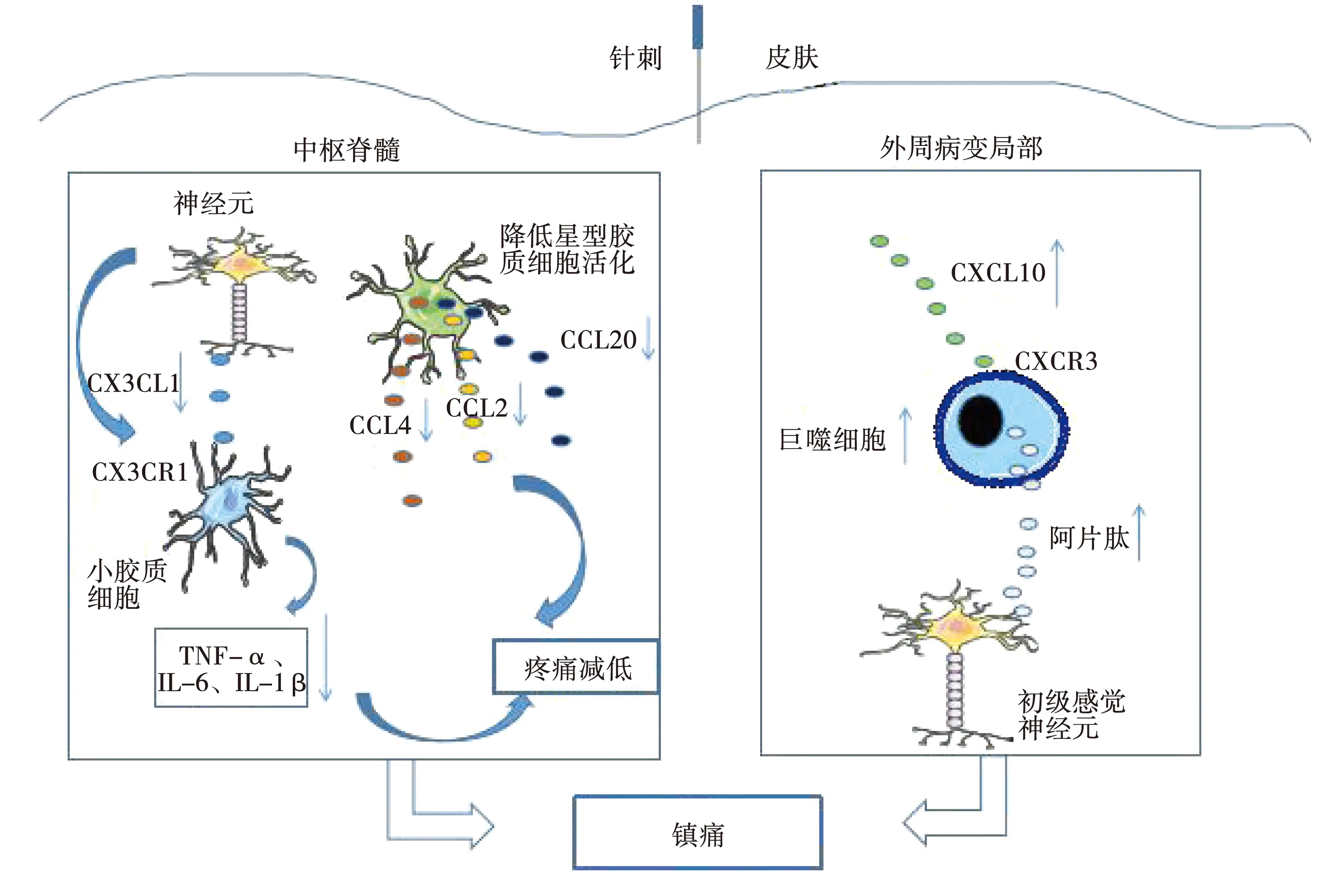
图1 趋化因子参与针刺镇痛机制图

