克氏原螯虾核糖体蛋白S24(RPS24)基因的克隆与表达分析
江红霞,李屹铮,张 冉,王 磊,张 猛,于 淼,乔志刚,李学军
(河南师范大学水产学院,水产动物疾病控制河南省工程实验室,河南省水产动物养殖工程技术研究中心,河南新乡 453007)
克氏原螯虾(Proambausclarkii),隶属于节肢动物门(Arthropoda)甲壳纲(Crustacea)十足目(Decapoda)螯虾科(Cambaridae)原螯虾属(Procambarus),是我国重要的淡水虾类养殖品种。克氏原螯虾整体产业在我国具有非常重要的经济地位,据中国渔业统计年鉴(2020)数据显示,2019年,全国克氏原螯虾养殖产量达到208.960 4万t,在淡水甲壳动物养殖中位居第一[1]。随着克氏原螯虾养殖规模的不断扩大,规模化养殖场需要在同一时期内提供规格整齐的苗种,因此,如何促进克氏原螯虾卵巢同步发育并提高其抱卵量已成为克氏原螯虾规模化养殖产业中重要的研究课题。
目前,在水产甲壳动物的规模化繁育中,广泛应用人工摘除雌性虾蟹的眼柄的方法来促进卵巢的同步发育、快速成熟并提高抱卵量。但眼柄摘除会使亲虾亲蟹的卵巢因失去性腺抑制激素的调控而始终处在旺盛的发育状态,后期卵巢发育成熟和排卵的速度过快,致使卵黄积累不足,卵子质量降低,生产的虾蟹苗容易死亡。同时眼柄摘除手术对亲虾亲蟹的损伤较大,死亡率也较高[2]。因此,寻找新的人工调控方法成为其规模化繁育中亟待解决的问题。
核糖体是有机体细胞中合成蛋白质的机器,而核糖体蛋白(ribosomal protein,RP)是组成核糖体的重要成分。但是合成蛋白质传递遗传信息并不是RP的唯一功能,它们还具有强大的核糖体外功能[3-6]。此外,许多研究发现RP还参与许多生物体卵巢的发育过程,例如,在海胆(Paracentrotuslividus)卵子发生过程中,核糖体蛋白S24(RPS24) mRNA表达量增加[7];核糖体蛋白L10a(RPL10a)和核糖体蛋白S3a(RPS3a)在墨吉明对虾(Fenneropenaeusmerguiensis)卵巢发育过程中起着刺激因子的作用[8-10];对虹鳟(Oncorhynchusmykiss)的研究表明RPL10a基因在虹鳟鱼染色质核仁期和周边核仁期的卵巢中高表达,证明该基因在虹鳟鱼卵巢发育的早期进程中起重要的作用[11];核糖体蛋白L24(RPL24)基因在日本囊对虾(Marsupenaeusjaponicas)所有器官中的表达量以在卵巢中为最高,表明RPL24在十足目甲壳动物的卵子发生和卵巢发育中也具有重要的作用[12]。
目前,有关克氏原螯虾卵巢发育和产卵的调控的研究已有不少报道[13-17],但有关核糖体蛋白在该虾卵巢发育过程中的调控作用的研究迄今为止尚未见报道。本研究从克氏原螯虾的卵巢中克隆得到一种核糖体蛋白S24(RPS24)基因的全长cDNA序列,命名为PcRPS24基因。对该基因的cDNA序列进行了生物信息学分析,并对该基因在克氏原螯虾的不同发育阶段、成虾的不同的组织和不同发育时期的卵巢中的表达模式进行了检测,以期为克氏原螯虾卵巢同步发育的调控研究提供一定的基础资料。
1 材料与方法
1.1 实验材料
试验用虾来自河南师范大学水产养殖基地,养殖水温20~25 ℃,每天早晚各投喂商品饲料1次,1周换水1次。采集克氏原螯虾不同发育阶段的样品,即无节幼体期、蚤状幼体期的受精卵,出膜后5 d和15 d的尚不能分辨雌雄的整只虾样品,出膜后30 d、60 d和100 d的能分辨雌雄的雌虾的头胸甲样品,以及卵巢发育至Ⅰ期的成年雌虾的头胸甲样品;卵巢发育处于Ⅰ期的成年雌性克氏原螯虾的不同组织样品,即卵巢、肝胰腺、心脏、胃、肠、脑、眼柄、肌肉、鳃和腹神经索共10种组织;以及成年雌虾的Ⅰ-Ⅵ期的不同发育阶段的卵巢样品(Ⅰ期:卵原细胞增殖期;Ⅱ期:卵黄发生前期;Ⅲ期:初级卵黄发生期;Ⅳ期:次级卵黄发生期;Ⅴ期:成熟期;Ⅵ期:恢复期)。每种试验样品采集6尾虾为1组,样品获得后立即放入RNAstore Reagent(天根,北京)中,并于-80 ℃冰箱保存,直到进行RNA的提取。
1.2 PcRPS24基因cDNA序列全长的获得
按试剂盒Total RNA kit Ⅱ(Omega公司)的说明书对克氏原螯虾卵巢组织提取总RNA。利用NanoDrop 2000c微量紫外分光光度计(Thermo,美国)测定RNA的浓度和纯度,并利用1.5%的琼脂糖凝胶电泳检测RNA完整性。然后按primeScriptTMRT Master Mix试剂盒(TaKaRa,大连)的说明书合成第一链cDNA。根据本实验室克氏原螯虾转录组测序中得到的PcRPS24基因片段设计中间片段引物:PcRPS24-F和PcRPS24-R(表1),以克氏原螯虾卵巢cDNA作为模板进行PCR扩增,获得PcRPS24基因的中间片段序列,PCR 反应程序为:94 ℃预变性2 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,36 个循环,终延伸72 ℃ 10 min。在已获得的中间片段序列的基础上设计3′ RACE和5′ RACE的特异性引物PcRPS24-3′-GSP和PcRPS24-5′-GSP(表1),采用SMARTer®RACE 5′/3′ Kit(Clontech公司)试剂盒,利用试剂盒中的通用引物(universal primer,UMP)和设计的3′ RACE和5′ RACE特异性引物分别扩增目的基因的3′和5′末端序列,反应程序按照试剂盒的说明书设定。PCR扩增产物回收纯化、连接转化后挑选阳性克隆送至上海英骏生物技术有限公司测序。将所获得的中间片段序列、3′和5′端序列拼接后获得PcRPS24基因cDNA全长序列。
1.3 序列对比分析
使用在线软件对PcRPS24进行序列分析,包括开放阅读框的预测(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)、蛋白的理论相对分子质量以及理论等电点的预测(http://web.expasy.org/compute_pi/)、蛋白的磷酸化位点预测(http://www.dabi.temple.edu/disphos/)和蛋白三维结构预测(https://swissmodel.expasy.org/interactive)等。应用ClustalX 2程序进行氨基酸多重序列比对(http://clustalw.ddbj.nig.ac.jp/),应用MEGA 5.0软件以邻接法构建系统进化树。
1.4 PcRPS24的mRNA表达模式分析
PcRPS24基因在克氏原螯虾不同发育时期、成虾的不同组织和不同发育阶段的卵巢中的表达模式利用实时荧光定量PCR(QPCR)法进行。首先按试剂盒Total RNA kit Ⅱ(Omega公司)的说明书对克氏原螯虾的不同样品提取总RNA。RNA的浓度、纯度和完整性的检测同1.2。使用PrimeScript®RT reagent Kit with gDNA Eraser(TaKaRa,大连)试剂盒对组织的总RNA进行反转录。依据已克隆的PcRPS24基因cDNA全长序列设计荧光定量引物PcRPS24-qf和PcRPS24-qr,以18S-RNA为内参基因(表1)。使用CFX96 实时荧光 PCR检测系统(Bio-Rad,USA)和SYBR®Premix Ex TaqTMII(TaKaRa,大连)试剂进行QPCR,反应体系(25 μL):SYBR®Premix Ex Taq II 12.5 μL,上、下游引物各1.0 μL,cDNA模板2.0 μL,ddH2O 8.5 μL;反应程序:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,共40个循环。每个样本设置3个重复,依据2-ΔΔCt法分析实验样本PcRPS24的相对表达量,SPSS 20.0软件One-Way ANOVA统计分析所得的数据,进行LSD和Duncan氏比较,以P<0.05作为具有显著性差异,结果用平均值±标准误(mean±SE)表示。
2 结果
2.1 PcRPS24基因cDNA全长和氨基酸序列分析
所克隆序列经测序和拼接,结果显示PcRPS24基因cDNA序列全长438 bp,其中5′非编码区长15 bp,3′非编码区长60 bp,poly(A)尾前有1个加尾序列AATAAA。该基因开放阅读框408 bp,编码136个氨基酸,推导的蛋白分子质量为15.686 ku,理论等电点为10.61,分子式为C695H1172N210O189S6,富含赖氨酸(Lys,17.6%)、甘氨酸(Ala,10.3%)、天冬氨酸(Arg,10.3%)和苏氨酸(Thr,10.3%),含量最低的为半胱氨酸(Cys,0.7%)和组氨酸(His,0.7%)。另外,在该氨基酸序列上预测到有11个磷酸化位点,为1个丝氨酸(Ser)和10个苏氨酸(Thr)(图1),另外还有一个RPS24e 标志序列。
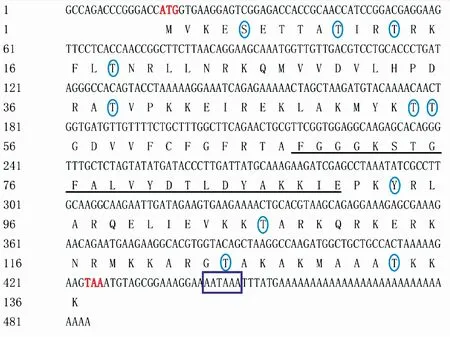
图1 PcRPS24基因全长cDNA序列和氨基酸序列分析Fig.1 Sequence analysis of the full-length cDNA and amino acid of PcRPS24ORF区的起始密码子(ATG)和终止密码子(TAA)用红色标注,椭圆形内为预测的磷酸化位点,下划线部分为RPS24e 标志序列,长方形框内为poly A加尾信号(AATAAA)
2.2 PcRPS24氨基酸序列同源性比较及系统进化分析
利用NCBI BLASTP软件,将克氏原螯虾与其他已知动物的RPS24氨基酸序列进行同源性比对。结果显示克氏原螯虾与其他已知动物的RPS24氨基酸序列相似性在72%~80%,其中与脊椎动物硬骨鱼纲的八棘多刺鱼的相似性最高,为79.84%,其次为黄鳍棘鲷和虹鳟,相似性均为79.07%,与无脊椎毛颚动物头翼锄虫的相似性最低,为72.41%(表2)。利用Expasy 在线软件预测了PcRPS24蛋白的三维结构,该蛋白具有5个α-螺旋和4个β-折叠结构(图2)。使用Clustal X2将克氏原螯虾与其他已知节肢动物的RPS24氨基酸序列进行多重比对,发现所有已知节肢动物的RPS24均具有5个α-螺旋区和4个β-折叠区,以及一个RPS24e标志序列,其氨基酸序列结构见图3。利用MEGA 5.0构建系统进化树,RPS24进化分析发现,进化树分为两大支,脊椎动物聚为一支,无脊椎动物聚为一支,克氏原螯虾的RPS24与无脊椎动物昆虫纲动物的RPS24聚为一支,亲缘关系最近,而与陆生脊椎动物的亲缘关系最远(图4)。
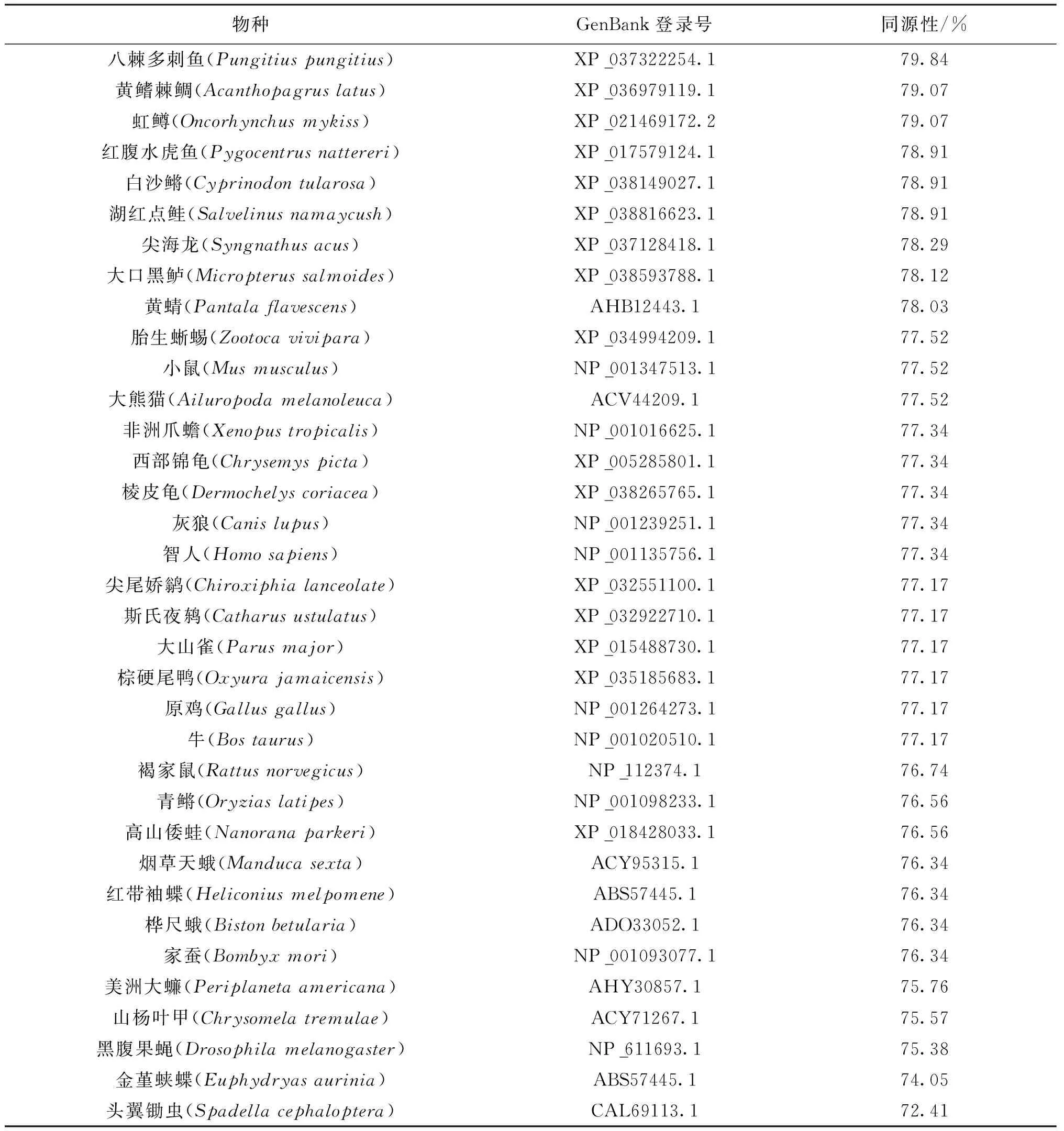
表2 克氏原螯虾与其他动物的RPS24氨基酸序列的同源性比对Tab.2 Comparative identity of amino acid sequence of RPS24 between P.clarkii and other animals
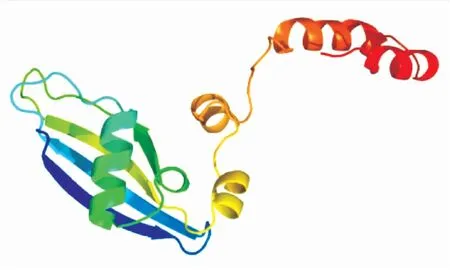
图2 预测的PcRPS24蛋白三维结构图Fig.2 The predicred three-dimensiona structure of PcRPS24
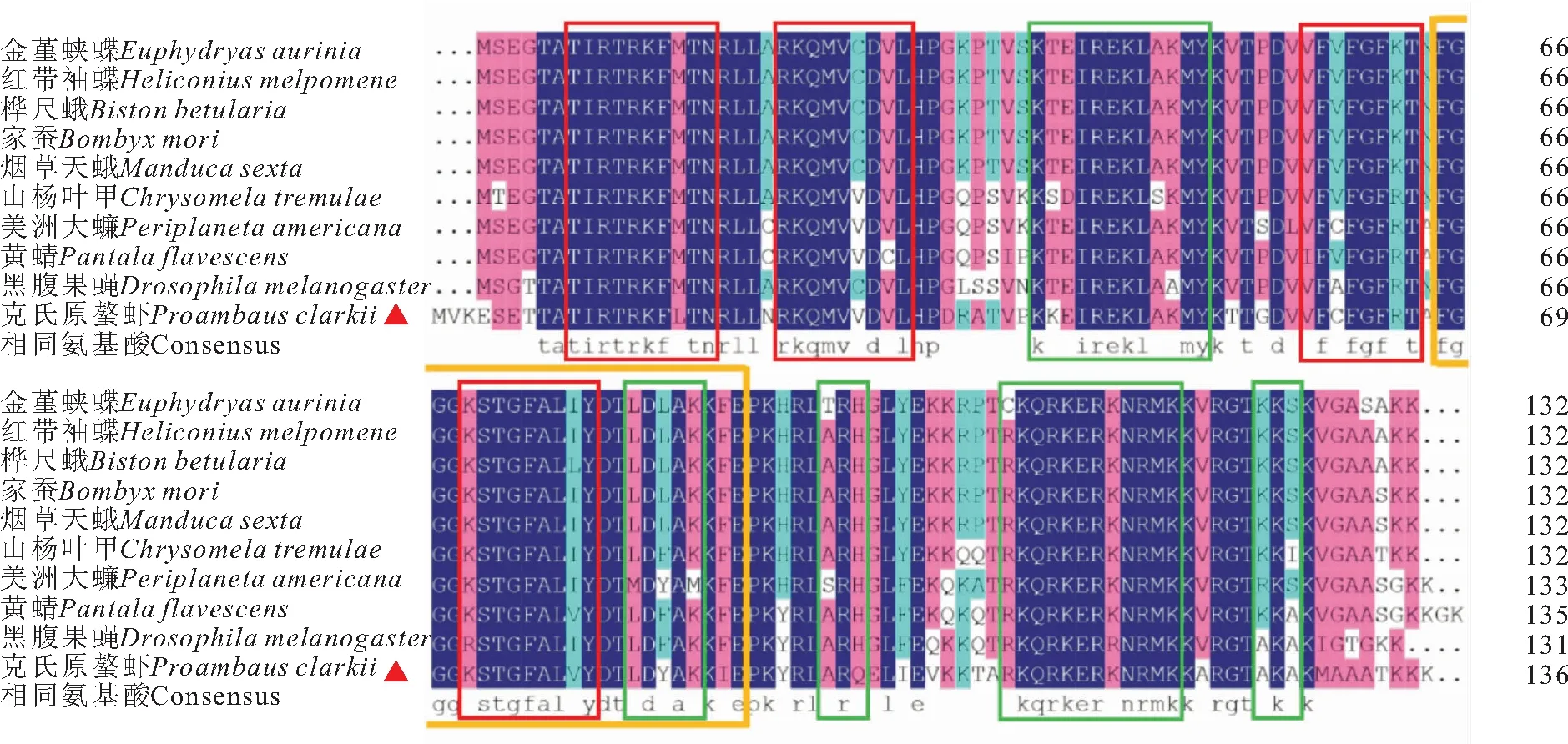
图3 克氏原螯虾RPS24与其他节肢动物RPS24氨基酸序列比对Fig.3 Alignment of RPS24 in P.clarkii with those of other known arthropodas使用Clustal X进行多重序列比对,绿色框内为α-螺旋区,红色框内为β-折叠区,桔色框内为RPS24e 标志序列
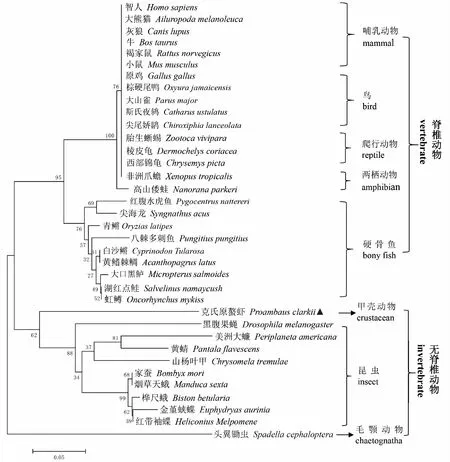
图4 基于RPS24氨基酸序列的系统进化树(Neighbor-Joining 法)Fig.4 Phylogenetic tree based on amino acid sequences of RPS24(Neighbor-Joining method)线的长度与遗传距离成正比,克氏原螯虾用“▲”表示
2.3 PcRPS24 基因在克氏原螯虾不同发育时期的表达模式
PcRPS24基因在克氏原螯虾不同发育时期的表达模式如图5所示。从无节幼体期开始PcRPS24基因的表达水平逐渐升高,在出膜后30 d时与在出膜后15 d时相比略微下降,然后又继续升高,在卵巢发育至Ⅰ期的成虾时达到最大值。卵巢发育至Ⅰ期的成虾时和出膜后100 d时的PcRPS24基因表达水平无显著差异,但均显著高于无节幼体期、溞状幼体期、出膜后5、15、30和60 d时的表达水平。
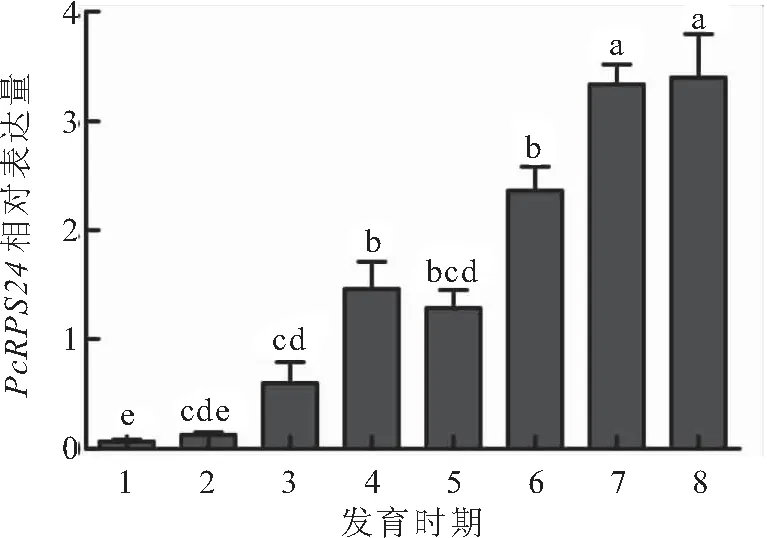
图5 PcRPS24基因在克氏原螯虾不同发育时期的表达模式Fig.5 Expression pattern of PcRPS24 gene in the development period of P.clarkii1.无节幼体;2.溞状幼体;3.出膜后5 d;4.出膜后15 d;5.出膜后30 d;6.出膜后60 d;7.出膜后100 d;8.卵巢发育至Ⅰ期的成虾。不同小写字母表示差异显著(P<0.05)
2.4 PcRPS24 基因的组织表达模式
PcRPS24 基因在成体克氏原螯虾不同组织中的表达模式见图6。结果显示PcRPS24基因在所检测的10个组织中均有表达,但在肝胰腺中的相对表达量最高,其次为卵巢、肌肉、鳃和脑,这五个组织中的PcRPS24 基因表达量没有显著差别。腹神经索中PcRPS24 基因表达量最低。PcRPS24在肝胰腺和卵巢中的基因表达量显著高于心脏、胃、肠、眼柄和腹神经索,心脏、胃、肠、眼柄和腹神经索这五个组织中的PcRPS24 基因表达量没有显著差别。
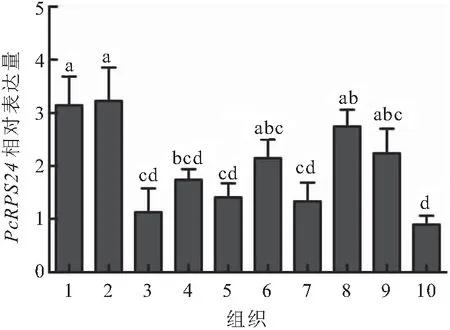
图6 PcRPS24基因在成年克氏原螯虾各组织中的表达模式Fig.6 Expression pattern of PcRPS24 gene in different tissues of adult P.clarkii1.卵巢;2.肝胰腺;3.心脏;4.胃;5.肠;6.脑;7.眼柄;8.肌肉;9.鳃;10.腹神经索。不同小写字母表示差异显著(P<0.05)
2.5 PcRPS24 基因在不同发育阶段的卵巢中的表达模式
在克氏原螯虾不同发育阶段的卵巢中均检测到PcRPS24基因的表达(图7),PcRPS24基因的表达量在Ⅰ期卵巢中最高,然后随着卵巢的发育先逐渐下降,在Ⅳ期卵巢中又升高,随后在Ⅴ期和Ⅵ期卵巢又下降,并在Ⅴ期卵巢中的表达量达到最低值。Ⅰ期卵巢中PcRPS24基因的表达量和Ⅱ期卵巢无显著差异,但显著高于Ⅲ、Ⅳ、Ⅴ和Ⅵ期卵巢中PcRPS24基因的表达量。
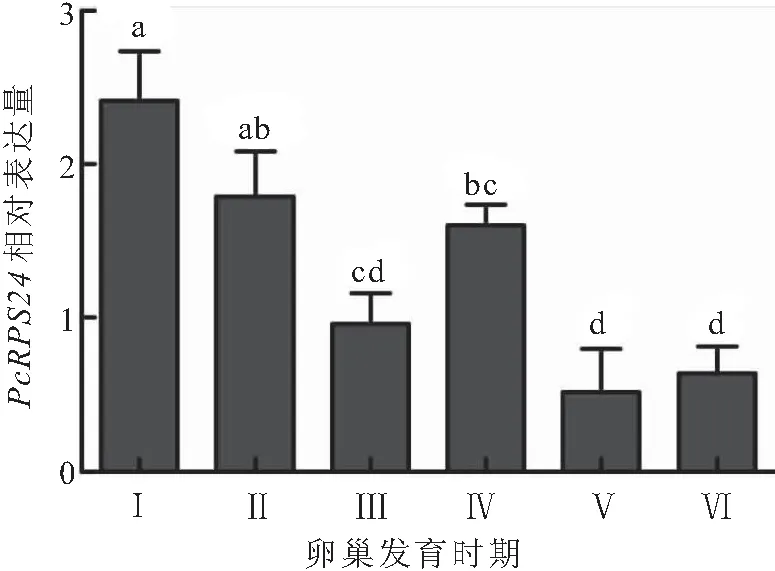
图7 PcRPS24基因在不同发育时期的卵巢中的表达模式Fig.7 Expression pattern of PcRPS24 gene in different ovarian stages of P.clarkiiⅠ~Ⅵ:Ⅰ~Ⅵ期卵巢;不同小写字母表示差异显著(P<0.05)
3 讨论
核糖体蛋白具有蛋白质合成功能之外的其他作用,即核糖体外作用[18]。RPS24为核糖体40S小亚基的一个组成部分,对于RPS24基因的研究,目前多集中在RPS24基因异常表达与哺乳动物DBA先天性再生障碍性贫血[19-21]及癌症发生[22-24]的关系方面,而RPS24 基因与生物体卵巢发育的关系的研究则十分有限[7]。
本研究克隆得到了RPS24 基因的cDNA 的全长序列PcRPS24基因。PcRPS24与其他已知节肢动物的RPS24氨基酸序列进行多重比对后发现,这些动物RPS24的氨基酸序列均具有5个α-螺旋区和4个β-折叠区,以及一个RPS24e 标志序列,说明节肢动物的RPS24蛋白可能具有相似的结构和功能。目前,已知动物的RPS24 mRNA前体可经选择性剪接产生4种转录本RPS24a、RPS24b、RPS24c和RPS24e,克氏原螯虾和已知的节肢动物的RPS24氨基酸序列上均具有一个RPS24e 标志序列,说明他们都应该属于RPS24e。RPS24系统进化分析发现,克氏原螯虾的RPS24与无脊椎动物昆虫纲的RPS24聚为一支,这与克氏原螯虾与昆虫动物都属于节肢动物门的分类地位是一致的。
在克氏原螯虾的发育过程中,本研究发现随着发育时间的延长,PcRPS24 基因的表达量有逐渐增加的趋势,并在卵巢发育至Ⅰ期的成虾时达到最大值。克氏原螯虾在出膜后30 d后可以分辨雌雄,本实验对雌虾发育的研究结果说明随着卵巢的分化和逐步发育,雌虾对PcRPS24蛋白的需要量是逐渐增加的。在雌性克氏原螯虾成虾的各组织中,PcRPS24在卵巢中的表达量也高于除了肝胰腺之外的其他8种组织,表明PcRPS24蛋白在克氏原螯虾的卵巢中可能起着重要的作用。
对PcRPS24基因在克氏原螯虾不同发育阶段的卵巢中的表达分析发现,该基因的表达量在Ⅰ期卵巢中最高,然后随着卵巢的发育逐渐下降,在Ⅳ期卵巢中又升高,随后又下降,并在Ⅴ期卵巢中达到最低值。卵巢的发育过程伴随着卵子的发生、发育和成熟。在克氏原螯虾Ⅰ期到Ⅱ期卵巢的发育中,其主要事件为卵原细胞分化为卵母细胞,在Ⅰ-Ⅲ期的卵巢中,伴随着卵原细胞分化为卵母细胞和卵母细胞的发育,PcRPS24的表达量逐渐下降。在Ⅳ期到Ⅴ期卵巢发育中,其主要事件为卵母细胞成熟分裂的启动,在Ⅳ期卵巢中,PcRPS24的表达量伴随着卵母细胞成熟分裂的启动突然增高,但在Ⅴ期和Ⅵ期卵巢中,伴随着卵子的成熟和排出,PcRPS24的表达量又逐渐下降,并在Ⅴ期卵巢中降至最低。据此推测PcRPS24在克氏原螯虾卵巢中的功能可能与卵原细胞分化为卵母细胞和卵母细胞成熟分裂的启动这两个关键点有关。由于该基因的表达量在Ⅰ期卵巢中最高,推测PcRPS24在早期卵巢发育过程中的卵原细胞的分化中可能起最重要的作用。Navakanitworakul等[8]在研究墨吉明对虾时发现,RPS3a基因在该虾卵巢发育的早期阶段表达量最高,然后随卵巢的发育是逐渐降低;Palasin等[9]的研究发现RPL10a蛋白能刺激墨吉明对虾早期卵巢的发育,但对晚期卵巢不起作用;这两项研究认为RPS3a和RPL10a这两种核糖体蛋白都在墨吉明对虾卵巢发育的早期阶段起重要的作用,可能是早期卵巢发育的刺激因子,这与本实验对PcRPS24的研究结果基本一致。然而,Sgroi等[7]在研究海胆卵子发生过程中,发现RPS24 mRNA 表达量随卵子的发育是逐渐增加的,这与本研究结果不一致,这可能与物种的不同有关,但由于RPS24在不同动物卵巢和卵子发育过程中的作用的研究非常有限,具体原因尚需进行大量的不同物种的比较研究才能进一步确定。
总之,本研究克隆获得了PcRPS24基因 cDNA 序列全长,通过生物信息学分析以及系统进化分析了解了该基因的序列特征和进化特点,通过荧光定量分析推测该基因的功能可能与克氏原螯虾卵原细胞的分化和卵母细胞成熟分裂的启动有关,并可能在克氏原螯虾卵巢早期发育阶段中起最重要的作用。

