lncRNA UCA1、VEGF、PKCα于肾上腺良恶性肿瘤中表达变化及与预后的关系
吴悠悠 任巧霞 徐柳汀
肾上腺肿瘤是常见泌尿外科肿瘤之一,具有良恶性之分,肾上腺恶性肿瘤具有远处转移、包膜浸润等多种生物学行为特点,受肾上腺组织学特性与解剖学特点影响,30%患者确诊时已出现远处转移,5年生存率仅约为44.0%,预后较差[1⁃2]。既往研究表明,长链非编码RNA(long non⁃coding RNA,lncRNA)在结直肠癌[3]、膀胱癌[4]等多种肿瘤组织中均过度上调,与肿瘤发生、发展密切相关,已成为新的肿瘤标志物的关注焦点,而尿路上皮相关基因(urothelial carcinoma antigen 1,UCA1)是与泌尿系统相关的lncRNA。血管内皮生长因子(vascular endothelial growth factor,VEGF)参与病理血管生成、新生血管重塑等过程,在肿瘤病理进程中起着重要作用。蛋白激酶Cα(Protein Kinase⁃α,PKCα)通过调控细胞增殖、分化、凋亡过程,参与肿瘤的形成、发生及发展。既往研究显示,lncRNA UCA1、VEGF、PKCα在肾上腺嗜铬细胞瘤的鉴别诊断中均起着十分重要的作用[5⁃6]。然而关于lncRNA UCA1、VEGF、PKCα同时在肾上腺良恶性肿瘤患者中表达及与预后的关系研究较少。本研究尝试探讨lncRNA UCA1、VEGF、PKCα于肾上腺良恶性肿瘤中表达变化及与预后的关系,旨在为临床诊治、预测预后提供循证支持。详情如下。
1 资料和方法
1.1 一般资料
选取2014年1月至2018年5月本院肾上腺恶性肿瘤患者74 例为恶性组、良性肿瘤患者31 例为良性组。纳入标准:①两组经手术病理组织学检查证实分别为恶性肾上腺嗜铬细胞瘤、良性肾上腺嗜铬细胞瘤;②术前均未接受放化疗、激素治疗;③研究对象均签署知情同意书;排除标准:①合并肝癌、脑胶质瘤等其他部位恶性肿瘤者;②合并全身感染性疾病或自身免疫系统疾病者;③严重心脑血管疾病者;④凝血机制紊乱或存在活动性出血倾向者;⑤伴有严重心理障碍或精神行为异常者。
1.2 方法
1.2.1 检测方法
所有行手术治疗切除的肾上腺良、恶性肿瘤患者入院手术时均留有病理组织(3 cm×3 cm),利用液氮迅速解冻组织,置于-80℃冰箱中待检。采用上海钦诚生物科技有限公司实时荧光定量逆转录聚合酶链反应法试剂盒测定组织中lncRNA UCA1、VEGF、PKCαmRNA 表达。
1.2.2 治疗方法
肾上腺肿瘤患者行腹腔镜手术治疗。肾上腺恶性肿瘤患者手术切除肿瘤后4 周实施辅助治疗或化疗。
1.2 统计学方法
采用统计学软件SPSS 22.0 处理数据,计量资料以(±s)描述,两组间比较采用独立样本t检验,多组间用方差分析;计数资料用n(%)表示、χ2检验;lncRNA UCA1、VEGF、PKCα相对表达量与恶性组病理特征的相关性分析采用Spearman 相关系数模型;lncRNA UCA1、VEGF、PKCα相对表达量对肾上腺恶性肿瘤的鉴别效能分析采用受试者工作特征(ROC)曲线;lncRNA UCA1、VEGF、PKCα相对表达量与肾上腺恶性肿瘤患者预后的关系采用卡普兰⁃迈耶曲线(KM)分析,组间比较采用Log⁃rank 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组lncRNA UCA1、VEGF、PKCα 相对表达量
恶性组lncRNA UCA1、VEGF、PKCαmRNA 表达水平高于良性组,差异有统计学意义(P<0.05)。见表1。
表1 两组lncRNA UCA1、VEGF、PKCα 表达量比较(±s)Table 1 lncrna UCA1,VEGF,PKCα in 2 groups α Comparison of relative expression(±s)

表1 两组lncRNA UCA1、VEGF、PKCα 表达量比较(±s)Table 1 lncrna UCA1,VEGF,PKCα in 2 groups α Comparison of relative expression(±s)
组别恶性组良性组t 值P 值n 74 31 lncRNA UCA1 5.49±1.40 3.27±1.02 7.977<0.001 VEGF mRNA 3.49±1.10 1.98±0.75 6.984<0.001 PKCα mRNA 1.23±0.36 0.89±0.20 4.940<0.001
2.2 lncRNA UCA1、VEGF、PKCα 之间相关性
经Pearson 相关性分析可知,lncRNA UCA1(r=0.621、0.578,P<0.001)与VEGF、PKCαmRNA均呈正相关性,VEGFmRNA(r=0.591,P<0.001)与PKCαmRNA 呈正相关性。
2.3 恶性组不同病理特征患者lncRNA UCA1、VEGF、PKCα 相对表达量
恶性组不同性别、年龄、肿瘤数目患者lncRNA UCA1、VEGF、PKCαmRNA比较,差异无统计学意义(P>0.05);恶性组不同肿瘤最大直径、T分期、分化程度、有无包膜浸润、远处转移患者lncRNA UCA1、VEGF、PKCαmRNA 比较,差异有统计学意义(P<0.05)。见表2。
表2 恶性组不同病理特征患者lncRNA UCA1、VEGF、PKCα 比较(±s)Table 2 lncRNA UCA1,VEGF and PKCα in patients with different pathological characteristics in malignant group α compare(±s)

表2 恶性组不同病理特征患者lncRNA UCA1、VEGF、PKCα 比较(±s)Table 2 lncRNA UCA1,VEGF and PKCα in patients with different pathological characteristics in malignant group α compare(±s)
病理特征性别n lncRNA UCA1 VEGF mRNA PKCα mRNA男女44 30 t/值P 值年龄(岁)<60≥60 t 值P 值肿瘤最大直径(cm)<5≥5 t 值P 值肿瘤数目单发多发t 值P 值T 分期T1期T2期T3+T4期F 值P 值分化程度高分化中分化低分化F 值P 值包膜浸润5.61±1.49 5.31±1.65 0.814 0.418 3.56±1.02 3.39±0.96 0.721 0.473 1.29±0.31 1.14±0.40 1.815 0.074 49 25 5.33±1.35 5.80±1.27 1.446 0.153 3.36±1.12 3.74±1.24 1.331 0.187 1.20±0.36 1.27±0.33 0.813 0.419 33 41 4.36±1.29 6.40±1.33 6.647<0.001 2.77±0.86 4.07±1.05 5.730<0.001 0.96±0.27 1.45±0.42 5.802<0.001 32 42 5.18±1.56 5.73±1.09 1.785 0.079 3.27±1.04 3.66±1.20 1.466 0.147 1.21±0.37 1.25±0.32 0.498 0.620 22 32 20 4.08±1.25 5.27±1.59 7.39±2.03 22.012<0.001 2.12±0.77 3.49±0.96 5.00±1.04 50.100<0.001 0.97±0.26 1.24±0.20 1.50±0.15 33.905<0.001 31 19 24 3.97±1.34 5.28±1.66 7.62±2.39 27.413<0.001 2.25±0.74 3.67±0.82 4.95±0.98 69.737<0.001 0.92±0.30 1.33±0.25 1.55±0.19 42.908<0.001有无35 39 t 值P 值远处转移6.32±1.42 4.75±1.17 5.211<0.001 4.76±0.92 2.35±0.73 12.543<0.001 1.49±0.38 1.00±0.27 6.444<0.001有无38 36 t 值P 值6.55±1.59 4.37±1.28 6.475<0.001 4.29±1.03 2.65±0.84 7.482<0.001 1.51±0.34 0.93±0.28 7.986<0.001
2.3 lncRNA UCA1、VEGF、PKCα 相对表达量与恶性组病理特征的相关性
经Spearman 相关性分析可知,lncRNA UCA1、VEGF、PKCαmRNA 与恶性组肿瘤最大直径、T 分期、包膜浸润、远处转移呈正相关性,与分化程度呈负相关性(P<0.05)。见表3。
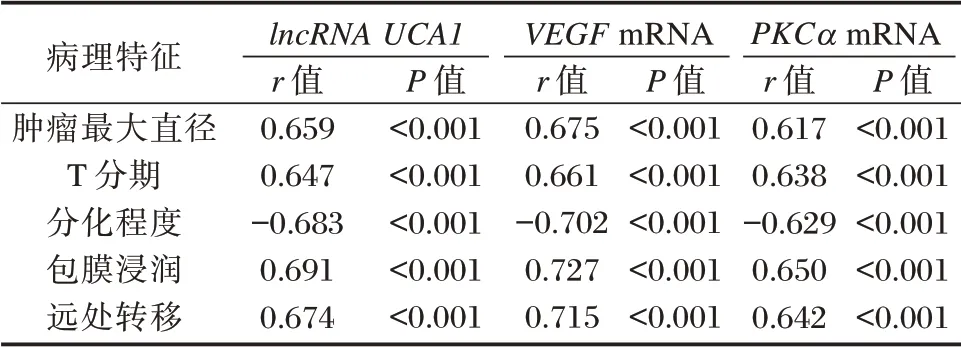
表3 lncRNA UCA1、VEGF、PKCα 相对表达量与恶性组病理特征的相关性Table 3 lncrna UCA1,VEGF,PKCα Correlation between relative expression and pathological features of malignant group
2.4 lncRNA UCA1、VEGF、PKCα 相对表达量对肾上腺恶性肿瘤的鉴别效能
绘制ROC 曲线,结果显示,lncRNA UCA1、VEGF、PKCαmRNA 及三者联合鉴别肾上腺恶性肿瘤的曲线下面积(AUC)分别为0.833、0.865、0.721、0.907。见图1。
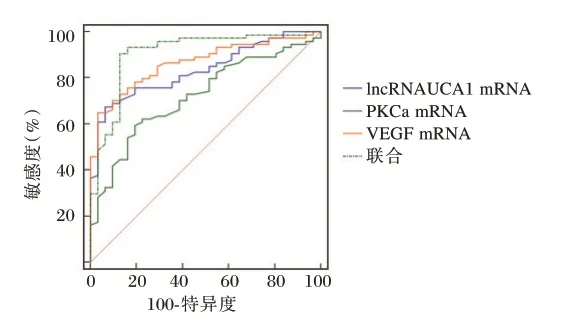
图1 ROC 曲线Figure 1 ROC curve
2.5 lncRNA UCA1、VEGF、PKCα 相对表达量与肾上腺恶性肿瘤患者预后的关系
以图4中lncRNA UCA1、VEGF、PKCαmRNA 最佳截断值为界限,将患者分为lncRNA UCA1低表达(≤4.55)、高表达(>4.55)、VEGFmRNA 低表达(≤3.19)、高表达(>3.19)和PKCαmRNA 低表达(≤1.07)、高表达(>1.07)患者。采用K⁃M法进行分析,显示lncRNA UCA1、VEGF、PKCαmRNA 高表达患者3年生存率低于低表达患者(χ2=4.638,P=0.031;χ2=4.728,P=0.039;χ2=7.050,P=0.008)。见图2。
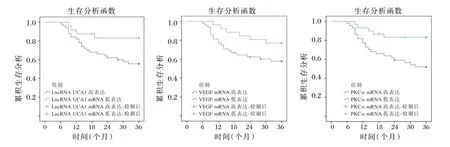
图2 lncRNA UCA1、VEGF、PKCα 相对表达量与肾上腺恶性肿瘤患者预后的关系Figure 2 lncRNA UCA1、VEGF、PKCα Relationship between relative expression and prognosis of patients with adrenal malignant tumor
3 讨论
lncRNA UCA1在肿瘤细胞增殖、转移、凋亡、新陈代谢、耐药等方面起着重要调控作用。孙青风等[7]通过52例肾上腺癌患者手术切除的肾上腺癌组织及配对癌旁组织标本表明,lncRNA UCA1在肾上腺癌组织中显著上调,其相对表达水平与肿瘤大小、转移和分期有关,这与本研究观点相似。推测lncRNA UCA1对肾上腺恶性肿瘤患者预后亦具有一定预测价值。
VEGF 主要产生于肿瘤自身分泌及其相关基质,可提高肿瘤血管渗透性,持续蓄积血浆蛋白外渗和纤维蛋白[8],大量研究已证实[9⁃10],新基质和新血管形成是肿瘤侵袭与转移的重要基础。本研究结果与贺亮亮[11]观点相似。说明VEGF 过度高表达可能参与肾上腺恶性肿瘤的发生、发展,推测VEGF 可能通过促进血管生成,提高血管壁渗透性,从而调控肿瘤细胞增殖、转移、浸润等。另外,杜学谦等[12]经COX 法分析可知,VEGF 高表达是影响肾上腺肿瘤患者不良预后的独立危险因素。本研究经K⁃M 曲线分析,肾上腺恶性肿瘤VEGFmRNA 高表达者3年生存率低于低表达者,提示VEGF 高表达可能预示肾上腺恶性肿瘤患者不良预后。
PKC 为G 蛋白和酪氨酸激酶介导的细胞信号传导途径中重要信号因子,可介导多种促癌基因信号,PKCα 是传统型PKC,在细胞恶性转化过程中扮演着重要角色[13]。本研究指出,PKCαmRNA 在肾上腺恶性肿瘤患者中呈异常高表达,并与肿瘤最大直径、T 分期、包膜浸润、远处转移、分化程度均存在一定相关性,结合张昊等[14]、姜媛等[15]研究考虑机制可能在于PKC 下游分子P38 信号通路活化,诱导基质金属蛋白酶⁃9 异常高表达,促进恶性肿瘤浸润与转移。推测抑制PKCα 表达可能成为一个潜在防治肾上腺恶性肿瘤的靶点。另外,本研究经Log⁃Rank 检验还发现,PKCαmRNA 高表达可能降低肾上腺恶性肿瘤患者3年生存率,这可能归因于PKCα 表达升高通过抑制细胞黏附连接,阻断9⁃4 整联蛋白介导的半桥粒形成,防止细胞基质连接,增强肿瘤细胞活性与侵袭力,诱导肿瘤迁移、侵袭,进而上调患者死亡风险。然而lncRNA UCA1、VEGF、PKCαmRNA 单一鉴别肾上腺恶性肿瘤存在一定局限性,敏感性较低,故本研究尝试绘制联合ROC 曲线,结果显示,lncRNA UCA1、VEGF、PKCαmRNA 联合鉴别肾上腺恶性肿瘤的AUC 优于上述指标单一鉴别,敏感性、特异性均有所提升。提示联合检测lncRNA UCA1、VEGF、PKCα 有助于提高鉴别效能。
综上所述,lncRNA UCA1、VEGF、PKCα 在肾上腺恶性肿瘤中呈高表达,联合检测可为临床鉴别肾上腺肿瘤良恶性、评估肿瘤恶性程度、预测预后提供科学指导。但本研究样本量小,lncRNA UCA1、VEGF、PKCα 能否成为肾上腺肿瘤治疗的靶位点,还需设计更为完善的实验方案深入分析上述指标对肾上腺肿瘤的调控机制。

