不同煎煮时间下10批三果汤散的HPLC指纹图谱研究
张艳娇 廖振中 林艾和 李蓉 黄宽 范源 朱培芳
【摘要】目的:对不同煎煮时间下的10批三果汤散进行指纹图谱分析,评价其相似性,为其质量控制及临床应用提供依据。方法:采用HPLC-DAD指纹图谱对煎煮时间为20、30、40、50min的10批三果汤散进行检测,采用《中药色谱指纹图谱相似度评价系统(2012版)》进行相似度评价,并采用SIMCA 14.1软件进行主成分分析(Principal Component Analysis,PCA)、有监督模式正交偏最小二乘法-判别分析(OPLS-DA)、Origin2019b软件进行聚类分析(Cluster Analysis,CA)。結果:通过指纹图谱对10批三果汤散分析发现,其共有14个分离度较好、峰面积较大的峰,经对照品指认出6个峰,分别是没食子酸(Galiic acid,GA)、柯里拉京(Corilagin)、诃黎勒酸(C heulagic acid,CHA)、1,2,3,4,6-O-五没食子酰葡萄糖(PGG)、诃子酸(Chebulinic acid,CHI)、鞣花酸(Ellagic acid,EA);不同煎煮时间下10批三果汤散的相似度评价结果都在0.9以上;CA、PCA分析发现可将不同煎煮时间下的10批三果汤聚为4类,CA可将6个化合物聚为2类,GA一类,其他5个化学成分一类,表明GA在三果汤散中的含量与其他成分存在较大差异。结论:传统的中药煎煮时间对药物的药效及性能存在着一定影响,本实验可以简便、快捷地判断出煎煮时间对香格里拉藏医院的10批三果汤散的影响总体差异不大,对三果汤散质量控制及临床应用都有重要意义。
【关键词】三果汤散;指纹图谱;煎煮时间;聚类分析;主成分分析
【中图分类号】R283.1【文献标志码】 A【文章编号】1007-8517(2021)18-0047-07
HPLC Fingerprint of 10 Batches of Triphala at Different Decocting TimeZHANG Yanjiao1LIAO Zhenzhong2LIN Aihe1LI Rong1HUANG Kuan1FAN Yuan1,3*ZHU Peifang1
1.Yunnan University of Chinese Medicine College of Traditional Chinese Medicine,Kunming 650500, China;
2.Tibetan Hospital of Diqing Tibetan Autonomous Prefecture of Yunnan,Diqing 674499,China;
3.Yunnan University of Chinese Medicine Second Affiliated Hospital,Kunming 650216,ChinaAbstract:Objective The fingerprints of 10 batches of Triphala with different decocting time were analyzed to evaluate its similarity and provide basis for its quality control and clinical application.Methods HPLC-DAD fingerprint was used to detect 10 batches of Triphala with decocting time of 20,30,40,50 min,and the similarity was evaluated by the Similarity Evaluation System of TCM Chromatographic Fingerprint (2012 edition),the Principal Component Analysis (PCA),supervised model of OPLS-DA of SIMCA 14.1,Cluster Analysis (CA) and Origin2019b were used to analyze the 10 batches of Triphala.Results Based on the fingerprint analysis of 10 batches of Triphala,it was found that there were 14 peaks with good resolution and large peak area,and 6 peaks were identified by the control sample,namely,Gallic acid (GA),Corilagin,Cheulagic acid (CHA),1,2,3,4,6-O-6-gallyl-glucose (PGG),Chebulinic acid (CHI),Ellagic acid (EA). The results showed that there were 14 peaks with good resolution and large peak area in 10 batches of Triphala,and 6 peaks were identified by the control sample. The similarity evaluation results of 10 batches of Triphala under different boiling time were all above 0.9. CA analysis showed that 10 batches of Triphala under different boiling time could be grouped into 4 groups,and 6 compounds could be grouped into 2 groups. The results showed that the content of GA in Triphala was quite different from that of other components.Conclusion The Traditional Chinese Medicine decocting time has some influence on the efficacy and performance of the medicine. This experiment can judge the influence of the decocting time on 10 batches of Triphala powder in Shangri-la Tibetan Hospital is not significantly different,which is of great significance to the quality control and clinical application of Triphala decoction.
Keywords:Triphala; Fingerprint; HPLC; Decocting Time; CA; PCA; Chemical Composition
三果汤散由余甘子(Phyllanthus emblica Linn.)、诃子(Terminalia chebula Retz.)和毛诃子[Terminalia bellirica (Gaertn.) Roxb.]三味药材磨成细粉,按比例为1∶1∶1组成,是藏医最常见的基础方,有研究表明[1]三种药物比例相等时,存在正相互作用,又称“哲布松汤”,在印度阿育吠陀医学中应用也较为广泛。三果汤散具有抗氧化[2]、抗红细胞增多症[3]、抗糖尿病[4]的作用;最新研究[6]表明三果汤具有调节肠道微生物[5]、治疗口腔疾病如牙周炎、抗微生物感染[7]、影响肿瘤血管生成[8]等作用。其中,酚酸鞣质类成分是三果汤的主要化学成分,较多研究者对其单一成分如没食子酸(Galiic acid,GA)进行质量控制研究,或者分别测定余甘子、诃子、毛诃子三种药物中GA的含量[9-11]。李斌等[12]对三果汤中的GA、柯里拉京(Corilagin)、鞣花酸(Ellagic acid,EA)进行含量测定,张海伟等[13]采用HPLC法对不同批次藏药三果汤中主要酚酸类成分GA、EA进行含量测定。目前相关报道对三果汤散质量控制研究都不全面,测定时因其特征成分不统一,专属性差,难以实现质量控制标准化[14]。故增加指标性成分检测及指纹图谱的建立可更好地为三果汤的质量控制研究提供依据。
传统中药的煎剂具有悠久的历史,现代中医临床仍应用广泛[15]。中药所含的化学成分会随煎煮时间不同发生变化,根据疾病的不同,中药的煎煮时间的确立具有重要意义。指纹图谱分析是近代药物尤其是组方中药用得最普遍的一种质控研究方法,其是评价中药质量一致性、真实性、产品稳定性的一种可行性模式分析[16]。本实验采用HPLC法指纹图谱结合化学模式分析不同煎煮时间下的10批三果汤散的稳定性,以期为三果汤散的质量控制研究及临床应用提供参考。
1实验材料
1.1仪器KDM调温电热套,常州国华电器有限公司;EYEL4型旋转蒸发仪,上海爱朗仪器有限公司;YL-080ST型超声清洗机,深圳市语路清洗设备有限公司;FA1004N型万分之一电子分析天平,上海菁海仪器有限公司;Agilent 1200 系列高效液相色谱仪(VWD紫外检测器),美国安捷伦公司。
1.2试药及试剂诃子酸(批号wkq20032707,含量≥98%;购于四川维克奇生物科技有限公司);诃黎勒酸(批号wkq20042206,含量≥98%;购于四川维克奇生物科技有限公司);1,2,3,4,6-O-五沒食子酰葡萄糖(批号14937-32-7,含量≥98%;购于成都普法瑞科技有限公司);没食子酸对照品(批号wkq16081904,含量≥98%;购于四川维克奇生物科技有限公司);柯里拉京对照品(批号wkq20032604,含量≥98%;购于四川维克奇生物科技有限公司);鞣花酸对照品(批号MO104AS,含量≥98%;购于美伦生物);纯净水(杭州娃哈哈集团有限公司),其余试剂均为分析纯;10批三果汤散由香格里拉藏医院制备,详细情况见表1。
2方法与结果
2.1溶液的制备
2.1.1混合对照品溶液的制备分别精密称取对照品GA、Corilagin、EA、CHI、CHA、PGG置于容量瓶中,用70%的甲醇溶解并定容至刻度,配置成浓度为0.43、0.32、0.23、0.58、0.23、0.58mg/mL的标准品溶液;取以上标准品溶液超声混匀,过0.45μm微孔滤膜,制备混合对照品溶液。
2.1.2样品溶液制备分别取10.0g不同批次的三果汤散,加入150mL水,浸泡30min,于电热套上回流加热20、30、40、50min,过滤,至旋转蒸发仪上旋干,温度为75℃,加入70%的甲醇30mL溶解样品,至于50mL离心管中,超声20min,离心3000r,离心5min,取上清液过0.45μ微孔滤膜,即得40个样品溶液。
2.1.3色谱条件采用Agilent ZORBAX SB-C18色谱柱(4.6mm×250mm,5μm),流动相为磷酸水溶液(A)-甲醇(B),梯度洗脱,检测波长273nm,柱温25℃,流速1.0mL/min。梯度见表2。表2洗脱程序时间/min甲醇/%0557103035404545
2.2方法学考察以样品S1为测试样品,按“3.1.2”煎煮30min,进行精密度、稳定性、重复性实验,考察该分析方法的可靠性。
2.2.1精密度实验取S1样品,按“3.1.2”煎煮30min处理样品,按“3.1.3”色谱条件连续进样6次,以4号峰(没食子酸)为参照峰,计算各色谱峰的相对保留时间和相对峰面积,结果14个共有峰的相对保留时间RSD小于0.2%,相对峰面积小于0.7%,表明仪器精密度良好。
2.2.2重复性实验取S1样品,按“3.1.2”煎煮30min,制备样品6份,按“3.1.3”色谱条件分别进样,以4号峰(没食子酸)为参照峰,计算各色谱峰的相对保留时间和相对峰面积,结果14个共有峰的相对保留时间RSD小于0.21%,相对峰面积RSD小于0.55%,表明样品重复性较好。
2.2.3稳定性实验取S1样品,按“3.1.2”煎煮30min制备样品,分别在0、2、4、6、8、10、12h进样,以4号峰(没食子酸)为参照峰,结果14个共有峰的相对保留时间RSD小于0.6%,相对峰面积RSD小于0.8%,表明稳定性较好。
2.3不同煎煮时间下10个批次的三果汤散指纹图谱结果分析
2.3.1相似度评价对不同批次的三果汤散进行指纹图谱分析,将图谱以“AIA”的格式导入“中药色谱指纹图谱相似度评价系统2012A(国家药典委员会)”软件,进行数据分析。以N1为参照图谱,时间窗宽度为0.1min采用多点校正进行全谱峰匹配。选择5min以后、文献报道较多的主要成分以及分离度较好的峰共14个共有峰。10批三果汤散指纹图谱匹配,计算相似度。见表3。
各批次的药物相似度都在0.9以上,说明该方剂品质均一稳定,差异不大,其中煎煮20、30min时都以S8的相似度最低,40、50min时以S7的最低,S1较好。
不同煎煮时间的三果汤对照图谱及叠加图谱如图1所示,其中N1~N10为煎煮20min,N11~N20为煎煮30min,N21~N30为煎煮40min,N31~N40为煎煮50min;混合对照品如图2所示,采用对照品指认了6个共有峰,分别是没食子酸酸(4)、柯里拉京(8)、诃黎勒酸(10)、1,2,3,4,6-O-五没食子酰葡萄糖(12)、诃子酸(13)、鞣花酸(14)。
2.3.2聚类分析将10批三果汤散样品的14个共有峰峰面积导入Origin2019b中的Cluster analysis中进行分析,CA显示可将样品分为四大类,N2、N6、N7、N8、N9、N10、N21、N22、N23、N28、N29、N32、N36、N37、N38、N39、N40共17个样品为第Ⅰ类,N13、N14、N15、N16、N17、N19、N20共7个样品为第Ⅱ类,N1、N3、N4、N5、N24、N25、N26、N27、N30、N31、N33、N34、N35共13个样品为第Ⅲ类,N11、N12、N18共3个样品为第Ⅳ类;如图3所示,其中从N1~N40为10批药材分别煎煮20~50min,按序排。
2.3.3主成分分析以14个共有峰为变量,将40个样品导入SIMCA-P 14.1 软件进行主成分(principal components analysis,PCA)分析。由图可知,得分矩阵图[R2X(cum)=0.992,Q2(cum)=0.967],表明该模型预测较好,可将40个样品区分为4类,该结果与CA一致。如图4所示。
2.3.4正交偏最小二乘判别分析(OPLS-DA)为了进一步检验样本是否有效或者样本间是否存在差异,找出对组分贡献较大的变量,将不同煎煮时间下10个批次样本共有的14个峰面积作为变量,导入SIMCA-P 14.1软件,采用OPLS-DA分析,观察样本聚集情况。其中R2X(cum)、R2Y(cum)和Q2(cum)分别是0.991、0.358、0.185,表明模型具有较好的预测性和稳定性,且其分类结果与PCA分析结果基本一致。
图5不同煎煮时间下10批样品的OPLS-DA 得分图载荷图(LoadingBi plot,如图6所示),峰1、3、4、6、12、14在第三类样品(N1、N3、N4、N5、N24、N25、N26、N27、N30、N31、N33、N34、N35)等样品周围,因此这些峰在第三类样品中贡献较大;剩下的峰8个峰与第四類样品(N11、N12、N18)样品最接近,因此剩下的8个峰对第四类样品聚类贡献较大,而第一类及第二类样品周围无共有峰分布,说明这两组样品中各组分的含量差异较小。
在OPLS-DA模型中,为了筛选出样品中差异性较大的成分,使用变量权重值(Variableimportanceinprojection,VIP)评价方法,VIP>1.00的变量对组间分类贡献较大,具有统计学意义[17]。VIP>1.00的峰有5个:3号峰、5号峰、7号峰、10号峰(CHA)、13号峰(CHI)的VIP值分别为1.65、1.57、1.15、1.13、1.09,说明这几个峰对组间分类贡献较大。如图7所示。
3讨论
3.1色谱条件的选择本实验先后考察了乙腈与磷酸水溶液、乙腈醋酸水溶液、甲醇甲酸水溶液的比例,最后选择了甲醇和0.1%的磷酸水溶液梯度洗脱可使标准品和样品达到较好的分离效果,酚酸鞣质类化合物在在273nm时有较强的紫外吸收,因此选择273nm作为指纹图谱的检测波长。
3.2模式识别的分析本实验建立不同煎煮时间对香格里拉藏医院的10批三果汤散的指纹图谱进行分析,显示样品都具有较高的相似性,在0.985~1之间。选择分离度较高,峰面积较大的色谱峰共14个,经对照品指认共有6个成分被分辨出来。不同煎煮时间的10批药材从直观结果分析显示,其样品含量较单一,药材质量无明显差异。CA与PCA分析结果显示可将不同煎煮时间下的10批三果汤散聚为4类,其分类情况存在一定的差异。并且通过OPLS-DA模型的载荷图、VIP值分析,判断14个峰对于样品分类的具体作用,从而判断出贡献最大的峰。
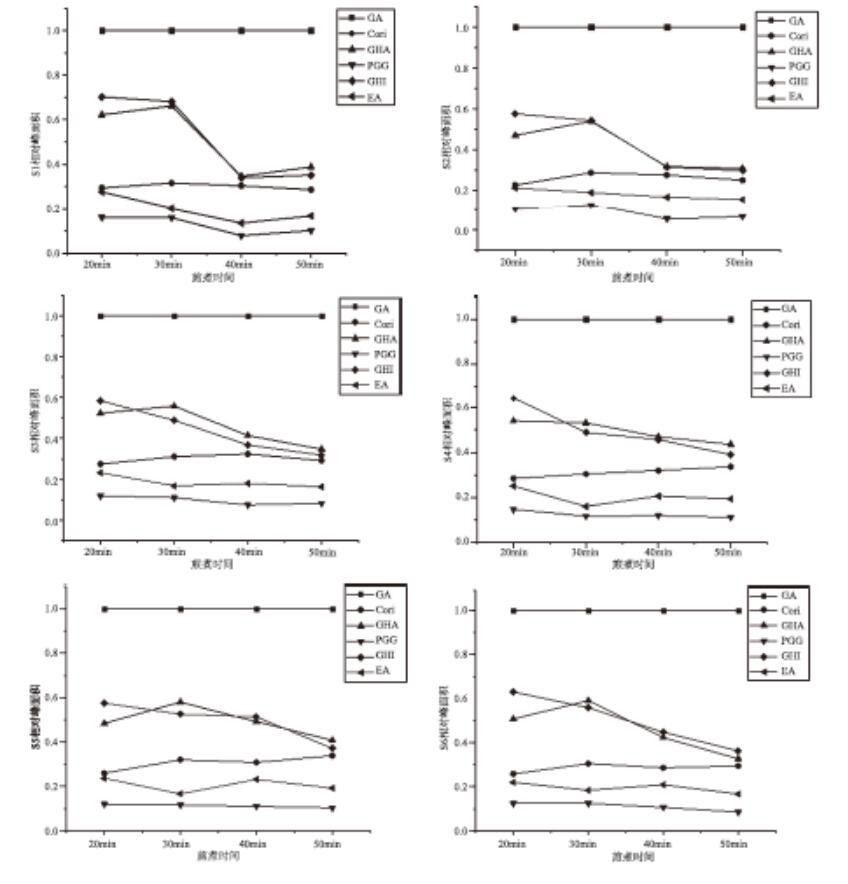
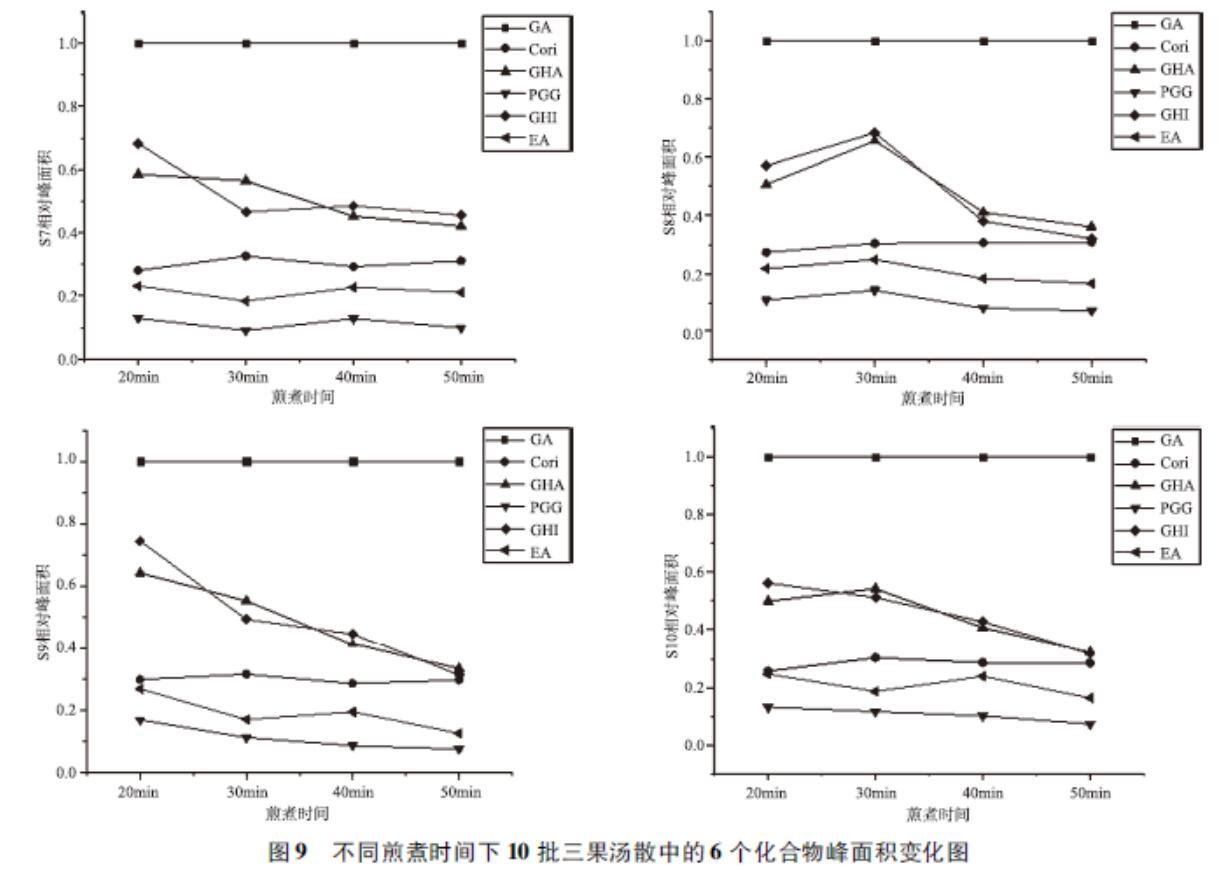
3.3对不同煎煮时间下10批三果汤中6个化合物的相对峰面积变化的分析由聚类分析发现,40个样本中的6个化合物可聚为两大类,说明GA的含量与其他5个成分差异较大。如图8所示。
图86个化学成分峰面积聚类分析图以4号峰(没食子酸为对照),计算6个化合物的相对峰面积,并绘制曲线观察可知,在煎煮20、30、40、50min时间内,6个化合物的相对峰面积变化如图9所示:S1~S10中的Corilagin、EA、PGG的趋势基本一致,相对峰面积的大小也较稳定,CHA在S1~S6、S8、S10中先增后降,以30min达到最大值,其中又以S1和S8中最高,且CHI与CHA在S8中趋势一致,相对峰面积大小相当;CHI在S1~S7、S9~S10中都呈下降趋势,以20min达到最大值,其中又以S1、S9中最高。
通过查阅文献分析可知,三果汤散的组成方药余甘子、诃子、毛诃子中都含有大量的酚酸鞣质化合物,尤其是如GA、CHI、CHA、PGG、1,3,6-三-O-没食子酰基葡萄糖等可水解鞣质[18]。水解鞣质在煎煮过程中,加热的时间可能会使某些化合物分解成GA。本实验将40个样品中的6个已知的化合物峰面积进行CA分析发现,GA与其他5个化合物存在较大差异,在所有样品中的聚集都是最明显的,因此随煎煮时间的增加,其他化合物可能会分解合成GA。峰面积折线图比显示10批三果汤散中以GA为参照,其他峰的峰面积比都小于1,差异变化较明显的峰是10号(CHA)与峰13号(CHI),除CHA外,其他5个化学成分都在20min最高,综上可考虑选择20min或30min的煎煮时间为佳,但是不同煎煮时间下各成分的含量变化的相关性还需进一步研究。
目前三果汤指纹图谱全方位的质控研究报道较少,本实验建立不同煎煮时间10批三果汤散指纹图谱并结合化学模式分析的方法,操作便捷、方法稳定,可为三果汤散的质量控制及临床使用提供参考,但其临床应用还需后期药效学实验进一步研究。
参考文献
[1]MONTON C,WUNNAKUP T,SUKSAEREE J,et al. Investigation of the Interaction of Herbal Ingredients Contained in Triphala Recipe Using Simplex Lattice Design:Chemical Analysis Point of View[J]. 2020:5104624.
[2]李轩豪,刘兰茹,龙伟,等. 基于计算药理学的藏药三果汤散抗氧化研究[J]. 中华中医药杂志,2018,33(9):4139-4142.
[3]杨忠先. 藏药三果汤防治高原红细胞增多症的临床疗效评价[J]. 智慧健康,2019,5(8):66-67.
[4]SURYAVANSHI S V,GATUD M S,BARVE K,et al. Triphala Ameliorates Nephropathy via Inhibition of TGF-β1 and Oxidative Stress in Diabetic Rats[J]. Pharmacology,2020:1-11.
[5]PETERSON C T,PPURANG A,DHALIWAL S,et al. Modulatory Effects of Triphala and Manjistha Dietary Supplementation on Human Gut Microbiota:A Double-Blind,Randomized,Placebo-Controlled Pilot Study[J]. J Altern Complement Med,2020,26(11):1-10.
[6]LALEMAN I,TEUGHELS W. Novel natural product-based oral topical rinses and toothpastes to prevent periodontal diseases[J]. Periodontol 2000,2020,84(1):102-123.
[7]OMRAN Z,BADER A,PORTA A,et al. Evaluation of Antimicrobial Activity of Triphala Constituents and Nanoformulation[J]. Evid Based Complement Alternat Med,2020(2020):6976973.
[8]ABHINAND C S,ATHIRA P A,SOUMYA S J,et al. Multiple Targets Directed Multiple Ligands:An In Silico and In Vitro Approach to Evaluating the Effect of Triphala on Angiogenesis[J]. Biomolecules,2020,10(2):177.
[9]邓星,苟立平,温倩雯,等. 藏药诃子的质量标准提高研究[J]. 中国民族民间医药杂志,2017,26 (18):12-15.
[10]邓星,罗莉娅,苟立平,等. 藏药毛诃子的质量标准提高研究[J]. 中南药学,2018,16 (1):117-120.
[11]冀静. 藏药余甘子质量标准提高研究[D].成都:成都中医药大学,2012.
[12]李斌,李鑫,范源. HPLC同时测定三果汤水提物中没食子酸、柯里拉京及鞣花酸含量[J]. 中国中医药信息杂志,2017,24(9):76-79.
[13]张海伟,张艺,杨继家,等. HPLC测定不同批次藏药三果汤中没食子酸和鞣花酸的含量[J]. 中国实验方剂学杂志,2013,19(10):95-97.
[14]王文军,丁一,窦芳,等.藏药三果汤散化学成分、质量控制及药理作用研究概况[J]. 中国药房,2019,30(4):556-559.
[15]王世岩,周杰. 中药湯剂和配方颗粒临床应用浅析[J]. 中医临床研究,2015,7(5):32-34.
[16]李 强,杜思邈,张忠亮,等. 中药指纹图谱技术进展及未来发展方向展望[J]. 中草药,2013,44(22):3095-3104.
[17]郭丽,杨忠杰,于晓涛,等. 南、北五味子药材的HPLC指纹图谱建立及化学模式识别分析[J].中国药房,2020,31(18):2224-2229.
[18]黄浩洲,魏夕川,林俊芝,等. 余甘子回流过程中鞣质转化及药典含量测定方法合理性探讨[J].中国药学杂志,2019,54(7):581-587.(收稿日期:2021-02-04编辑:陶希睿)
基金项目:云南省高校重点实验室项目。
作者简介:张艳娇(1995-),女,汉族,硕士,研究方向为中药药理学研究。E-mail:2531484362@qq.com
通信作者:范源(1966-),男,汉族,博士,教授,研究方向为中药药理。E-mail:1647909799@qq.com

