车前草水提物对环磷酰胺致免疫抑制小鼠免疫功能的影响
李燕华 梁月琴 李丛元 李翠红 夏洪颖 李仲昆


【摘要】目的:研究车前草水提物(PAE)对CY诱导的免疫抑制小鼠免疫功能的影响,为PAE在临床应用研究提供实验基础。方法:SPF级ICR小鼠60只,随机分为正常对照组、模型组、PAE低、中、高剂量组,每组12只。观察各组小鼠的体重增加率、脏器指数、肠黏膜PPs的数量及淋巴细胞表型、细胞因子水平的改变。结果:注射CY后模型组、PEA低、中剂量组小鼠体重增加率、脏器指数、肠黏膜PPs的数量及细胞因子水平降低(P<0.05),PPs内CD3+细胞比例升高(P<0.05),CD19+细胞比例均降低(P<0.05);尤其以模型组、PEA低剂量组明显(P<0.05)。结论:PAE预处理可改善CY致免疫抑制小鼠的免疫功能。
【关键词】车前草;环磷酰胺;免疫抑制;小鼠
【中图分类号】R967【文献标志码】 A【文章编号】1007-8517(2021)18-0021-05
The Effects of Plantain aqueous Extract on Immune Functions in Immunosuppressive Mice Induced by CyclophosphamideLI YanhuaLIANG YueqingLI CongyuanLI CuihongXIA HongyingLI Zhongkun*
Yanan Hospital of Kunming City,Kunming 650051,ChinaAbstract:Objective To study the effects of plantain aqueous extract(PAE) on immune function in immunosuppressive mice inducedcyclophosphamide,and to provide experimental basis for clinical application of PAE.Metheds The 60 SPF ICR mice were randomly divided intocontrol group,model group,low,mediumand highdose groups of PAE,which had 12 mice of each group.The rate of weight gain,viscera index,number of intestinal mucosa PPs,lymphocyte phenotype and cytokine level were observed.Results After the injection of CY,the rate of weight gain,viscera index,the number of PPs and the level of cytokines in the intestinal mucosa of the mice in the model group,low and medium dose groups of PEA were decreased(P<0.05),the proportion of CD3+ cells in PPs were increased (P<0.05),while the proportion of CD19+ cells were decreased (P<0.05),especially in the model group and the low dose group of PEA (P< 0.05).Conclision PAE pretreatment can improve the immune function of CY induced immunosuppressive mice.
Keywords:Plantain;Cyclophosphamide;Immunosuppression;Mice
車前草(Ribwort plantain)为车前科植物车前或平车前的干燥全草,为世界范围内应用最广泛的药用植物之一[1-2]。具有凉血、清热、解毒、利尿、祛痰、抗肿瘤、神经和免疫调节的作用[3-6],可治疗热淋涩痛、暑湿泻痢、水肿尿少、痈肿疮毒、痰热咳嗽、吐血衄血等疾症[7]。免疫系统在抵抗微生物和外来抗原方面起着重要的作用,它参与了由宿主免疫状态所决定的疾病的发生与恢复,如癌症、肥胖、糖尿病、肺结核等,对于免疫介导性疾病的预防和康复都至关重要。免疫器官(如骨髓、胸腺、脾脏、扁桃体、淋巴结、粘膜免疫系统包括肠黏膜派氏淋巴结(Peyer′s patches,PPs)、免疫细胞、免疫分子都是机体免疫系统的重要组成部分[8]。环磷酰胺(Cyclophosvnamide,CY)是一种烷基化剂,被广泛应用于免疫治疗和肿瘤化疗,其不良反应包括免疫抑制、骨髓抑制、白细胞减少和氧化应激等[9-11]。有报道[12]称,CY可产生氧化应激,介导氧化还原平衡的破坏,导致生化和生理上的干扰。CY可破坏Th1/Th2平衡[12],诱导T细胞和B细胞的绝对计数下降[13]。目前对车前草多种药用价值的报道甚多,但对肠道免疫功能的影响尚未报道。研究拟通过观察小鼠体重变化率、脏器指数、肠黏膜PPs的数量及淋巴细胞表型、细胞因子水平等指标的变化,初步探讨PAE对肠道免疫功能的影响,为开发利用车前草提供参考。
1材料与方法
1.1药物车前草购自云南新世纪中药饮片药有限公司,经云南省楚雄州人民医院罗宝生主任药师鉴定为车前草属车前草科植物Plantago asiatica L。取干燥车前草100g,煎煮2次,第1次煎煮前先用纯水浸泡约20min,水量为浸过药面1~3cm,先用武火煮沸,再改用文火煎煮30min。合并2次水煎液,用旋转蒸发仪将水煎液浓缩至100mL,得到车前草水提物,浓度为1g/mL,含生药量为1g/mL,冷藏备用,给药剂量按生药量计算。0.9%氯化钠注射液(批号G115051701,四川科伦药业股份有限公司);注射用CY(批号15102925,江苏盛迪医药有限公司)。
1.2动物6~8周龄18~22g的SPF级ICR雄性小鼠60只,自湖南斯莱克景达实验动物有限公司购入,动物许可证号SCXK(湘)2013-0004。饲养于昆明市延安医院中心实验室动物房,保持室温25±2℃,湿度50%±5%。
1.3试剂改良RPMl-l640培养基(赛默飞世尔生物化学制品(北京)有限公司);胎牛血清(FBS,法国Biowest公司);抗小鼠CD3e-FITC、抗小鼠CD19-PE购自美国BD-Pharmingen公司;MouseIL-4 ELISA kit、Mouse IFN-Y ELISA kit购自欣博盛生物科技有限公司,其他试剂均为分析纯。
1.4仪器全自动酶标仪Model550(美国BIO-RAD公司);FACSCalibur流式细胞仪(FC-500)(美国Beckman公司);LEGENDMICRO17台式微量离心机(美国 Thermo公司);TD5M低速多管架自动平衡离心机(长沙万佳森仪器设备有限责任公司);FA2004电子分析天平(上海精密科学仪器有限公司);RE-52A型旋转蒸发仪(上海亚荣生化仪器厂)。
1.5动物分组、造模及给药60只SPF级ICR健康雄性小鼠随机分为正常对照组、模型组、PAE低、中、高剂量组,每组12只。PAE低、中、高剂量组分别每天按0.25、0.5、1.0g/kg灌胃,正常对照组、模型组给予与PAE体积相当的NS灌胃,共14d。在实验第9d开始模型组和PAE各剂量组小鼠隔日给予CY注射液50mg/kg腹腔注射,共3次,正常组小鼠给予等体积生理盐水腹腔注射,末次注射CY 24h后颈椎脱臼处死小鼠,取材进行各项指标检测。
1.6体质量增率、脾脏及胸腺指数测定上述各组小鼠连续灌胃14d后称取体质量并颈椎脱臼处死,无菌条件下分离脾脏和胸腺剔除脂肪和结缔组织后称重,分别计算体质量增率、脾脏及胸腺指数:净体质量增率=(处死时体质量-初始体质量)/初始体质量×100%,脏器指数(%)=脏器重量(g)/小鼠体质量×100%。
1.7PPs细胞表型的测定
1.7.1PPs计数将肠腔冲洗干净,迅速放入含5%胎牛血清(5%FBS)的RPMI1640培养基的培养皿中,肉眼可见外肠壁上米白色麦粒样圆形突起即为派氏结(PPs),计数PPs个数。
1.7.2PPs细胞表型测定用眼科镊和眼科剪小心分离出小肠外壁PPs,将PPs迅速浸入RPMI1640液的培养皿中,将PPs移入经RPMI1640液浸润过的120目细胞筛中,用研磨棒加适当力度轻轻研磨,再RPMI1640液冲洗过滤;取其过滤液再经200目细胞筛过滤后收集滤液加至5mL,以2000r/min离心10min,弃上清液,加入RPMI1640液约3mL,重悬细胞即得PPs细胞悬液。将收集到的PPs细胞悬液进行细胞计数并调节细胞浓度至1×107/mL,分别取100μL细胞移入流式细胞专用管进行荧光标记,每管依次加入抗小鼠CD3e-FITC,CD19-PE单克隆抗体各0.5μg,混匀后4℃避光30min,荧光标记结束后,用PBS洗涤细胞2次后重悬于400μL的PBS中用流式细胞仪检测细胞表型。
1.8ELISA检测细胞因子分泌水平打开小鼠腹腔取出全段小肠,向将NS3 mL注入肠腔内,保留并轻轻晃动4min,使肠内容物充分混匀溶解,收集肠腔内的NS于EP管中,3000r/min离心10min,取上清液,编号备用,按酶联免疫技术(ELISA)鼠IL-4、IFN-γELISA试剂盒说明书上的流程操作进行检测操作,以酶标仪测定肠黏膜IL-4、IFN-γ的光密度值。
1.9统计学方法实验数据以(x±s)差表示,用SPSS 23.0統计学软件进行数据分析,组间比较采用单因素方差分析,P<0.05表示差异有统计学意义。
2结果
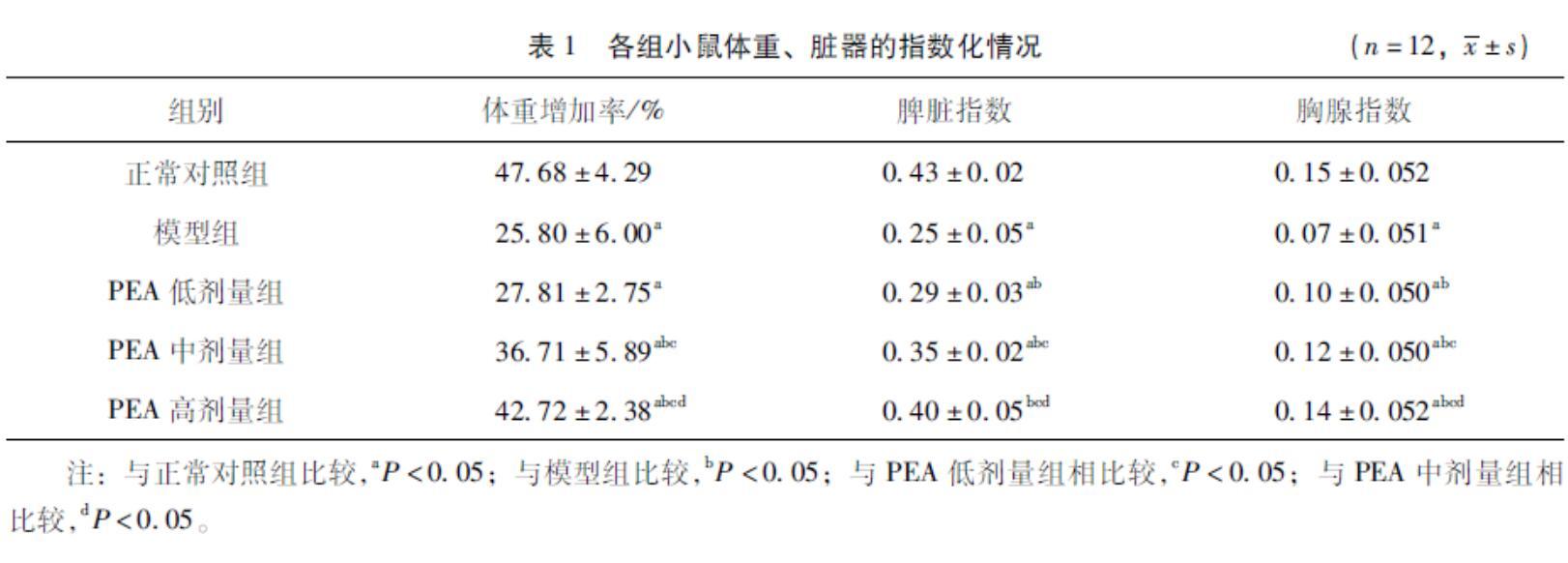
2.1PEA对免疫抑制小鼠体重增加率、胸腺及脾脏指数的影响与正常对照组相比较,模型组、PEA低、中、高剂量组体重增加率、胸腺指数均显著降低(P<0.05),模型组、PEA低、中剂量组脾脏指数显著降低(P<0.05);与模型组相比较,PEA中、高剂量组的体重增率显著增高(P<0.05),PEA低、中、高剂量组脾脏指数和胸腺指数显著升高(P<0.05);与PEA低剂量组相比较,PEA中、高剂量组体重增率、脾脏指数和胸腺指数显著升高(P<0.05);与PEA中剂量组相比较,PEA高剂量组体重增率、脾脏指数和胸腺指数显著升高(P<0.05)。见表1。
2.2PEA对PPs数目及淋巴细胞表型的测定与正常对照组相比较,模型组、PEA低、中剂量组小鼠肠黏膜PPs数目及CD19+细胞比例均显著降低(P<0.05),模型组、PEA低剂量组小鼠肠黏膜PPs内CD3+细胞比例显著升高(P<0.05);与模型组相比较,PEA低、中、高剂量组小鼠肠黏膜PPs数目及CD19+细胞比例均显著升高(P<0.05),CD3+细胞比例显著降低(P<0.05);与PEA低剂量组相比较,PEA中、高剂量组小鼠肠黏膜PPs数目显著升高(P<0.05),PEA高剂量组的小鼠肠黏膜CD19+细胞比例显著升高(P<0.05),CD3+细胞比例显著降低(P<0.05);与PEA中剂量组相比较,PEA高剂量组小鼠肠黏膜PPs数目显著升高(P<0.05)。见表2。
2.3PEA对细胞因子的调节与正常对照组相比较,模型组、PEA低、中剂量组小鼠肠黏膜IFN-γ、IL-4浓度均显著降低(P<0.05);与模型组相比较,PEA低、中、高剂量组小鼠肠黏膜IFN-γ、IL-4浓度比值均显著升高(P<0.05);与PEA低剂量组相比较,PEA中、高剂量组小鼠肠黏膜IFN-γ、IL-4浓度比值均显著降低(P<0.05);与PEA中剂量组相比较,PEA高剂量组小鼠肠黏膜IFN-γ、IL-4浓度比值均显著降低(P<0.05)。见表3。
3討论
胸腺是机体的中枢免疫器官,也是参与细胞免疫和T细胞分化、发育和成熟的重要器官;脾脏是机体最大的外周淋巴组织器官,是机体的免疫中心,含有大量NK细胞、记忆T细胞及Th细胞等,在机体免疫中都发挥着重要作用。免疫器官所含免疫细胞数量及功能与其重量密切相关,脏器指数可在一定程度上反应机体免疫功能的强弱,因此,脾脏及胸腺重量的改变可初步反映出受试物对机体免疫系统的影响[14]。
PPs富含T细胞(约为40%)和B细胞(约为60%),在免疫监视和细胞介导的黏膜免疫中具有重要作用;是诱导细胞增殖活化和抵御肠道内有害物质侵袭的主要部位,PPs中淋巴细胞及其亚群的数量和活性状态可作为反映肠道黏膜局部的免疫状态的指标[15]。CD3分子为T细胞的特有标志,表达于成熟的T淋巴细胞表面。CD19分子是与B细胞增殖、分化、活化及抗体产生有关的重要膜抗原,存在于全体B细胞表面,是最重要的B细胞标记因子。茯苓多糖能拮抗CY诱导的各淋巴组织中T、B细胞亚群的失衡,尤其是肠道免疫系统作用[16],表现为PPs细胞中CD3+细胞比例下降,CD19+细胞比例上升。
维持肠黏膜系统免疫功能平衡的另一个重要因素是细胞因子。辅助性T细胞(helperTcell,Th)可分为Th1和Th2两种类型,对机体免疫有重要的调节作用。其中Th1细胞调节细胞免疫,促进细胞毒性活动和炎症反应,与迟发型超敏反应的发生和机体抗肿瘤作用有关,主要分泌IFN-γ和IL-2等细胞因子;Th2细胞辅助B细胞增殖分化为浆细胞,分泌抗体调节体液免疫,主要分泌IL-4等细胞因子;IFN-γ和IL-4分别是Th1和Th2细胞的特征性细胞因子。
CY是治疗恶性肿瘤最常用的烷化剂,属广谱抗肿瘤药物,可抑制细胞的DNA合成、干扰细胞的增殖、抑制抗体形成,是临床上治疗肿瘤和免疫性疾病的常用药物之一[8],其主要毒副作用是免疫和骨髓抑制。在既往的研究[16-18]中提示注射CY可出现免疫抑制,表现为实验动物体重、脏器指数、肠黏膜PPs的数量及细胞因子水平降低,PPs内CD3+细胞比例升高,CD19+细胞比例均降低,本研究的结果与之相同。在有的研究中显示PPs内CD3+细胞数量降低,由于在本研究并未测量PPs内CD3+、CD19+细胞的绝对数量,CD3+细胞比例的升高考虑为CD19+细胞下降较多引起PPs内细胞总数降低所致。
许多天然物质(包括植物来源和动物来源)具有调节先天和适应性免疫功能和抗氧化的特性,临床上已经使用许多中草药来预防化疗药物的毒副作用[8,19-20]。有许多生物活性多糖对免疫系统有较深的影响,且无明显毒副作用,具有免疫调节功能[21],如促进细胞因子或趋化因子分泌、激活补体系统和免疫相关细胞等[22]。同时在众多的研究中,许植物多糖[16,18]能够对抗CY引起的免疫抑制状态如:实验动物体重、脏器指数、肠黏膜PPs的数量及细胞因子水平降低,PPs内淋巴细胞表型比例的改变。在本研究中,PEA已表现出了与前述报道相似的改变,尤其以中、高剂量组明显,然而中、高剂量之间的差异不明显。
PAE预处理可改善CY致免疫抑制小鼠的免疫功能。由于本文仅研究车前草水提物对环磷酰胺致免疫抑制小鼠的免疫功能是否有影响及其影响的程度,故并未设立阳性对照组,有关车前草水提物与其它免疫调节剂的比较,有待进一步深入的研究。
参考文献
[1]WANG H,ZHAO C,HUANG Y,et al. Chemical Constituents and Bioactivities of Plantaginis Herba[J].Hong Kong Med J,2015(22):29-35.
[2]GONCALVES S,ROMANO A. The medicinal potential of plants form the genus Plantago (Plantaginaceae) Ind[J].Crops Prod,2016(82):213-226.
[3]FERRZAZZANO G F,CANTILE T,ROBERTO L,et al. Determination of the in vitro and in vivo antimicrobial activity on salivary streptococci and lactobacilli and chemical characterisation of the phenolic content of a Plantago lanceolata infusion[J].BioMed. Res. Int. 2015
[4]ADOM M B,TAHER M,MUTALABISIN M F,et al.Chemical constituents and medical benefits of Plantago major[J].Biomed Pharmacother. 2017(96):348-360.
[5]BOSKABADY M,RAKHSHANDAH H,AFIAT M,et al. Antitussive effect of Plantago lanceolata in guinea pigs[J].Iran. J. Med. Sci,2015(31):143-146.
[6]BEARA I N,LESJAK M M,ORCˇIC' D Z,et al. Comparative analysis of phenolic profile,antioxidant,anti-inflammatory and CYtotoxic activity of two closely-related plantain species:Plantago altissima L. and Plantago lanceolata L[J].LWT Food Sci. Technol,2012(47):64-70.
[7]国家药典委员会. 中华人民共和国药典 (一部)[M]. 北京:中国医药科技出版社,2015:64.
[8]钟金凤,方热军.环磷酰胺免疫抑制机制及在动物模型上的应用[J].中国免疫学杂志,2016,32(10):1541-1546.
[9]DENG J,ZHONG Y F,WU Y P,et al. Carnosine attenuates CYclophosphamide-induced bone marrow suppression by reducing oxidative DNA damage[J].Redox Biol,2018(14):1-6.
[10]SUN C,YANG J,PAN L,et al. Improvement of icaritin on hematopoietic function in CYclophosphamide-induced myelosuppression mice[J].Immunopharmacol. Immunotoxicol,2018(40):25-34.
[11]MANENTE F A,QUINELLO C,FERREIRA L S,et al. Experimental sporotrichosis in a CYclophosphamide-induced immunosuppressed mice model[J].Med. Mycol,2018(56):711-722.
[12]BORDBAR S,ANWAR F,SAARI N. High-value components and bioactives from sea cucumbers for functional foods-A review[J]. Mar. Drugs,2011(9):1761–1805.
[13]YU Q,NIE S P,WANG J Q,et al. Molecular mechanism underlying chemoprotective effects of Ganoderma atrum polysaccharide in CYclophosphamide-induced immunosuppressed mice[J].J. Funct. Foods,2015(15):52-60.
[14]李学敏,于卿,郑荣,等.4种常见海参对小鼠肠道黏膜免疫功能的保护作用[J].食品科学,2013,34(15):240-244.
[15]GAO J,LI F L,ZHOU Y. Research on the devolopment of intestinatal mucosa and the devolopment and activation of T lymphocyte in various periods[J].Chin J Immuol,2009,25(8):678-683.
[16]王青,胡明华,董燕,等.茯苓多糖对免疫抑制小鼠粘膜淋巴组织及脾脏中CD3+和CD19+细胞变化的影响[J].中国免疫学杂志,2011(27):228-231.
[17]李燕华,梁月琴,夏洪颖,等. 单次大剂量、多次小剂量环磷酰胺腹腔注射构建小鼠免疫抑制模型对比观察[J].山东医药,2020,60(3):42-46.
[18]李燕华,梁月琴,王崇静,等. 粗根荨麻多糖对环磷酰胺诱导的免疫抑制小鼠肠道派氏结细胞表型及TLR4的影响[J].中成药,2017,39(6):1272-1276.
[19]张莹石,李清,孙飞龙,等. 艾迪注射液联合CHOP方案治疗恶性淋巴瘤的Meta分析[J].中国新药与临床杂志,2014,33(11):807-812.
[20]WANG H,YANG S,WANG Y H,et al. Immunoenhancement Effects of Glycosaminoglycan from Apostichopus japonicus:In Vitro and In CYclophosphamide-Induced Immunosuppressed Mice Studies[J].Mar Drugs,2017,15(11):347.
[22]YANG L,ZHANG L M. Chemical structural and chain conformational characterization of some bioactive polysaccharides isolated from natural sources. Carbohydr[J].Polym,2009(76):349-361.(收稿日期:2021-02-04编辑:刘斌)药物研究
基金项目:云南省高层次卫生技术人才培养项目(No.L201625);云南省教育厅科学研究基金项目(2020J0217);昆明市卫生健康委员会卫生科研课题项目(2020-13-01-011)。
作者简介:李燕华 (1979-),女,彝族,硕士,主管药师,研究方向为药理学研究。E-mail:1836297741@qq.com
通信作者:李仲昆 (1967-),女,漢族,主任药师、硕士生导师,研究方向为医院药学研究。E-mail:yayylzk@163.com

