原发性胆汁性肝硬化患者外周血丝氨酸蛋白酶抑制剂A1基因多态性分析*
吴晓枫,黄 怡,杨如杏,邓少东,张静莹,官成浓,王 颖
原发性胆汁性肝硬化(primary biliary cirrhosis,PBC)是一种多见于中老年女性的慢性肝内胆汁淤积性疾病,在北美和北欧国家发病率相对较高[1,2]。PBC患者临床表现主要有乏力、皮肤瘙痒等,自然发病史包括临床前期、无症状期、症状期和失代偿期。由于该病在发病前进展较为缓慢,可长达10~15年,通过检测可靠的生物标志物对该病进行早期筛查具有重要的临床意义[3,4]。既往研究[5,6]发现,基因遗传多态性可能是个体间PBC易感性差异的重要原因,已有多个基因被报道与不同人种PBC易感性有关。丝氨酸蛋白酶抑制剂A1基因(serine protease inhibitor A1,SERPINA1)是α1-抗胰蛋白酶家族(α1-antitrypsin family,AAT)的重要成员[7],已有国外学者报道SERPINA1 基因多态性与PBC易感性存在关联,但有关结论还存在不一致性[8,9]。本研究检测了62例PBC患者外周血SERPINA1基因多态性,旨在为该病的临床诊治和发病机制研究提供有价值的资料,现报道如下。
1 资料与方法
1.1 研究对象 2018年3月~2020年3月在我院就诊的PBC患者62例,诊断符合《原发性胆汁性肝硬化诊断和治疗共识(2015年)》的标准[10],排除标准:①患有病毒性肝炎或药物性肝损伤;②患有严重的心、脑、血液系统疾病和感染性疾病;③入院前接受过相关药物治疗;④有精神状态异常。另选择同期在我院体检的健康人群60例作为对照组,所有纳入对象均对本研究知情同意,研究经我院医学伦理委员会审核通过。
1.2 外周血基因提取和单核苷酸多态性(single nucleotide polymorphism,SNP)位点基因分型检测 抽取外周血3 mL,采用酚-氯仿法提取DNA,使用NanoDrop公司提供的NanoDrop2000超微量分光光度计检测DNA浓度和纯度,将合格标本保存于-20℃冰箱备用。针对SERPINA1 基因rs28929474位点设计特异性引物,上游引物rs28929474-F:5′-TCCAGGCCGTGCATAAGG-3′,下游引物rs28929474-F:5′-GCCCCAGCAGCTTCAG-3′,引物交由南京擎科生物技术有限公司合成。PCR反应体系为20μL:DNA模板1μL,PCR反应液10μL,上、下游引物各1μL,双蒸水7μL。PCR反应条件:94℃预变性4 min,94℃ 30 s,56℃ 30 s,72℃ 42 s,共35个循环,最后72℃延伸10 min。取PCR产物,经1.8%琼脂糖凝胶电泳对扩增产物进行确认。取10μL扩增产物进行纯化,将纯化后的产物送南京擎科生物技术有限公司测序,对SERPINA1 基因rs28929474位点基因型和等位基因进行分析和记录。
1.3 血清自身抗体检测 使用YHLO公司生产的自身免疫性肝病抗体谱检测试剂盒(免疫印迹法) 检测血清自身抗体;采用欧蒙公司生产的检测抗线粒体抗体谱( anti-mitochondrial antibody,AMA) 试剂盒(欧蒙斑点法)。
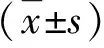
2 结果
2.1 两组一般资料 两组性别、年龄、BMI差异无统计学意义(P>0.05,表1)。

表1 两组一般资料比较
2.2 两组SERPINA1基因rs28929474位点基因型和等位基因频率比较 两组人群外周血SERPINA1 基因rs28929474位点基因型分布符合哈迪-温伯格平衡(P>0.05),具有群体代表性。PBC患者与健康人基因型分布频率存在显著性差异(P>0.05);PBC患者AA基因型和A等位基因频率显著高于对照组(P>0.05),而GG、GA基因型和G等位基因显著低于对照组(P>0.05,表2),提示A等位基因是患者发生PBC的保护性因素,而G等位基因可能是患者发生PBC的风险因素。

表2 两组SERPINA1 基因rs28929474位点基因型和等位基因频率(%)分布比较
2.3 不同基因型PBC患者Child评分和MELD评分比较 携带GA/AA型PBC患者Child评分和MELD评分显著高于GG型PBC患者(P>0.05),两组血清抗核抗体(ANA)和AMA-M2抗体阳性率比较无显著性统计学差异(P>0.05,表3)。
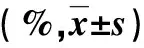
表3 不同基因型PBC患者肝功能评分和血清自身抗体阳性率比较
3 讨论
PBC患者肝组织病理学表现主要有进行性、非化脓性、破坏性肝内小胆管炎、伴门管区淋巴细胞浸润和肝纤维化等。近年来,随着AMA检查的逐渐普及,PBC的确诊率有了明显的提升[11]。研究发现,PBC患者住院期间发生医院感染风险显著增加,较普通人可增加5倍以上,除自发性细菌性腹膜炎外,还可引发尿路感染、肺部感染和血流感染,这些合并症可进一步导致病情的进展,导致患者出现肝衰竭,甚至死亡,是患者不良预后的重要原因。PBC可伴发皮肤、关节和腺体的自身免疫性疾病,如硬皮病、干燥综合征等,在临床上受到实验室条件、临床医生对疾病认知不足等因素的限制,导致该病常被误诊为病毒性肝炎、肝炎肝硬化或结缔组织病,不但延误了治疗时机,还增加了治疗负担和经济成本,影响患者预后。目前,已有C反应蛋白(C reactive protein,CRP)、降钙素原(procalcitonin,PCT)等可供检测,但由于PBC患者长期处于全身性慢性炎症状态,这些血液学指标的判断效能不足,筛选出可靠的血液生物标志物对该病进行提前诊断和治疗具有重要的意义[12,13]。
研究[14]发现PBC发病存在一定的家族聚集性和性别差异,女性患病率明显升高,说明PBC是一种受到个体间遗传多态性影响的疾病。已有研究发现汉族人群PBC发病与CD58基因、CD28基因、CD80基因、STAT4基因、IL-21基因、IL-12A基因等存在关联[15-19]。丝氨酸蛋白酶家族蛋白分子量大小约为40~50 kD,主要通过影响基质金属蛋白酶(MMPs)活性参与细胞外基质的水解过程,对机体炎症反应、细胞迁移、纤维蛋白溶解、细胞凋亡等生理过程产生重要的影响[20,21]。SERPINAI是一种高度保守的急性期时相反应蛋白,主要在肝脏合成和分泌,在其他组织细胞如肠上皮细胞、单核细胞和肿瘤细胞也产生[22]。在高级别脑胶质瘤组织SERPINA蛋白表达增加,且与患者预后不良有关[23]。在先兆子痫孕妇,尿液SERPINA mRNA水平上调,被认为是评估先兆子痫病情严重程度的有潜力的生物标志物[24]。肺气肿患者SERPINA1基因变异与肺功能改变有关[25]。研究发现[26],SERPINAI基因rs8004738位点多态性与中国人群慢性阻塞性肺疾病存在关联。本研究采用基因测序法对本地区PBC患者外周血SERPINA1 基因rs28929474位点多态性进行调查,结果发现该位点主要包含GG、GA、AA基因型,而PBC患者AA基因型、A等位基因频率显著高于健康人,经Logistic回归分析结果也显示了携带G等位基因是携带A等位基因型患者发生PBC风险的2.32倍,表明该位点的遗传多态性与本地区居民PBC易感性存在一定的关联。
Child评分和MELD评分是临床评估肝硬化患者肝脏功能的指标,对于PBC患者预后也有一定的预测价值。本研究进一步分析了携带不同基因型PBC患者Child评分和MELD评分及ANA、AMA-M2抗体阳性率的差异,结果显示携带GA/AA型PBC患者Child评分和MELD评分更高,但ANA和AMA-M2阳性率无显著性差异。本研究结果显示了SERPINA1基因rs28929474位点多态性对于判断PBC患者病情也有一定的价值,推测其原因可能是:SERPINA1在基因水平上的变异可能改变SERPINA1 蛋白转录,进而对肝细胞细胞外基质清除、炎症反应和细胞凋亡等生物学过程产生影响,导致对PBC的易感性差异[27,28]。SERPINA1 基因可能存在多处多态性位点而对PBC易感性产生影响,其它位点对PBC易感性的影响以及不同位点之间的交互效应有待进一步研究和完善。肝硬化涉及免疫反应发病机制,目前研究尚未明确,临床上也无有效药物逆转肝硬化的进程。因此,在患者疾病发生早期采取有效的干预和管理措施,对相关并发症进行充分的预防,对于提高患者生存期,改善患者预后具有重要的意义。
综上所述,本研究结果证明了本地区居民发生PBC可能与SERPINA1 基因rs28929474位点多态性有关,其中A基因可能是保护基因,而G基因可能是风险基因。监测外周血SERPINA1 基因rs28929474位点多态性对于预测PBC的发生可能具有一定的临床意义。

