红参提取物通过抑制凋亡减轻H2O2 诱导大鼠心肌细胞氧化损伤作用研究*#
张雨曦* 庄倩 李玉倩 石林 章卓 姜鲜
(1. 西南医科大学药学院2019 级研究生,四川 泸州 646000;2. 西南医科大学药学院药理教研室,四川泸州 646000;3. 泸州市人民医院麻醉科,四川 泸州 646000)
心血管疾病是目前病死率较高的疾病[1],发病机制与心肌细胞损伤有关,其中心肌细胞的氧化损伤是心血管疾病发生发展的重要因素,可大大增加患者的死亡风险[2]。近年来研究显示,氧化损伤可导致心肌细胞的正常结构和生理功能受损,进一步诱发心肌细胞凋亡,并最终演变成心力衰竭[3]。因此,减轻心肌细胞的氧化损伤对缓解心血管疾病尤为重要。
红参提取物(Red ginseng extract,Rge)包含人参皂苷类、有机酸类、糖类等多种活性成分,具有抗肿瘤、抗氧化、增强心功能等多种药理作用,尤其在免疫系统疾病、心血管系统疾病中具有明显的抗氧化作用[4-10]。但是,目前采用细胞模型对Rge 减轻心肌氧化损伤的研究较少,因此本研究旨在研究Rge 减轻过氧化氢(Hydrogen peroxide,H2O2)致H9c2 心肌细胞氧化损伤的作用及相关机制,并为Rge 防治心肌氧化损伤提供参考依据。
1 材料与方法
1.1 材料
1.1.1 细胞株
大鼠心肌细胞(H9c2)株购自中国科学院上海细胞库,用含10% FBS 和1%青-链霉素的DMEM/H 培养基在37℃、5%CO2孵箱中培养,每两天进行换液和传代。
1.1.2 药物与试剂
红参提取物(含量大于98%,西安维珍生物科技有限公司,中国);过氧化氢(Hydrogen peroxide,H2O2)(上海麦克林生化科技有限公司,中国);DMEM/H 培养基(Gibco,美国);FBS(Gibco,美国);青-链霉素溶液(北京罗比生物科技有限公司,中国);MTT(北京索莱宝科技有限公司, 中国); 乳酸脱氢酶( Lactate dehydrogenase,LDH)(南京建成生物工程研究所,中国);Bax、Bcl-2、Caspase-3、β-actin 抗体(Proteintech,美国);羊抗兔二抗、羊抗鼠二抗(上海碧云天生物技术有限公司,中国);PAGE快速制备试剂盒(上海雅酶生物医药科技有限公司,中国);双敏化学发光试剂(Affinity,美国);蛋白Marker(北京索莱宝科技有限公司,中国);5× SDS-PAGE 蛋白上样缓冲液,JC-1 试剂盒(上海碧云天生物技术有限公司,中国)。
1.2 方法
1.2.1 MTT 法筛选H2O2最优造模浓度
选对数生长期的H9c2 心肌细胞(7×103个·孔-1)接种于96 孔板中,设置对照组和模型组,每组6 个复孔,贴壁24 h 后给药。对照组常规培养;模型组用不同浓度(0.9 mg·kg-1、1.8 mg·kg-1、3.6 mg·kg-1、7.2 mg·kg-1、14.4 mg·kg-1)H2O2溶液处理6 h 后,弃上清,以含10% MTT 的培养液孵育4 h 后,每孔换用DMSO 100 μL,摇床震荡5 min,测定490 nm 波长处吸光度值(OD)。细胞存活率=模型组OD /对照组OD×100%。实验重复3 次。
1.2.2 Rge 对H9c2 心肌细胞增殖的影响
选对数生长期的H9c2 心肌细胞(7×103个·孔-1)接种于96 孔板中,设置对照组和Rge 组,每组6 个复孔,贴壁24 h 后给药。对照组常规培养;Rge 组用不同浓度(50、100、200、400、800、1600 mg·kg-1)Rge 溶液培养24、48、72 h。后续实验步骤参照1.2.1。实验重复3 次。
1.2.3 Rge 对H2O2致H9c2 心肌细胞氧化损伤的作用
对数生长期H9c2 心肌细胞(7×103个·孔-1)接种于96 孔板中,设置对照组,模型组,Rge 低、中、高浓度组,每组6 个复孔,贴壁24 h 后给药。对照组常规培养;模型组用9 mg·kg-1的H2O2溶液处理6 h;Rge 低、中、高浓度组分别用200 mg·kg-1、400 mg·kg-1和800 mg·kg-1Rge 溶液处理24 h 后,9 mg·kg-1H2O2溶液继续处理6 h。后续实验步骤参照1.2.1。实验重复3 次。
1.2.4 化学法检测LDH 释放量
选对数生长期的H9c2 心肌细胞(1×104个·孔-1)接种于24 孔板中,细胞按1.2.3 进行分组和给药,每组3 个复孔。,吸取各组细胞培养上清于1.5 mL EP 管,4℃条件下,以3000 g 离心10 min。结束后,取上清液,按试剂盒说明书检测。
1.2.5 JC-1 法凋亡染色
选对数生长期的H9c2 心肌细胞(5×104个·孔-1)接种于6 孔板中,设置对照组,模型组,CCCP 组(阳性对照),Rge 低、中、高浓度组,每组3 个复孔,贴壁24h 后给药。对照组常规培养;模型组和CCCP 组分别用9 mg·kg-1的H2O2溶液和2.05 mg·kg-1的CCCP 溶液处理6 h;Rge 低、中、高浓度组分别用200 mg·kg-1、400 mg·kg-1和800 mg·kg-1的Rge 溶液处理24 h 后,9 mg·kg-1的H2O2溶液继续处理6 h。处理完毕后,PBS 清洗两次,JC-1 染色工作液与完全培养基1:1 混合,37 ℃作用20 min 后,除去上清,用1×JC-1 缓冲液清洗两次,最后加入2 mL PBS,荧光显微镜下观察染色情况并进行拍照。
1.2.6 Western blot 法检测细胞中Caspase-3、Bax、Bcl-2 蛋白表达
选对数生长期的H9c2 心肌细胞(5×105个·孔-1)接种于6 孔板中,细胞按1.2.3 进行分组和给药,每组3 个复孔。用预冷的PBS 洗三次,每孔以80μL 裂解液(PMSF:PⅠPA=1:100)裂解细胞,置于冰上0.5h;4℃条件下,以12000 g 离心10 min;结束后,回收上清,BCA 试剂盒测定各组细胞蛋白浓度;将各组蛋白样品与5×上样缓冲液按1:4 混合后,金属浴(95℃)煮蛋白10 min;PAGE凝胶电泳分离目标蛋白;湿法转膜;用封闭液室温封闭40 min;TBST 溶液快速洗膜3 次,每次10 min;结束后,分别加入Caspase-3、Bax、Bcl-2 抗体在4 ℃孵育过夜;次日再用TBST 溶液快速洗膜3 次,每次10 min;然后加入二抗,室温摇床慢速孵育1 h;TBST 溶液洗膜3 次,每次10 min;最后加入显影液,用凝胶成像仪采集图像。
1.2.7 统计学分析
采用GraphPad Prism 9.0 进行统计学分析并作图,数据结果均以均数±标准(±SD)表示,组间的差异以单因素方差分析进行比较。P<0.05 表示差异有统计学意义。
2 结果
2.1 Rge 对H2O2 损伤的H9c2 心肌细胞活力的影响
利用MTT 法测定H2O2致H9c2 心肌细胞氧化损伤的ⅠC50,见图1A,与对照组相比,模型组的细胞活力呈现剂量依赖性降低(P<0.05 或P<0.001),其ⅠC50为9.16 mg·kg-1,故后续试验选择9 mg·kg-1H2O2作为H9c2 心肌细胞氧化损伤的造模浓度。同时,利用MTT 法检测不同浓度Rge与H9c2 心肌细胞作用24、48、72 h 的影响,见图1B,与对照组相比,50、100、200、400、800 mg·kg-1Rge 作用H9c2 心肌细胞24、48、72 h 时,细胞的活力没有任何影响(P>0.05),然而Rge 浓度为1600 mg·kg-1时,细胞的活力显著被抑制(P<0.001),故后续实验采用200、400、800 mg·kg-1Rge 分别作为低、中和高浓度用于预处理H9c2心肌细胞24 h。
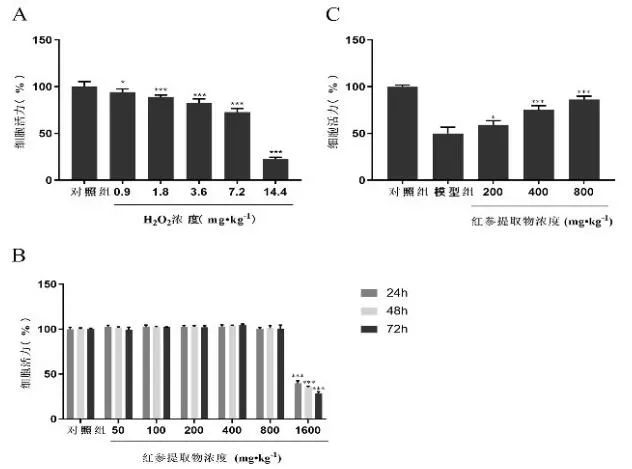
图1 MTT 法评价Rge 和H2O2 对细胞活力的影响
最后,利用MTT 法评价Rge 对抗H2O2所致的氧化损伤,见图1C,与对照组相比,模型组的细胞活力降至50.09%(P<0.05),表明成功建立氧化损伤模型,与模型组相比,Rge 低、中、高浓度组的细胞活力分别提升了9.21%、25.34% 和36.25%,表明Rge 呈剂量依赖性降低H2O2所致的氧化损伤。
2.2 Rge 对H2O2 诱导H9c2 心肌细胞LDH 的影响
如图2 所示,对照组LDH 释放量为13.45%,模型组中LDH 释放量升高至70.12%,Rge 低、中、高浓度组的LDH 释放量分别为61.81%、46.12%和23.18%。与模型组相比,Rge 低、中、高浓度组LDH 的释放量呈现剂量依赖性降低,表明Rge能够抑制LDH 的释放量抵抗H2O2造成的氧化应激损害从而减轻细胞膜的破坏。
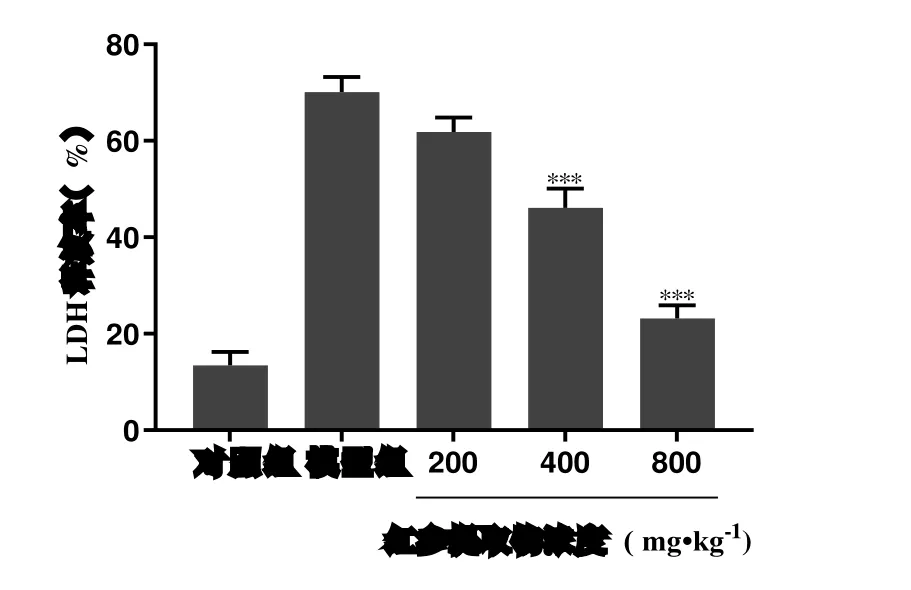
图2 Rge 对H2O2 诱导H9c2 心肌细胞LDH 的影响
2.3 Rge 对H2O2 诱导H9c2 心肌细胞凋亡的影响
与对照组相比,模型组和CCCP 组产生明显绿色荧光,红色荧光相对减弱,表明成功建立H9c2 心肌细胞氧化损伤模型。与模型组和CCCP组相比,Rge 低、中、高浓度组绿色荧光呈剂量依赖性降低,表明Rge 可以控制线粒体膜电位的下降,抑制H9c2 心肌细胞的凋亡,见图3。
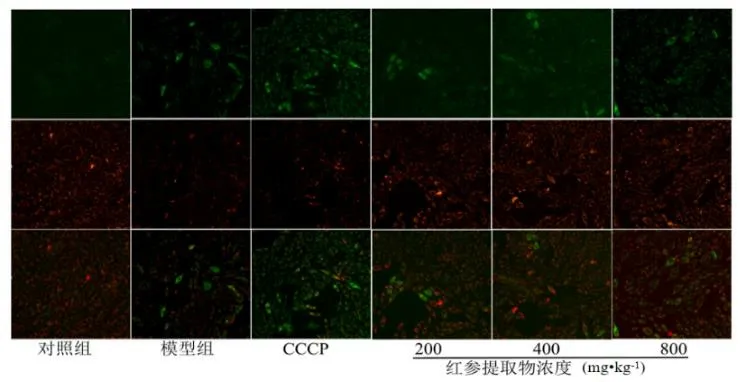
图3 JC-1 法评价Rge 对H2O2 诱导H9c2 心肌细胞凋亡的影响(×200)
另外,Western blot结果显示:与对照组相比,模型组中Caspase-3 蛋白表达水平明显增加,达到2.2 倍(P<0.01);与模型组相比,Rge 低、中、高浓度组中Caspase-3 和Bax蛋白表达水平随着Rge浓度增加依次降低了51.29%、78.26%、78.75% 和24.41%、34.13%、79.47%,而Bcl-2 蛋白表达水平依次增加了12.97%、24.46%和24.59%,详细见图4。
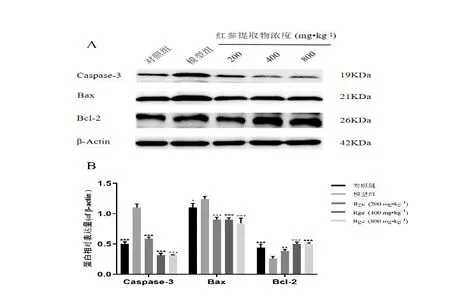
图4 Western blot 法评价Rge 对H2O2 诱导H9c2 细胞Caspase-3、Bax、Bcl-2 蛋白的表达
3 讨论
氧化应激反应是引发心肌细胞损伤的主要病理机制之一[11]。若机体长期处于氧化损伤状态会造成心肌组织细胞大量死亡,从而引发心力衰竭等严重疾病。H2O2能参与体内较多重要的胞内反应,如转录因子的激活,但是当H2O2在细胞内聚集过多时,则加剧氧化应激反应,造成心肌细胞凋亡,为了尽可能的重现临床上氧化损伤心肌病变的进程,我们利用H2O2构建体外氧化损伤模型[12-14]。在评价Rge 对H9c2 心肌细胞活力影响的实验中发现,Rge 能以剂量依赖性的方式提高H9c2 心肌细胞的细胞活力,从而抵抗H2O2导致的氧化损伤。LDH 释放量可是评价细胞活力和细胞膜完整性的关键指标[15,16]。处于氧化损伤状态的心肌细胞,其细胞膜完整性受损,导致LDH 大量释放,使细胞损伤进一步加重。我们发现Rge能够抑制LDH 的释放,表明Rge 能够保护细胞膜的完整性,减轻细胞损伤。过激的氧化损伤可导致细胞凋亡[17,18]。线粒体膜电位的下降是细胞处于凋亡早期的标志之一。JC-1 试剂盒能通过荧光颜色的改变判断线粒体膜电位的变化,从而衡量细胞凋亡的状态。Rge 低、中、高浓度组线粒体基质内的红色荧光随着Rge浓度的增加而逐渐明亮,并且胞质内的绿色荧光逐渐消失,因此,Rge 能抑制线粒体膜电位的下降,减轻H9c2 心肌细胞的氧化损伤,阻断H9c2心肌细胞的凋亡。细胞凋亡是H9c2 心肌细胞氧化损伤的重要过程,研究Rge 对凋亡的影响可反应Rge 保护心肌细胞氧化损伤的部分机制。Caspase-3 是凋亡中重要的枢纽蛋白,能和Bax 分别启动和调控细胞的凋亡,但该过程可被调控凋亡途径的抗凋亡蛋白Bcl-2 阻断[19,20]。我们发现,Rge能下调Caspase-3、Bax蛋白的表达和上调Bcl-2 蛋白的表达。因此,Rge 可能通过阻断凋亡途径,增强H9c2 心肌细胞对氧化损害的抵抗作用。
综上,Rge 可能通过促进Bcl-2 蛋白表达并且阻断Caspase-3 和Bax 蛋白表达,从而减轻H2O2致H9c2 心肌细胞的氧化损害,从而增强H9c2 心肌细胞抵抗不利因素的能力,但是否与其他作用机制有关待需进一步研究。

