补肾解毒通络方对Ⅱ型胶原诱导性关节炎大鼠TLR4/IκBα/NF-κB信号通路相关因子的影响
陈倩雯,何奕坤,沈佳莹,杨光辉
1.上海中医药大学,上海 201203;2.上海中医药大学附属曙光医院,上海 201203
类风湿关节炎(rheumatoid arthritis,RA)是以侵蚀性关节炎为主要临床表现的慢性、全身性、自身免疫性疾病,其发病率在自身免疫性疾病中居首位,基本病理表现为滑膜炎症、血管增生、滑膜增厚及滑膜纤维化改变,若不及时干预或治疗不当,极易导致关节畸形、功能丧失,具有较高的致畸率和致残率,严重者可伴发关节外系统受累,甚至有生命危险[1]。目前RA病因及发病机制尚未阐明,但普遍认为主要由免疫系统紊乱攻击关节形成的慢性炎症所致[2-3]。全身性免疫失衡伴随滑膜和关节的局部炎症浸润贯穿RA的整个过程[4]。Toll样受体(TLR)是炎症信号转导的门户蛋白,其中TLR4是最早发现的TLR受体家族的一员,可通过激活核因子κB抑制蛋白α(IκBα)、核因子(NF)-κB信号通路介导RA的免疫炎症反应,在RA病程进展中具有重要作用[5]。补肾解毒通络方是上海中医药大学附属曙光医院风湿免疫科治疗RA的有效方剂,具有补肾助阳、解毒消肿、祛瘀通络、通利关节功效[6]。前期研究表明,本方治疗RA临床疗效显著[7-9],可明显降低RA患者血清白细胞介素(IL)-6、IL-8和肿瘤坏死因子(TNF)-α水平,具有良好的抗炎作用[10]。本研究基于TLR4/IκBα/NF-κB通路观察补肾解毒通络方对胶原诱导性关节炎(CIA)模型大鼠的影响,探讨其抗炎作用机制。
1 实验材料
1.1 动物
SPF级雌性SD大鼠32只,体质量(180±20)g,北京维通利华实验动物技术有限公司提供,动物许可证号SCXK(浙)2019-0001。大鼠饲养于上海中医药大学实验动物中心,温度(22±2)℃,相对湿度53%~57%,12 h光照,自由摄食饮水。本实验经上海中医药大学实验动物伦理委员会审查批准(PZSHUTCM 190301010)。
1.2 药物
补肾解毒通络方(仙茅12 g,淫羊藿12 g,续断15 g,肿节风30 g,青风藤15 g,忍冬藤30 g,赤芍9 g,莪术30 g,牡丹皮9 g,片姜黄15 g,全蝎3 g,乌梢蛇9 g,甘草6 g),饮片购自上海中医药大学附属曙光医院中药房,使用纯水煎煮2次,合并滤液,浓缩成含原药材1.95 g/mL,-20 ℃冰箱保存备用。甲氨蝶呤片,上海上药信宜药厂有限公司,批号036190703,蒸馏水配制成0.1 mg/mL药液。
1.3 主要试剂与仪器
牛Ⅱ型胶原,北京博蕾德生物科技有限公司,货号20022;不完全弗氏佐剂(IFA),北京博蕾德生物科技有限公司,货号7002;TLR4兔多克隆抗体,武汉爱博泰克生物,货号A0007;NF-κB p65、IκBα兔单克隆抗体,美国CST公司,货号分别为8242、4812;辣根过氧化物酶标记山羊抗兔IgG,美国Proteintech公司,货号A0208;TNF-α、IL-6、IL-8、IL-10 ELISA试剂盒,江苏酶免实业有限公司,货号分别为MM-0190R1、MM-0175R1、MM-0195R1、MM-0180R1。离心机(北京离心机厂,型号LDZ5-2),组织匀浆器(上海净信科技发展有限公司,型号JX-FSTPRP-24),倒置荧光显微镜(日本Olympus,型号IX71),病理切片机(德国徕卡,型号RM2015),垂直式蛋白电泳槽(美国Bio-Rad公司,货号165-8004),RT-PCR仪(美国ABI公司,型号7500),凝胶成像系统(上海天能科技有限公司,型号5200)。
2 实验方法
2.1 分组、造模及给药
大鼠适应性饲养1周,随机分为正常组、模型组、甲氨蝶呤组、补肾解毒通络方组,每组8只。除正常组外,其余各组均参照文献[11]方法制备CIA大鼠模型。将2 mg/mL牛Ⅱ型胶原溶液和预冷的IFA等体积混合后匀浆器乳化,制成终浓度为1 mg/mL牛Ⅱ型胶原/IFA乳剂。分别在大鼠背部、左后足脚面注射0.2 mL牛Ⅱ型胶原/IFA乳剂,尾根部2 cm处注射0.1 mL牛Ⅱ型胶原/IFA乳剂进行首次免疫,诱导大鼠发生炎症,造模当日记为第0日;7 d后以0.1 mL/只在大鼠尾根部3 cm处注射牛Ⅱ型胶原/IFA乳剂进行二次免疫。正常组在相同时间、相同部位注射等体积生理盐水。造模第14日后开始给药,按人与大鼠体表面积换算给药剂量(按60 kg成人临床等效剂量6倍),甲氨蝶呤组按照1 mg/kg灌胃,每周1次;补肾解毒通络方组按照10 mL/kg灌胃,每日1次;正常组和模型组给予等体积生理盐水灌胃,连续21 d。
2.2 取材
治疗结束后以舒泰50(60 mg/kg)肌肉注射麻醉大鼠,腹主动脉采血后迅速离断后肢,剥离膝关节处皮肤,分离肌肉,露出膝盖骨,继续向下分离,可见平滑光亮的滑膜组织,用手术刀分离关节囊的滑膜层和纤维层,取出一侧膝关节滑膜组织,另一侧用剪骨刀分离膝关节后立即置于4%多聚甲醛溶液中固定。同法取出大鼠双侧踝关节滑膜组织,迅速投入液氮中,-80 ℃冰箱保存备用。
2.3 观察指标
2.3.1 一般状况
观察大鼠毛色、饮食、精神状态变化及关节肿胀情况,每隔7 d测量并记录大鼠体质量。
2.3.2 关节炎指数
造模后依据大鼠关节肿大、变形、红肿状况,采用五级评分法[7]对大鼠关节炎症进行判定。0分表示无关节炎;1分表示关节出现红肿,症状轻微;2分表示中度红肿;3分表示严重红肿;4分表示关节严重肿胀并出现功能障碍。关节炎指数为4个关节炎症评分之和,每个关节评分最高为4分,总分最高为16分。每隔7 d进行评估并记录。
2.3.3 足趾厚度
造模后每隔7 d用游标卡尺测量并记录大鼠左后足趾厚度,选取大鼠足趾中部位置,垂直方向进行测定,连续测量3次,取平均值。
2.3.4 血清炎症因子
大鼠麻醉后腹主动脉采血,置于4 ℃冰箱静置5 h,4 ℃、4 000 r/min离心10 min,收集上层血清,ELISA试剂盒检测大鼠血清IL-6、IL-8、IL-10和TNF-α含量,严格按试剂盒说明书进行操作。
2.4 Western blot检测
每组随机取4只大鼠膝关节滑膜组织,每个组织称取20 mg,置于2 mL EP管,加入200 μL裂解液,匀浆5 min,4 ℃、13 000 r/min离心10 min,吸取上清液,BCA法测定蛋白浓度,制备蛋白样品;以每孔20 μg蛋白上样,每个样品设2个复孔,进行SDS-PAGE,先80 V电泳30 min,再调整为100 V电泳30 min;湿转法100 V恒压转膜120 min;以5%脱脂牛奶置于摇床上封闭20 min;加入TLR4、NF-κB p65、IκBα一抗,4 ℃孵育过夜,PBS-T清洗3次;加入辣根过氧化物酶标记山羊抗兔IgG孵育2 h,PBS-T清洗3次;ECL发光液显影,全自动凝胶成像系统观察并拍照,以GAPDH为内参,Image J软件计算蛋白灰度值。
2.5 RT-PCR检测
每组随机取4只大鼠膝关节滑膜组织,每个组织称取50 mg,将滑膜组织研磨成粉末,加入Trizol,离心柱法提取滑膜组织总RNA,反转录为cDNA,进行RT-PCR,引物由上海生工公司合成。引物序列见表1。以ABI实时荧光定量PCR仪监测记录数据,反应条件:95 ℃预变性5 min,95 ℃变性10 s,60 ℃、30 s,共40个循环。以GAPDH为内参,采用2-ΔΔCt法计算各mRNA相对表达量。

表1 各基因PCR引物序列
2.6 HE染色
将大鼠膝关节标本置于4%多聚甲醛固定液中固定1周,用15%EDTA-Na2溶液脱钙7周,彻底脱去钙盐后常规石蜡包埋,每个标本沿正中矢状面切片(厚度5~7 μm),二甲苯脱蜡,HE染色,梯度乙醇脱水,封片,镜下观察膝关节滑膜组织病理变化。
3 统计学方法
采用GraphPad Prism 8.0.1统计软件进行分析。实验数据以±s表示,服从正态分布用方差分析,不服从正态分布用非参数检验,组间比较用多个独立样本比较的秩和检验。P<0.05表示差异有统计学意义。
4 结果
4.1 补肾解毒通络方对模型大鼠一般状况的影响
正常组大鼠形体丰满,活动灵敏,精神、饮食正常,毛发光亮;模型组大鼠形体消瘦,活动缓慢,关节肿胀,足趾皮肤发红,以左后足趾关节为甚,后足拖地跛行,饮食减少,精神萎靡,毛发稀疏黯淡少光泽;甲氨蝶呤组和补肾解毒通络方组大鼠关节肿胀程度减轻,活动虽缓慢但无跛行,精神尚可,饮食增加,毛发略稀疏。造模前各组大鼠体质量无明显差异;二次免疫后,各组大鼠体质量增长较为缓慢,造模第14日,与正常组比较,模型组及甲氨蝶呤组大鼠体质量差异有统计学意义(P<0.05);造模第21、28、35日,与正常组比较,各组大鼠体质量差异均有统计学意义(P<0.05,P<0.01)。见表2。
表2 各组大鼠造模不同时点体质量比较(±s,g)
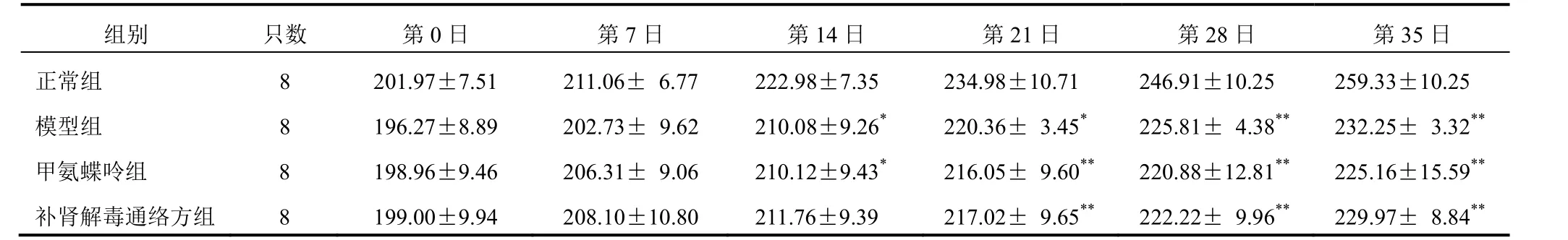
表2 各组大鼠造模不同时点体质量比较(±s,g)
注:与正常组比较,*P<0.05,**P<0.01
组别 只数 第0日 第7日 第14日 第21日 第28日 第35日正常组 8 201.97±7.51 211.06± 6.77 222.98±7.35 234.98±10.71 246.91±10.25 259.33±10.25模型组 8 196.27±8.89 202.73± 9.62 210.08±9.26* 220.36± 3.45* 225.81± 4.38** 232.25± 3.32**甲氨蝶呤组 8 198.96±9.46 206.31± 9.06 210.12±9.43* 216.05± 9.60** 220.88±12.81** 225.16±15.59**补肾解毒通络方组 8 199.00±9.94 208.10±10.80 211.76±9.39 217.02± 9.65** 222.22± 9.96** 229.97± 8.84**
4.2 补肾解毒通络方对模型大鼠关节炎指数的影响
造模第7日,与正常组比较,各组大鼠关节炎指数明显升高(P<0.01),二次免疫后,各组大鼠关节炎指数显著升高,并在造模第14日达到峰值;造模第28、35日,与模型组比较,甲氨蝶呤组和补肾解毒通络方组大鼠关节炎指数明显降低(P<0.01);造模第35日,与甲氨蝶呤组比较,补肾解毒通络方组大鼠关节炎指数明显降低(P<0.01)。见表3。
表3 各组大鼠造模不同时点关节炎指数比较(±s,分)

表3 各组大鼠造模不同时点关节炎指数比较(±s,分)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01;与甲氨蝶呤组比较,△△P<0.01
组别 只数 第0日 第7日 第14日 第21日 第28日 第35日正常组 8 0 0 0 0 0 0模型组 8 0 5.62±0.91** 8.12±0.64** 7.87±0.35** 7.25±0.70** 6.75±0.46**甲氨蝶呤组 8 0 5.60±0.91** 8.00±0.53** 6.50±0.76## 3.62±0.74## 2.37±0.51##补肾解毒通络方组 8 0 5.37±0.74** 7.88±0.64** 7.12±0.83 3.62±0.74## 1.62±0.51##△△
4.3 补肾解毒通络方对模型大鼠足趾厚度的影响
造模第7日,与正常组比较,各组大鼠足趾明显肿胀发红,左后足趾厚度明显增加,差异有统计学意义(P<0.01),二次免疫后,各组大鼠左后足趾厚度显著增加,并在造模第14日达到峰值;造模第28、35日,与模型组比较,甲氨蝶呤组和补肾解毒通络方组大鼠足趾肿胀明显减轻,左后足趾厚度明显减少,差异有统计学意义(P<0.01)。见表4、图1。
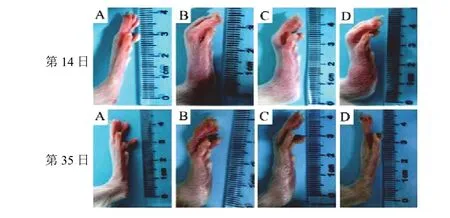
图1 各组大鼠给药前后左后足趾形态
表4 各组大鼠造模不同时点左后足趾厚度比较(±s,mm)

表4 各组大鼠造模不同时点左后足趾厚度比较(±s,mm)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01
组别 只数 第0日 第7日 第14日 第21日 第28日 第35日正常组 8 3.98±0.20 4.03±0.19 4.15±0.14 4.23±0.18 4.29±0.18 4.35±0.17模型组 8 3.94±0.19 6.28±0.56** 8.65±0.77** 8.43±0.49** 8.21±0.52** 7.63±0.55**甲氨蝶呤组 8 3.88±0.28 6.02±0.57** 8.80±0.95** 6.98±0.60## 6.01±6.01## 5.16±0.23##补肾解毒通络方组 8 3.99±0.19 6.21±0.49** 8.50±1.01** 7.69±0.79 5.72±0.36## 5.00±0.15##
4.4 补肾解毒通络方对模型大鼠血清炎症因子含量的影响
与正常组比较,模型组大鼠血清IL-6、IL-8和TNF-α含量显著增加,IL-10含量显著减少,差异有统计学意义(P<0.01);与模型组比较,甲氨蝶呤组和补肾解毒通络方组大鼠血清IL-6、IL-8和TNF-α含量显著减少,IL-10含量显著增加,差异有统计学意义(P<0.01);与甲氨蝶呤组比较,补肾解毒通络方组大鼠血清IL-8含量显著减少,差异有统计学意义(P<0.01)。见表5。
表5 各组大鼠血清IL-6、IL-8、TNF-α、IL-10含量比较(±s,pg/mL)

表5 各组大鼠血清IL-6、IL-8、TNF-α、IL-10含量比较(±s,pg/mL)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01;与甲氨蝶呤组比较,△△P<0.01
组别 只数 IL-6 IL-8 TNF-α IL-10正常组 8 61.91± 2.27 52.47±1.32 62.11±4.08 68.96±5.91模型组 8 139.08± 8.98** 142.34±2.56** 164.41±4.31** 31.42±4.02**甲氨蝶呤组 8 76.50±10.47## 107.03±7.01## 81.17±4.75## 61.65±5.18##补肾解毒通络方组 8 75.40± 9.42## 86.37±8.33##△△ 75.51±8.48## 67.49±6.47##
4.5 补肾解毒通络方对模型大鼠膝关节滑膜组织TLR4、NF-κB p65、IκBα蛋白表达的影响
与正常组比较,模型组大鼠膝关节滑膜组织TLR4、NF-κB p65蛋白表达明显升高,IκBα蛋白表达明显降低,差异均有统计学意义(P<0.01);与模型组比较,甲氨蝶呤组和补肾解毒通络方组大鼠膝关节滑膜组织TLR4、NF-κB p65蛋白表达明显降低,IκBα蛋白表达明显升高,差异均有统计学意义(P<0.01,P<0.05)。见表6、图2。
表6 各组大鼠膝关节滑膜组织TLR4、NF-κB p65、IκBα蛋白表达比较(±s)
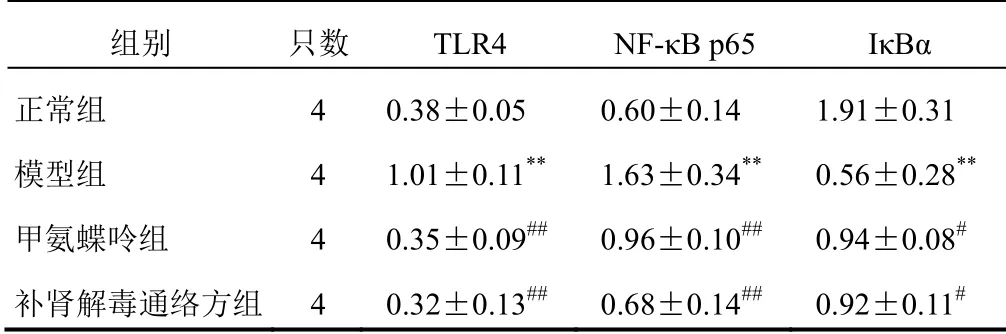
表6 各组大鼠膝关节滑膜组织TLR4、NF-κB p65、IκBα蛋白表达比较(±s)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
组别 只数 TLR4 NF-κB p65 IκBα正常组 4 0.38±0.05 0.60±0.14 1.91±0.31模型组 4 1.01±0.11** 1.63±0.34** 0.56±0.28**甲氨蝶呤组 4 0.35±0.09## 0.96±0.10## 0.94±0.08#补肾解毒通络方组 4 0.32±0.13## 0.68±0.14## 0.92±0.11#
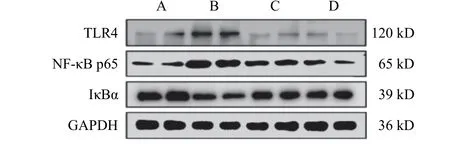
图2 各组大鼠膝关节滑膜组织TLR4、NF-κB p65、IκBα蛋白免疫印迹图
4.6 补肾解毒通络方对模型大鼠膝关节滑膜组织TLR4、NF-κB p65、IκBα mRNA表达的影响
与正常组比较,模型组大鼠膝关节滑膜组织TLR4、NF-κB p65 mRNA表达明显升高(P<0.01),IκBα mRNA表达明显降低(P<0.01);与模型组比较,甲氨蝶呤组和补肾解毒通络方组大鼠膝关节滑膜组织TLR4、NF-κB p65 mRNA表达明显降低(P<0.01,P<0.05),IκBα mRNA表达明显升高(P<0.01)。见表7。
表7 各组大鼠膝关节滑膜组织TLR4、NF-κB p65、IκBα mRNA表达比较(±s)
表7 各组大鼠膝关节滑膜组织TLR4、NF-κB p65、IκBα mRNA表达比较(±s)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
组别 只数 TLR4 NF-κB p65 IκBα正常组 4 0.34±0.02 0.27±0.06 1.89±0.31模型组 4 1.08±0.18** 1.34±0.26** 0.53±0.07**甲氨蝶呤组 4 0.45±0.07## 0.86±0.13# 1.78±0.45##补肾解毒通络方组 4 0.40±0.12## 0.67±0.33## 1.80±0.22##
4.7 补肾解毒通络方对模型大鼠膝关节滑膜组织病理形态的影响
正常组大鼠膝关节及周围组织结构正常,无特殊病理改变,滑膜组织成纤维细胞排列整齐,滑膜无增生,滑膜血管分布正常,管壁光滑,关节腔中无炎性细胞浸润;模型组大鼠膝关节滑膜组织增生,滑膜细胞排列紊乱,组织内新生毛细血管增多,管壁粗糙,有较多淋巴细胞及单核细胞浸润;甲氨蝶呤组大鼠膝关节滑膜组织局部轻度增生,血管增多,管壁粗糙增厚,可见少量淋巴细胞及单核细胞;补肾解毒通络方组大鼠膝关节滑膜组织无明显增生,血管无明显增多,有少量淋巴细胞及单核细胞。见图3。
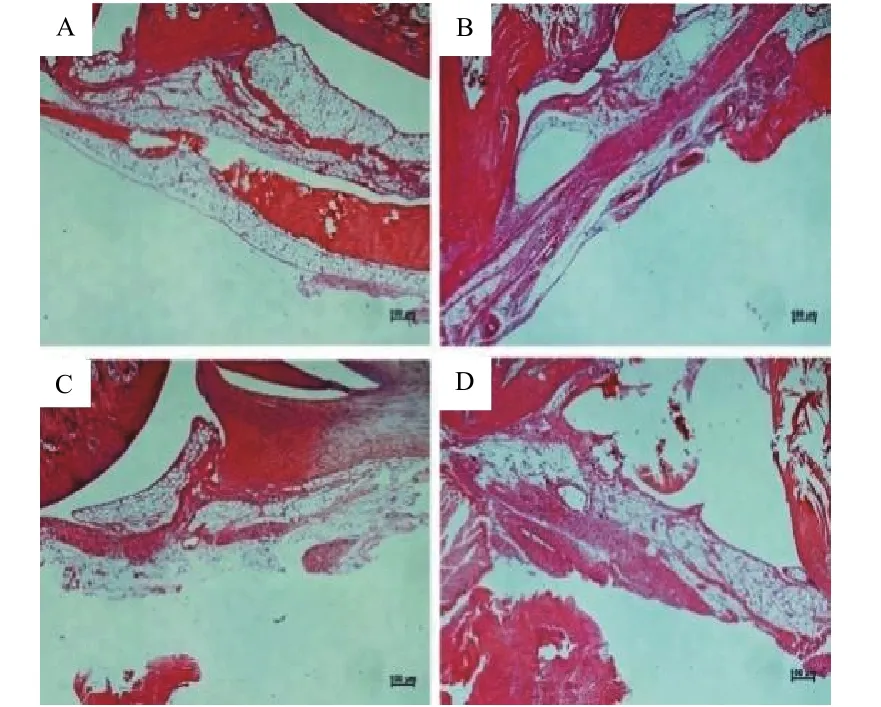
图3 各组大鼠膝关节滑膜组织形态(HE染色,bars=100 μm)
5 讨论
免疫机制的触发是引发RA病变的主要原因,促炎性细胞因子的不断释放及炎症信号通路的异常激活在这一机制中起关键作用[12-13]。已有研究表明,TLR4/IκBα/NF-κB信号通路与RA密切相关,其激活能启动多个下游炎症信号通路的级联反应,促进炎症因子IL-6、TNF-α等分泌,抑制抗炎因子IL-10的产生,在RA炎症、关节破坏及相关合并症中起关键作用[14-15]。目前该通路下游2个炎症因子TNF-α和IL-6已被作为RA临床治疗药物靶标,可通过抑制全身免疫反应和局部关节滑膜组织炎症延缓RA病情[13]。
RA属中医学“痹证”范畴,其病因常涉及风、寒、湿、热等外淫邪气与肝、脾、肾三脏。而“肾虚毒蕴络阻”是导致RA发生的关键病机[6]。其中,肾虚是导致RA骨关节病变发生的根本原因,肾主骨生髓,肾虚则无以藏精、无以御邪,致骨与关节失荣失养,若此时恰逢风、寒、湿、热等外淫邪气入侵机体,则易演变发展为痹证。毒邪是RA发生的主要致病因素,致病势缠绵反复,病性顽固,且极易侵犯人体其他脏腑,难以根治。“毒邪”致病病势急、病情重、致病广泛且极易与六淫邪气相合,符合RA发病特点,与现代医学所说的免疫炎症反应过程极为相似。络脉受损贯穿RA全病程,络脉伏行于分肉之间,外接关节肌肉,内连五脏六腑。RA初起病位在浅表脉络,患者以项背拘挛、关节酸胀麻木为主要临床表现,若病情迁延,日久不愈,血行不畅,阻滞于深层脉络则会损筋伤骨,出现关节肿胀、屈伸不利甚至畸变,后期若侵犯脏腑深部脉络,则极易出现肺、心包及肾络的损伤。补肾解毒通络方中以淫羊藿、仙茅、续断为君,温肾助阳、祛风除湿、强筋健骨,此以二仙汤为基础温补肾阳,强肾而不燥热,益精而无凝滞;臣以肿节风、忍冬藤、青风藤解毒消肿,片姜黄、乌梢蛇、全蝎通络止痛,其中虫类药物有穿透筋骨、通达经络、破瘀消坚之功;佐以活血药物牡丹皮、赤芍祛瘀通络,阻断瘀毒形成,以松透病根,使络脉通利,血行畅达。诸药相配,肾虚得补,瘀毒得解,络阻得通,关节得养。前期研究发现,补肾解毒通络方能减少RA患者血清炎症因子IL-6、IL-8和TNF-α含量[10]。本研究从TLR4/IκBα/NF-κB炎症通路入手,探讨补肾解毒通络方对RA的治疗作用及其机制,为深入研究其机制及中医药治疗RA提供实验依据。
TLR4是一种模式识别受体[16],广泛表达于上皮细胞、内皮细胞及免疫细胞表面,可对不同病原相关分子模式进行识别、结合并引发一系列的信号转导,在天然免疫及获得性免疫中具有重要作用,与慢性炎症、肿瘤及自身免疫性疾病紧密相关[17-19]。RA发病触发机体免疫反应,TLR4可识别并激活机体的免疫细胞,进行免疫应答并激发机体的抗微生物防御体系,促使炎症介质及趋化因子释放,同时启动多个下游炎症信号通路转导[14-15]。NF-κB是经典的TLR4下游炎症信号转录因子,主要由2个亚单位p65和p50结合成二聚体或异二聚体,有明显的促炎活性。在静息状态下,p65/p50二聚体与IκB抑制蛋白家族结合,形成一个稳定的三聚体存在于细胞质中[20]。当受到细胞因子、有丝分裂原等细胞外信号刺激时,IκB从三聚体中解离出来,释放p65/p50进行核移位,与基因上的κB位点进行特异性结合,从而启动多种炎症基因的表达[21]。IκBα是IκB家族中的一员,是NF-κB蛋白的主要抑制剂[22],当细胞外刺激发生时,上游信号通路(通常是TLR4信号通路)的级联反应首先激活IκB激酶复合物,使IκBα发生泛素化、磷酸化并降解,降解的IκBα从NF-κB中解离,使NF-κB的2个亚单位活化,并从细胞质转移到细胞核(尤其是p65亚单位),与相应的炎症基因结合,启动炎性细胞因子转录,释放IL-6、IL-8、TNF-α等促炎因子[23]。IL-10是细胞介导免疫反应的负调节物,能抑制前列腺素E2和促炎因子如TNF-α、IL-1、IL-6、IL-8的产生。本研究结果显示,补肾解毒通络方治疗后,大鼠膝关节滑膜组织TLR4、NF-κB p65蛋白及mRNA水平明显降低,IκBα蛋白及mRNA水平升高,说明补肾解毒通络方能显著抑制TLR4/IκBα/NF-κB信号通路转导,抑制促炎因子IL-6、IL-8和TNF-α释放,促进抗炎因子IL-10产生,减轻大鼠滑膜炎症反应,进一步抑制大鼠关节组织损伤。
综上所述,RA病情与TLR4/IκBα/NF-κB信号通路的激活有关,补肾解毒通络方能抑制该通路的激活,抑制促炎因子IL-6、IL-8和TNF-α释放,促进抗炎因子IL-10产生,显著改善RA炎症反应。本实验初步探讨了补肾解毒通络方干预RA的作用机制,但未考察不同剂量补肾解毒通络方的作用效果,今后研究可进一步明确量效关系。
致谢:感谢上海中医药大学附属曙光医院肾病研究所李东东博士为本实验提供技术指导。

