食用菌对鸭肉乳化肠冷藏过程中理化品质与安全特性的影响
孙 金,陈坤朋,夏 强,孙杨赢,潘道东
(宁波大学食品与药学学院,浙江省动物蛋白食品精深加工技术重点实验室,浙江宁波 315800)
鸭肉乳化肠(简称鸭肉肠)中脂肪含量较高,虽然脂肪能够显著影响肉制品风味和多汁性,但在贮藏过程中脂肪氧化会造成肉制品品质显著劣化,如产生令人不愉快的气味,造成有益成分破坏以及形成有毒化合物等。脂质氧化一直被认为是影响肉制品加工中品质和保质期的主要问题。此外,香肠腐败还与微生物的作用密切相关[1]。为解决上述问题,亚硝酸钠等人工合成食品添加剂在香肠加工应用普遍[2],但是随着消费者对健康和功能性香肠的需求不断增加,越来越多的企业和研究者开始寻找新型天然抗氧化剂[3]。
近些年来,各种食用菌因富含多种活性成分而越来越受到消费者的青睐。例如,已有多份研究证实香菇具有多种生物活性物质,如活性多糖、酚类物质等,表现出明显的抗氧化、抗炎、抗肿瘤和抗菌效应,以及免疫调节作用[4-6]。松露是一种含有多种抗氧化物质的天然食材,同时富含蛋白质、维生素、矿物质等营养元素[7-8]。松茸主要含有多糖、氨基酸、甾类、萜类和脂肪酸等多种活性物质成分,具有抗肿瘤、抗氧化、抗衰老、调节免疫力等作用[9]。因此,基于体外显著的抗氧化和抑菌效应,有研究提出以食用菌粉作为食品辅料可能是一种可行且安全经济的抗氧化策略[10-11]。前期研究已经表明,将香菇、松露和松茸三种食用菌添加到鸭肉乳化肠中可明显提高鸭肉肠的食用品质,感官上具有更好的整体可接受性[12],但该方法对鸭肉乳化肠储藏过程中的理化变化及品质影响未进行评估。
鉴于此,为了更进一步研究食用菌鸭肉乳化肠贮藏期间的理化特性及生物安全性,本文探究了食用菌粉添加对鸭肉肠在贮藏期间的品质及安全性的影响,即冷藏21 d过程中乳化肠理化特性、持水性、酚类物质含量、硫代巴比妥酸反应物(TBARS)、挥发性盐基氮(TVB-N)和菌落总数等参数的变化,以期为减少亚硝酸盐等人工添加剂在肉制品中的使用及鸭肉肠的实际生产应用提供一定的参考。
1 材料和方法
1.1 材料与仪器
香菇、松茸、黑松露 云南拇指菌业有限公司;羊肠肠衣 河清肠衣有限公司;鸭胸肉 河南华英农业发展股份有限公司;猪背膘以及辅料亚硝酸钠、磷酸盐(食品级)市购;福林-酚试剂 索莱宝生物科技有限公司;没食子酸、硫代巴比妥酸 国药试剂有限公司;盐酸平板计数琼脂(PCA) 杭州微生物试剂有限公司。
CR-440 色差仪 柯尼卡美能达办公系统(中国)有限公司;XHF-D高速分散器 宁波新芝生物科技有限公司;BJRJ-82型绞肉机 嘉兴艾博实业有限公司;BZBJ-20型斩拌机 嘉兴艾博实业有限公司;Infinte 200PRO型酶标仪 瑞士Tecan公司;RE-2000A旋转蒸发器 西安禾普生物科技有限公司;5804R艾本德冷冻离心机 德国艾本德股份有限公司;SW-CJ-2FD型双人单面净化工作台 上海右一仪器有限公司;HSW型智能恒温恒湿培养箱 浙江宁波江南仪器厂;FE20 pH计 梅特勒-托利多仪器有限公司;BVPJ-500TS真空包装机 嘉兴艾博实业有限公司。
1.2 试验方法
1.2.1 食用菌粉的制备 将购买的食用菌干品去除杂质后,用高速搅拌机将其粉碎,过100目筛后制备成三种食用菌粉,分别为香菇粉(LEP)、松露粉(TRP)和松茸粉(TMP)。在干燥条件下保存,以供后续试验使用。
1.2.2 鸭肉乳化肠的生产工艺 参照Sousa等[13]的方法略作修改制备鸭肉肠。将鸭胸肉剔除多余的脂肪和结缔组织,将其和猪背膘切块后分别使用6 mm孔板绞肉机搅碎。将鸭胸肉(3.2 kg)、猪背膘(0.8 kg)、食盐(80 g)、谷氨酰胺转氨酶(12 g)、β-环糊精(4 g)、复合磷酸盐(16 g)、花椒粉(1.6 g)、冰水(800 g)放入斩拌机中斩拌。生产5种不同处理方式的鸭肉肠,其中食用菌粉及亚硝酸钠(NaNO2)添加量根据Choe等[14]和Pil-Nam等[15]的研究,基于鸭胸肉及猪背膘的总质量比例(w/w)添加,种类如下:
a. 空白组(C):不添加食用菌粉,不添加NaNO2;b. NaNO2组(NC):不添加食用菌粉,添加0.01%NaNO2;c. 香菇鸭肉肠组(LE):添加0.8%香菇粉,不添加NaNO2;e. 松露鸭肉肠组(TR):添加0.8%松露粉,不添加NaNO2;f. 松茸鸭肉肠组(TM):添加0.8%松茸粉,不添加NaNO2。
对于每个处理组,首先将绞碎的鸭胸肉放入斩拌机中,低速斩拌10 s,逐渐加入食用盐、磷酸盐、谷氨酰胺转氨酶、花椒粉和食用菌粉高速斩拌1 min,然后添加三分之一的冰水并高速斩拌2 min。最后加入绞碎的猪背膘,并逐渐加入剩余的冰水,高速斩拌5 min。
将斩拌好的肉糜灌入天然肠衣中,生产三批次产品,每批次5种鸭肉肠,在75 ℃条件下蒸煮40 min,冷却后晾干,于4 ℃条件下保存备用。
生产完成的样品真空包装后,放入4 ℃冰箱贮藏,分别在第0、7、14、21 d取样分析。
1.2.3 鸭肉肠的理化指标 水分含量测定参考GB 5009.3-2016《食品安全国家标准 食品中水分的测定》[16],分别在第0 d及第21 d取样分析。
色泽使用CR-440型色差仪测定,并由CIE Labsystem中的L*(亮度值)、a*(红度值)和b*(黄度值)参数表示。每种样品测量4次,每次测定前将鸭肉肠切成均一的薄片,光源为D65,采用10°角观察,分别在第0 d及第21 d取样分析。
pH测量方法:取3 g样品搅碎,加入27 mL去离子水。匀浆30 s后,6000×g离心20 min,用pH计测量。
1.2.4 鸭肉肠持水性测定 持水性的测定用蒸煮损失率和保水性衡量。
1.2.4.1 蒸煮损失率测定 将灌注好预蒸煮的鸭肉肠称重,质量为M1(g),将蒸煮后的鸭肉肠取出,冷却后用滤纸将鸭肉肠中的水分擦干,称重质量M2(g),蒸煮损失率是基于原料的重量计算的百分比,计算方法如下:
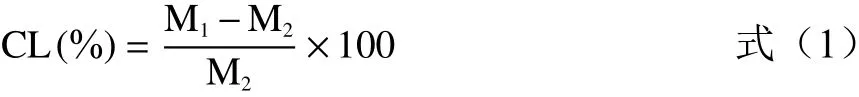
1.2.4.2 保水性测定 保水性(WHC)测定参考Verbeken等[17],取(3.0±0.3 g)剪碎的鸭肉肠样品,在(4 ℃,12000×g)下离心35 min,计算公式如下:

式中:Wa离心后鸭肉肠样品质量;Wb离心前鸭肉肠样品质量。
为了测量持水性在贮藏期间的稳定性,测定4 ℃条件下保藏0、7、14、21 d后的鸭肉肠的保水性。
1.2.5 总酚含量测定 鸭肉肠总酚含量测定根据Gómez-Martínez等[18]的方法做简要修改,取鸭肉肠10 g样品剪碎加入10 mL去离子水匀浆后过滤,取滤液0.5 mL样品加入2.5 mL 10倍稀释的福林-酚试剂和2 mL 7.5%的碳酸钠溶液,25 ℃放置30 min,在760 nm处测量吸光度。以没食子酸(GM)溶液作标准曲线,结果表示为mg没食子酸/100 g香肠样品(mg GA/100 g sausage)。
1.2.6 鸭肉肠脂肪氧化测定 硫代巴比妥酸值(Thiobarbituric acid reactive substance, TBARS)根据Wang等[19]的方法测定,其中硫代巴比妥酸反应物使用以下公式计算:
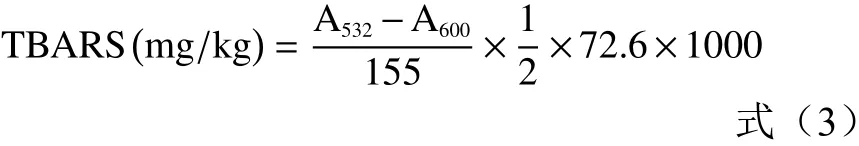
式中:A532、A600分别为待测液在波长532 nm及600 nm处的吸光度。
1.2.7 挥发性盐基氮测定 鸭肉肠中挥发性盐基氮(Total volatile nitrogen,TVN)含量测定参考国标[20]GB 5009.228-2016《食品安全国家标准 食品中挥发性盐基氮的测定》。
1.2.8 鸭肉肠中微生物测定 菌落总数(PCA)的测定参考Liu[21]的方法并作简要修改,在无菌条件下将25 g剪碎的鸭肉肠样品放入装有225 mL无菌生理盐水中,使用均质机拍打3 min,制成1:10的样品匀液,并进行10倍系列稀释。取稀释液100 μL均匀涂布于PCA平板培养基上,每个浓度设置3个平行。同时使用无菌生理盐水作为空白对照,37 ℃培养48 h。
1.3 数据处理方法
本试验数据使用IBM SPSS26进行分析,样品的显著性差异P<0.05,每个试验重复三次。采用Origin 2019进行数据整理和作图。
2 结果与分析
2.1 鸭肉肠的理化特性
食用菌鸭肉乳化肠冷藏前后水分含量(MS)、pH和色差等理化性质的变化结果如表1所示。各组鸭肉肠在贮藏期间水分含量为60.35%~62.22%,在贮藏开始时添加食用菌鸭肉肠的水分含量显著高于对照组(P<0.05),其中添加松茸鸭肉肠组(TM)水分含量最高。这与Stefanello等[22]在猪肉肠中加入姬松茸降低其水分含量结果不同,可能与添加量有关,膳食纤维具有一定的水分保持能力[23],但肉糜制品中膳食纤维的添加量增多可能造成体系中蛋白质-水的凝胶网络结构遭到破坏,从而导致水分的流失。在贮藏期间各组鸭肉肠水分含量均有所降低,其pH在5.90~6.73范围变化,与空白对照相比,添加食用菌组的pH显著增加(P<0.05),但不同食用菌粉鸭肉肠之间pH无显著性差异(P>0.05)。Jo等[24]将食用菌添加入鸡肉乳化肠,Choe等[14]在猪肉乳化肠中添加食用菌,均不同程度地提高了pH,与本研究结果一致,这可能是与食用菌添加导致赖氨酸等碱性氨基酸含量提高有关[25]。贮藏21 d后各组鸭肉肠pH降低,Viuda-Martos等[26]发现真空包装贮藏香肠的pH降低与乳酸菌的产生有关,因而推断食用菌添加有可能抑制了鸭肉肠中乳酸菌微生物的生长。
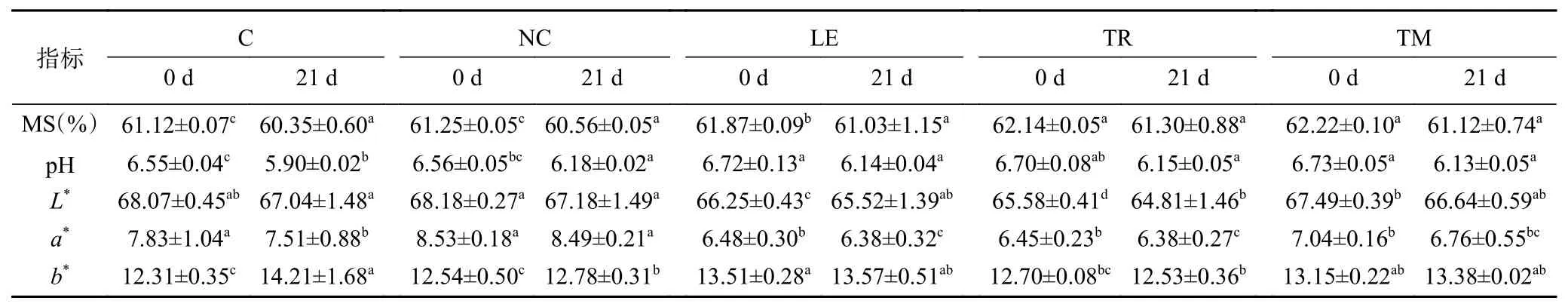
表1 不同食用菌添加鸭肉肠保藏0 d和21 d后的理化性质Table 1 Physical properties of emulsified duck sausages with different kinds of edible mushrooms at day 0 and after 21 days of storage
各组鸭肉肠中在贮藏期间的颜色变化见表1,与对照组(C)相比,NaNO2组(NC)赋予鸭肉肠更高的a*值(P<0.05),但是对鸭肉肠L*和b*没有显著影响(P>0.05),食用菌添加组L*和a*值则不同程度降低,其中以松露添加组(TR)最低,可能是因为松茸粉和香菇粉颜色较浅,而松露本身颜色较深,对鸭肉肠颜色影响大。此外,添加食用菌显著增加了鸭肉肠的b*(P<0.05),多个研究表明天然添加物由于其固有的颜色,从而对肉色产生影响[27]。贮藏21 d后,鸭肉肠L*降低,但各组之间的亮度值则无显著性差异;a*值还与肉品氧化程度关联,因此贮藏期间鸭肉肠a*降低,可能源自脂质氧化。与a*变化情况相反,鸭肉肠b*值在贮藏期间升高,脂肪氧化产物可以诱导亚铁血红蛋白氧化而改变肉色,与对照组(C)组相比,NC组和食用菌组鸭肉肠b*较低,可能是因为其氧化程度较低[28]。Pil-Nam等[15]和Xiang等[29]研究同样表明添加了0.8%和1.2%香菇的法兰克福香肠和添加了桑多酚的粤式香肠红度值升高,黄度值下降。
2.2 持水性结果分析
持水性是指肉品在加工条件下,经过加热、冷藏、风干等处理后保持体系水分的能力。其中肉品中不易流动水是影响其持水性的主要原因,并受蛋白质电荷性质与空间结构的影响。肉制品的持水性主要指标为蒸煮损失与保水性,对产品品质至关重要。蒸煮损失结果如表2所示,对照组和NC组在贮藏初期蒸煮损失率分别为14.50%和14.70%,没有显著性差异(P>0.05),而食用菌组样品与对照组及NC组相比,蒸煮损失率显著降低(P<0.05),其中添加松茸组鸭肉蒸煮损失率为8.11%,松露组鸭肉肠为12.25%,均低于未添加食用菌组。这与食用菌中膳食纤维的吸油性和水合作用有关。研究表明,肉类体系保持水分的能力取决于蛋白质凝胶网结构的形成和亲水胶体截留水分的能力[30],体系加热过程中纤维可以吸水形成凝胶,从而降低了蒸煮损失率。在贮藏期间各组不同贮藏天数鸭肉肠之间蒸煮损失无明显差异。
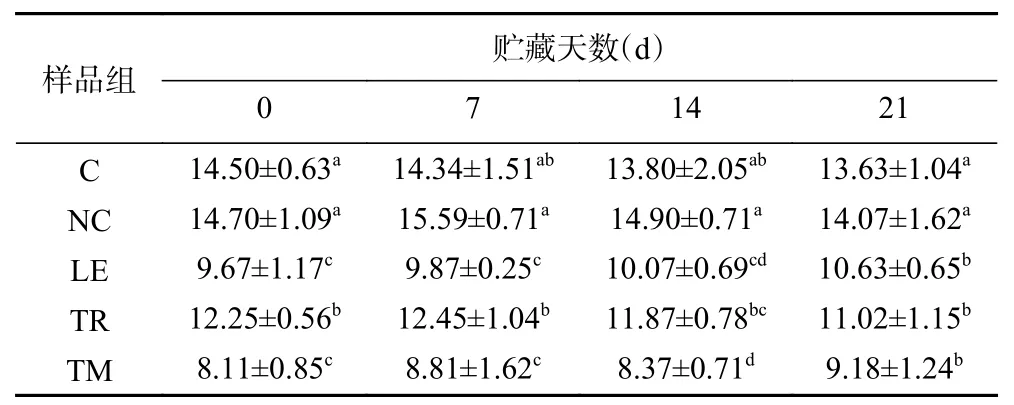
表2 贮藏期间鸭肉乳化肠蒸煮损失率的变化(%)Table 2 Changes on cooking loss rate of emulsified duck sausages with different kinds of edible mushrooms during storage(%)
贮藏期间各组鸭肉肠保水性结果如表3所示,添加食用菌可显著增加鸭肉肠的保水性(P<0.05),在贮藏初始三种食用菌组保水性为81.54%~83.04%,对照组及NC组保水性分别为71.62%和72.64%,显著低于添加组食用菌(P<0.05),其变化趋势与蒸煮损失变化趋势类似。此外,随着贮藏时间的延长,各组鸭肉肠的保水性均有所提高。这可能与产品的自由水含量降低有关,贮藏期间pH不断降低,蛋白质结合水的能力下降,从而导致水分流失到产品外部。因此,保水性测定过程中离心分离的自由水含量下降造成鸭肉肠保水性的增高。
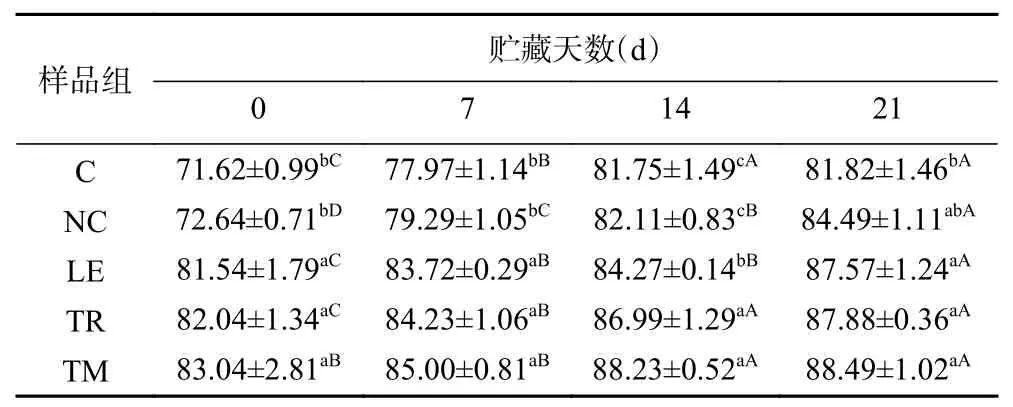
表3 贮藏期间鸭肉乳化肠保水性的变化(%)Table 3 Changes on water-holding capacity of emulsified duck sausages with different kinds of edible mushrooms sausage during storage(%)
2.3 总酚含量变化
三种添加食用菌鸭肉肠中酚类物质的含量变化结果如图1所示,对照组及亚硝酸盐组的总酚含量在0.05~0.13 mg GA/100 g之间,测量值远小于食用菌添加组,图中未显示。食用菌鸭肉肠中初始酚类物质含量变化范围为13.04~17.51 mg GA/100 g香肠样品。由图1可知,贮藏期间食用菌组样品酚类化合物含量逐渐降低。Liu等[21]发现添加迷迭香的鸡肉香肠在贮藏期间酚类物质逐渐降低,与本试验结果一致,推测酚类物质减少与抑制脂肪氧化有关并认为其与贮藏期间抑制脂肪氧化产生有关。Daood等[31]认为在贮藏期间天然产物的抗氧化成分含量会降低并且抗氧化能力减弱,从而导致脂肪氧化的增加。三种食用菌鸭肉肠在贮藏期间的TBARS值显著低于空白对照组(图2),推测酚类物质与抑制脂肪氧化有关。酚类化合物被认为是具有功能性、抑菌活性和抗氧化作用的活性成分,Palacios等[32]研究了食用菌中含有的酚类物质种类,并验证了其对脂肪氧化的抑制作用。
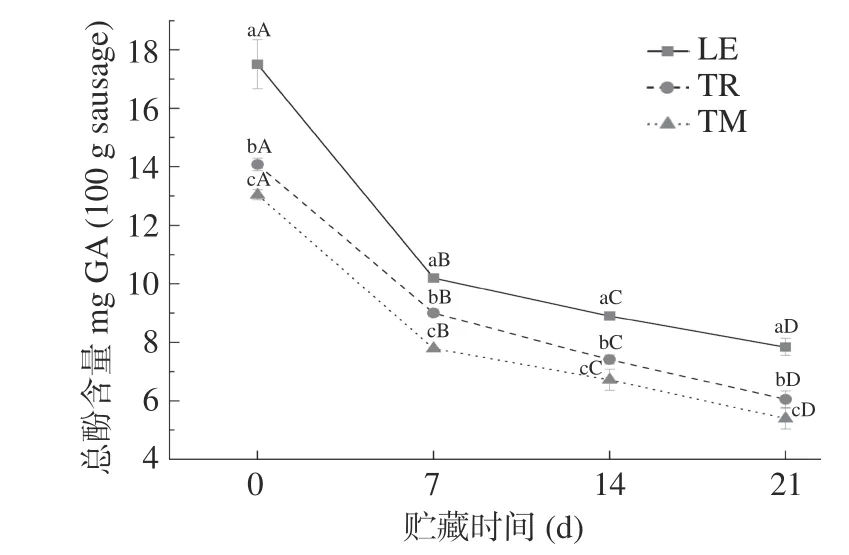
图1 食用菌添加组鸭肉肠总酚含量在贮藏期间的变化Fig.1 Remaining total phenolic content in emulsified duck sausages added with different kinds of edible mushrooms during refrigerated storage
2.4 贮藏期间鸭肉肠脂肪氧化的变化过程
脂肪氧化会产生多种氧化产物,在贮藏过程中对肉制品的品质特性造成影响,TBARS值表示脂质氧化次级产物的水平。如图2所示,TBARS初始值范围0.20~0.25 mg MDA/kg,贮藏期间鸭肉肠的脂肪氧化水平显著增加(P<0.05),在贮藏21 d时,空白组的TBARS值为0.56 mg MDA/kg,NaNO2和食用菌组显著低于空白组(P<0.05),其TBARS值范围为0.35~0.48 mg MDA/kg。在整个贮藏期间,NaNO2添加组脂肪氧化水平最低,其对脂肪氧化的抑制作用与NaNO2被还原为NO从而干扰脂质氧化链式反应有关[33]。食用菌添加鸭肉肠在0 d和7 d时与NaNO2组没有差异性,但是在14 d以后时TBARS开始逐渐上升。以上结果表明,添加食用菌可以降低鸭肉肠贮藏期间的脂肪氧化水平,这与香菇、松露、松茸中含有的多酚和黄酮类物质清除脂质氧化过程形成的自由基有关[34]。
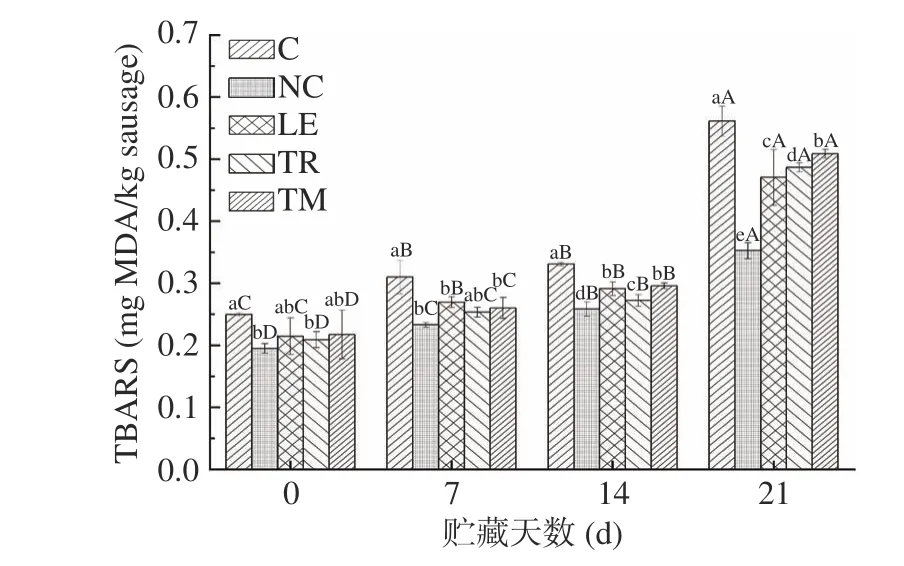
图2 不同食用菌添加鸭肉乳化肠贮藏期间硫代巴比妥酸反应物(TBARS)值变化情况Fig.2 Changes of thiobarbituric acid reactive substance(TBARS) values on emulsified duck sausages with different kinds of edible mushrooms during storage
2.5 贮藏期间鸭肉肠中挥发性盐基氮含量变化
TVB-N值反映了微生物对蛋白质的分解程度,如图3所示,贮藏过程中各组鸭肉肠中的TVB-N含量显著增加(P<0.05),贮藏初始TVB-N值为6.44~13.72 mg/100 g,其中以空白组鸭肉肠含量最高,NaNO2组含量最低,食用菌添加组(LE、TR、TM)分别为10.64、7.65和8.40 mg/100 g。贮藏第21 d时,与空白组相比,NaNO2组、食用菌LE、TR和TM组中TVB-N分别降低32.07%、18.28%、21.38%和21.03%,表明食用菌可显著延缓鸭肉肠在贮藏中的蛋白质降解,这与其含有的具有抗菌性的酚类物质有关。Song等[35]报道内源性酶的活性以及嗜冷菌可以影响冷藏鲷鱼的TVB-N值。Liu等[21]报道添加迷迭香能够降低香肠中的TVB-N值,与其含有的抗菌性成分有关。
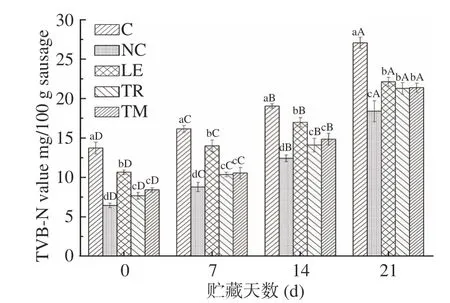
图3 不同食用菌添加鸭肉乳化肠贮藏期间TVB-N含量变化情况Fig.3 Changes of TVB-N on emulsified duck sausages with different kinds of edible mushrooms during storage
2.6 贮藏期间鸭肉肠中微生物的变化
鸭肉肠在贮藏过程中菌落总数的变化如图4所示,由图4可知,各组鸭肉肠初始的菌落总数为2.74~3.22 lg CFU/g,其中对照组鸭肉肠(C)中的菌落总数最高,达到了3.22 lg CFU/g,而食用菌组鸭肉肠菌落总数显著降低(P<0.05)。但随着贮藏时间的延长,各组鸭肉肠中菌落总数显著增加(P<0.05),与对照组(C)相比,NaNO2组菌落总数显著降低(P<0.05)。添加食用菌粉组在前14 d时可以明显抑制菌落总数的生长,但是在21 d时,其中香菇(LE)鸭肉肠与对照组(C)菌落总数没有显著性差异(P>0.05),而添加松露鸭肉肠(TR)菌落总数已经超过了对照组,松茸组(TM)菌落总数显著低于对照组鸭肉肠(P<0.05)。这可能与2.1结果中食用菌鸭肉肠中总酚含量随贮藏时间的延长急剧下降有关。另外各组的菌落总数在第14 d时已经超过国家标准规定的熟肉制品微生物菌落总数GB 2726-2016[36](lg CFU/g<4),说明已经失去了食用价值。
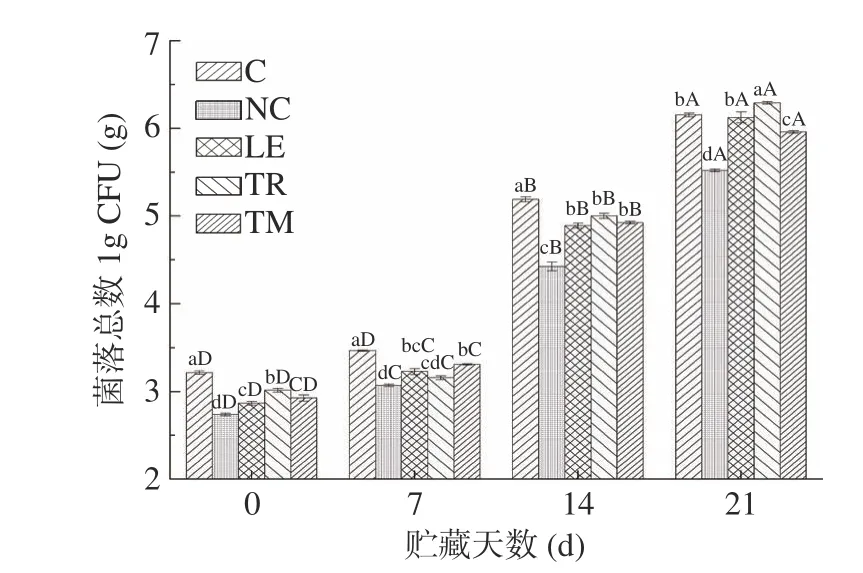
图4 不同食用菌添加鸭肉乳化肠贮藏期间菌落总数变化情况Fig.4 changes of total plate count on emulsified duck sausages with different kinds of edible mushrooms during storage
3 结论
添加食用菌粉能提高鸭肉肠的pH和水分含量,在整个贮藏期间食用菌添加组持水性显著高于对照组及NC组,从而提升了鸭肉肠的多汁性和出品率。与对照组相比,虽然香菇、松茸和松露的添加在一定程度上影响产品的亮度值和红度值,但是对鸭肉肠贮藏期间的脂肪氧化和TVB-N产生明显的抑制作用,在贮藏第0和7 d时添加食用菌组与NaNO2组的TBARS值没有显著性差异,均显著低于对照组(P<0.05)。在贮藏第21 d时对照组鸭肉肠的TBARS值为0.56 mg MDA/kg,NaNO2组和食用菌组其TBARS值范围为0.35~0.48 mg MDA/kg,明显降低了鸭肉的脂肪氧化程度。与对照组相比NaNO2组及食用菌添加组LE、TR和TM中TVB-N分别降低了32.07%、18.28%、21.38%和21.03%。另外,在贮藏0~14 d期间食用菌粉添加能够抑制鸭肉肠中微生物的生长,提高产品的安全性。因此,食用菌粉的添加能够提高鸭肉肠在贮藏期间的品质稳定性,满足大众对健康饮食的要求,具有一定应用前景。

