欧拉型藏羊源粪肠球菌的分离鉴定及药敏实验
陈晓慧,徐淑琴,马祥兆,贺 曦,贺晓龙,冶贵生
(青海大学农牧学院,青海西宁 810016)
欧拉型藏羊是高寒牧区优势畜种之一,具有较强的抗寒性与抗病能力。然而随着饲养规模扩大,藏羊消化道类疫病多发且缺乏良好的治疗方法,尽管抗生素能治疗消化道类疾病,但会打破肠道菌群平衡状态,长期使用抗生素会导致畜产品的药物残留和耐药菌株的产生,且引起肠道菌群紊乱。因此开发以益生菌为原材料的微生态制剂对藏羊肠道进行调控成为主流。益生菌是一种天然存在的微生物,它通过改变宿主共生微生物菌群、调节免疫、增强肠道屏障功能来赋予健康益处[1]。益生菌的使用被广泛认为是稳定或改善肠道系统的一种有前途的方法,在宿主内的定植特异性可直接影响微生态益生菌制剂的临床应用效果,选择菌种的最好方式是采用分离自同源动物肠道的优良菌种。长期以来肠球菌一直被用作益生菌和食品发酵,肠球菌是哺乳动物胃肠道内正常微生物群体中的重要组成部分[2],特别是粪肠球菌(Enterococcus faecalis),研究表明优良的粪肠球菌菌株主要来源于动物机体内[3]。
粪肠球菌是一种革兰阳性兼性厌氧菌,是广泛存在于动物肠道内的益生菌群[4]。粪肠球菌通过快速定植并耐受胃肠道的复杂环境来发挥益生作用[5]。粪肠球菌在调节肠道菌群环境中发挥着重要作用[6],可通过产生细菌素类抑菌物质,抑制大肠杆菌和沙门氏菌等病原菌的生长,改善肠道微环境,还能抑制肠道内产尿素酶细菌和腐败菌的繁殖,减少肠道尿素酶和内毒素的含量,使血液中氨和内毒素的含量下降,从而提高家畜抗病性和生产性能等[7]。微生态制剂可有效地调节动物肠道菌群的结构组成以及维持肠道菌群稳态,是目前替代抗生素研究的突破点[8]。不同动物肠道中的菌群都有一定特异性,来源与使用对象相同时,益生菌可更好地发挥益生效果。目前关于藏羊源肠道益生菌的研究报道很少,本研究对健康欧拉型藏羊肠道细菌进行分离培养与鉴定,旨在为其欧拉型藏羊源微生态制剂的研发提供候选菌株。
1 材料与方法
1.1 材料与仪器
健康欧拉型藏羊肠道内容物样本 来源于青海省海东市民和县某养殖场;大肠杆菌、沙门氏菌、金黄色葡萄球菌、产气荚膜梭菌 均来自于青海大学农牧学院动物医学系高原动物疾病研究室;粪肠球菌固体培养基(MRS固体培养基)、粪肠球菌液体培养基(MRS液体培养基)、Pfizer肠球菌选择性琼脂、细菌生化鉴定管 青岛海博生物技术有限公司;革兰氏染色试剂盒 珠海贝索生物技术有限公司;药敏纸片
杭州滨和生物有限公司;细菌基因组DNA提取试剂盒 宝生物工程(大连)有限公司。
立式压力蒸汽灭菌锅 上海申安医疗器械厂;恒温培养箱 上海一恒科技有限公司;恒温培养摇床
上海蓝豹实验仪器有限公司;生物安全柜 新加坡艺思高科技有限公司;DYY-12C型电泳仪电源北京市六一仪器厂;凝胶成像系统 莱普特科学仪器(北京)有限公司;紫外可见分光光度计 上海光谱仪器有限公司。
1.2 实验方法
1.2.1 菌株分离筛选 无菌操作采集欧拉型藏羊肠道内容物样品1 mL置3 mL MRS液体培养基中,37 ℃恒温厌氧培养16~24 h。将通过液体培养过的菌液接种在MRS的固体培养基上进行划线,37 ℃恒温培养箱倒置培养48 h,观察菌落形态,选取不同形态,大小,颜色的单个菌落划线于Pfizer肠球菌选择性琼脂培养基,厌氧培养48 h,纯化三次或三次以上,直到培养基菌落单一、稳定为止。
1.2.2 形态学鉴定 将纯化后所得疑似菌株,通过革兰氏染色,于光学显微镜100×油镜下观察其形态特征。
1.2.3 生化鉴定 按照菌株生化鉴定标准试剂盒说明书对分离菌株EF1-mh进行生化试验测定。
1.2.4 分子生物学鉴定 参照细菌基因组DNA提取试剂盒说明书提取分离菌株EF1-mh基因组DNA。以提取的分离菌株EF1-mh基因组DNA为模板,采用16S rDNA通用引物进行PCR扩增。引物序列为:
27F:5'-AGAGTTTGATCCTGGCTCAG-3',1492R:5'-GGTTACCTTGTTACGACTT-3'。PCR扩增体系为(50 μL):上、下游引物各1 μL,模板DNA 2 μL,Premix Taq 25 μL,ddH2O 22 μL。扩增条件为:95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸2 min,35个循环,72 ℃末端延伸10 min,4 ℃保存;同时设置阴性对照。将得到的PCR扩增产物进行1%琼脂糖凝胶电泳检测,若PCR扩增产物在1500 bp左右,将PCR扩增产物送至生物公司进行测序。
16S rDNA系统发育树的构建及同源性分析:使用DNA star软件中的Seq Man进行序列拼接、校对,利用BLAST网站和GeneBank数据库中收录的粪肠球菌参考序列,对测序结果进行同源性比对分析,并构建系统发育树。
1.2.5 生长曲线测定和产酸能力试验 取2%分离菌株EF1-mh菌悬液接种于5 mL MRS液体培养基内,37 ℃,150 r/min恒温培养24 h,从0 h开始,每隔2 h取样一次,使用紫外可见分光光度计测定波长600 nm处的吸光度值OD,并测定pH,每时间点取样做三次重复,记录数据,绘制曲线图。
1.2.6 药敏试验 采用K-B纸片扩散法[9],检测分离菌株EF1-mh对30种抗生素的敏感性。将待测菌株均匀涂布于MRS固体培养基上,37 ℃培养18 h,挑取单个菌落于5 mL MRS液体培养基中37 ℃恒温厌氧培养12~16 h,将粪肠球菌增殖液稀释至0.5麦氏浊度,使用无菌棉签涂布在MRS琼脂平板上,待琼脂表面水分稍干,将药敏纸片平整地贴在平板上,37 ℃倒置培养18~24 h,以药敏纸片为中心测定抑菌圈直径,统计记录抑菌结果:敏感(S)、中等敏感(I)、耐药(R)三种形式记录。
1.2.7 抑菌试验 使用牛津杯法[10]测定分离菌株EF1-mh对大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、沙门氏菌(Salmonella)和产气荚膜梭菌(C.perfringens)的抑菌能力。以大肠杆菌、金黄色葡萄球菌、沙门氏菌和产气荚膜梭菌为指示菌,将致病菌菌液浓度稀释至1×108CFU/mL,分别取100 μL均匀涂布于营养琼脂上,无菌操作放置牛津杯,利用牛津杯进行打孔,受试菌悬液12000 r/min离心10 min,收集上清液,取200 μL加至孔内,4 ℃预扩散12 h,37 ℃恒温培养24 h,测量抑菌圈直径。
1.3 数据处理
使用DNA star软件中的Seq Man进行序列拼接、校对,利用BLAST网站和GeneBank数据库进行同源比对分析;使用MEGA 7.0软件构建系统进化树;Excel 2019进行数据统计分析。
2 结果与分析
2.1 粪肠球菌鉴定结果
2.1.1 形态学鉴定结果 经过MRS固体培养基分离培养,该菌株菌落呈乳白色,表面光滑,边缘整齐(图1A),经Pfizer肠球菌选择性琼脂分离培养筛选到阳性疑似菌,呈棕黑色菌落,周围有棕色圈(图1B)。通过革兰氏染色镜检,油镜(100×)下可见蓝紫色球菌,初步判断为革兰阳性球菌,呈短链状或成对排列,通常不运动,菌体没有芽孢和菌毛,符合粪肠球菌的菌体形态特征[11](图1C)。

图1 分离菌株EF1-mh 形态学结果Fig.1 Morphological results of strain EF1-mh
2.1.2 生化鉴定结果 对分离菌株EF1-mh进行生化鉴定,结果显示,水杨苷、麦芽糖、L-精氨酸双水解酶、葡萄糖、果糖、半乳糖、蕈糖、胆汁七叶苷、乳糖、纤维二糖、蔗糖、甲基红、马尿酸盐指标均为阳性;甘露醇、山梨醇、棉子糖、木糖、硫化氢、L-鼠李糖、蛋白胨水、菊糖、阿拉伯糖、吲哚试验、西蒙氏枸橼酸盐、松三糖、VP实验、硝酸盐、葡萄糖酸盐指标均为阴性。
生化鉴定结果见表1,结果表明该分离菌能分解麦芽糖、葡萄糖、果糖等;可利用水杨苷;具有L-精氨酸双水解酶活性;胆汁七叶苷琼脂指示剂结果呈黑色;不能分解甘露醇、山梨醇、棉子糖、L-鼠李糖、阿拉伯糖等;不产生硫化氢;吲哚试验、VP试验呈阴性;不利用西蒙氏枸橼酸盐和葡萄糖酸盐做为能源,不能还原硝酸盐,参照《伯杰细菌鉴定手册》[12]分离菌株EF1-mh符合粪肠球菌的生化特征,且与钟浪等[13]筛选的牦牛源粪肠球菌生化特性研究结果相符。
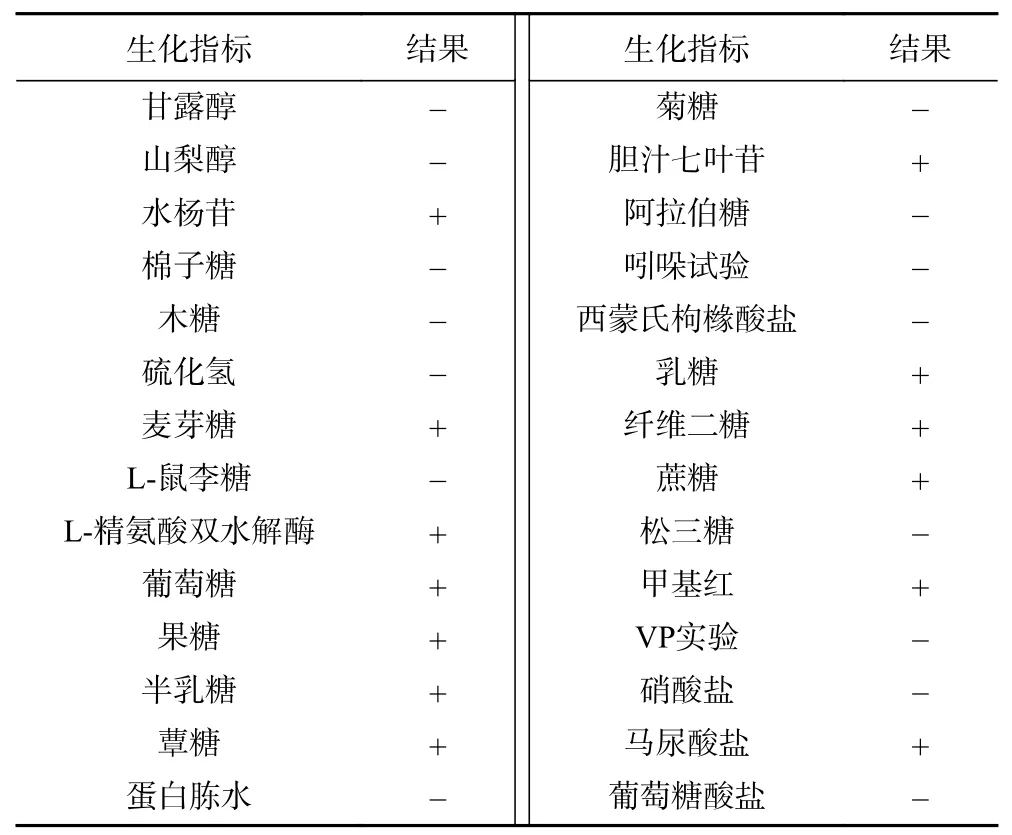
表1 生化鉴定试验结果Table 1 Biochemical identification results
2.1.3 分子生物学鉴定结果 使用16S rDNA通用引物对疑似粪肠球菌分离菌株EF1-mh DNA进行PCR扩增,经过1%琼脂糖凝胶电泳检测,扩增结果如图2,目的条带大小为1500 bp左右,符合预期设定。使用NCBI在线软件对16S rDNA序列进行BLAST同源性比对,结果显示分离菌株EF1-mh 16S测序长度为1461 bp,经过同源性比对分析得知分离菌株EF1-mh与GeneBank中11株粪肠球菌同源性在96.3%~97.2%之间,其中与粪肠球菌MH793511.1同源性最高,为97.2%,与粪肠球菌KC819130.1的同源性次之,为97.0%(如图3)。分离菌株EF1-mh与参考菌株16S rDNA基因序列所绘制的系统发育树(如图4),且在系统发育树上与粪肠球菌MT35 6183.1划分为同一支,从分子水平确定该分离菌株EF1-mh为粪肠球菌。

图2 分离菌株EF1-mh 16S rDNA基因PCR扩增Fig.2 PCR amplification of 16S rDNA gene in isolated strain EF1-mh

图3 菌株同源性比对分析Fig.3 Sequence homology of strains
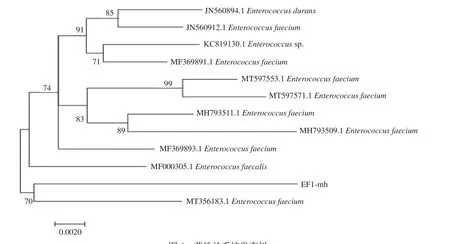
图4 菌株的系统发育树Fig.4 Phylogenetic tree of strains
2.2 生长曲线测定和产酸能力试验结果
生长曲线能够体现细菌的数量变化、生长与代谢状况,研究表明,肠球菌生长代谢速度快,繁殖力强。在本试验中,如图5所示,粪肠球菌EF1-mh在接种培养基后约6 h后进入对数生长期,并持续到14 h;16~18 h基本进入稳定期,生长速度降低即缓慢生长。任晓燕等[14]使用分光光度计和活菌计数2种方法对粪肠球菌生长曲线进行测定,两种方法结果一致,即粪肠球菌对数增长期是6~14 h,稳定期是16~18 h,18 h后进入衰亡期。并且粪肠球菌EF1-mh生长能力与石春卫等[15]筛选的粪肠球菌在24 h内的生长能力趋势一致,这表明筛选出的粪肠球菌可在营养充足的环境下快速生长,满足优良益生菌的特性。

图5 菌株生长曲线和和产酸能力Fig.5 Strain growth curves and acid production capacity of strains
粪肠球菌EF1-mh在MRS肉汤中培养6 h后pH下降,产酸能力弱,在18 h趋于稳定pH达到约在4.2左右,几乎不产酸,表明分离菌株EF1-mh具有弱产酸能力,并且所测得EF1-mh菌株产酸能力结果与桑梦琪等[16]、刘金艳[17]测定的粪肠球菌产酸能力结果一致,pH从约6.0降至4.2左右。研究表明粪肠球菌作为动物肠道内乳酸类肠球菌的原生菌种,能分泌L型乳酸,还可把部分糖类的无氮浸出物转化为乳酸供机体使用[18]。
2.3 药敏试验结果
粪肠球菌EF1-mh对苯唑西林、头孢呋辛、头孢氨苄、头孢拉定、多西环素、米诺环素表现出中度敏感;对青霉素、氨苄西林、羧苄西林、哌拉西林、头孢曲松、头孢唑啉、头孢哌酮、四环素、新霉素、庆大霉素、丁胺卡那、卡那霉素、诺氟沙星、环丙沙星、氧氟沙星、红霉素、麦迪霉素、克林霉素、万古霉素、氯霉素表现出敏感;而对呋喃唑酮、复方新诺明、头孢他啶、多粘菌素B这4种常见抗生素耐药(表2)。
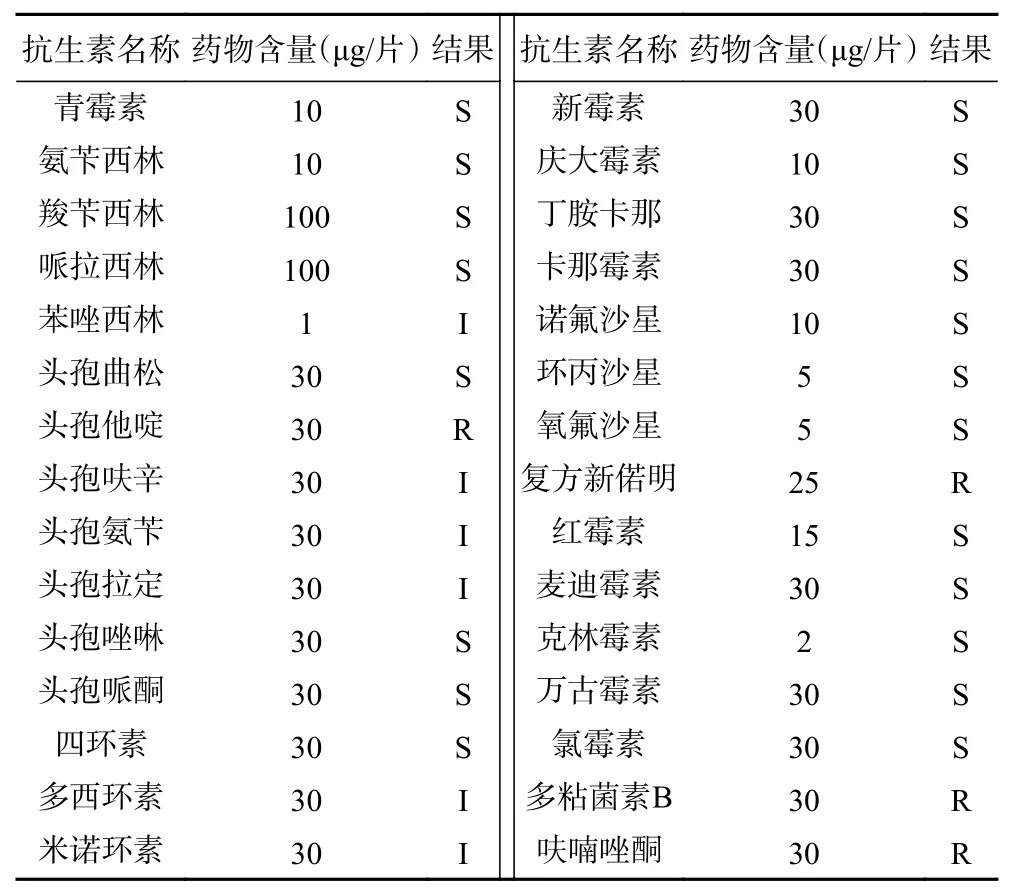
表2 药敏试验结果Table 2 Test results of drug sensitivity
近年从健康家畜和微生态制剂中分离的粪肠球菌均表现出一定的耐药性,说明在畜牧行业和饲料行业中粪肠球菌的耐药性呈现上升趋势。欧拉型藏羊源粪肠球菌EF1-mh株药敏实验结果表明在受试的30种抗菌药物中,对苯唑西林、头孢呋辛、头孢氨苄、头孢拉定、多西环素和米诺环素表现为中等敏感;对呋喃唑酮、复方新诺明、头孢他啶、多粘菌素B耐药;肠球菌的固有耐药性主要是β-内酰胺类、克林霉素、氨基糖苷类、甲氧苄氨嘧啶-磺胺甲恶唑[11]。对于β-内酰胺类药物的耐药性是肠球菌的一个固有特性,粪肠球菌可能不产生β-内酰胺酶的特性,从而导致对头孢他啶具有耐药性。粪肠球菌EF1-mh株与石春卫等[15]从长春市双阳地区某猪场28日龄健康仔猪新鲜粪便中分离的粪肠球菌,以及朱利霞等[19]从河北省围场县某牛场病死犊牛中分离出的粪肠球菌B2019的药敏试验结果有所不同,这可能是由于动物的品种和地理环境的差异性,来源于不同动物样品的粪肠球菌在耐药性方面存在差异。
2.4 抑菌试验结果
肠球菌可以有效抑制肠道病原菌,维护宿主肠道健康。其中,粪肠球菌和屎肠球菌也属于益生菌,具有益生的功能,对动物的生长和健康具有良好的作用。粪肠球菌作为一种益生菌,在医学和食品工程领域得到广泛应用[20]。粪肠球菌通过黏附于肠道表面形成保护屏障,可在肠道上皮细胞上形成生物膜,保护肠上皮细胞免受有害物质侵袭[18],并且可产生有机酸、细菌素(acteriocins),包括肠溶素A和肠道菌素(enterocins)Gr17等抑菌物质,来调节肠道内环境,发挥益生作用[21-22]。这些细菌素,即所谓的肠道菌素,大多是由核糖体合成机制产生的一些小的阳离子抗菌肽,对于一些革兰氏阳性腐败菌和致病菌有抗菌活性[23]。研究表明,大多数细菌素只对亲缘性较近的革兰氏阳性菌效果好,此外一些细菌素也对特定的革兰氏阴性菌有抑制作用,例如大肠杆菌和沙门氏菌,这可能与革兰氏阳性菌和革兰氏阴性菌的细胞壁成分有关,革兰氏阳性菌细胞壁主要仅由肽聚糖组成,不能形成有效的屏障;而革兰氏阴性菌外有一层磷脂膜和脂多糖结构,这使得抑菌物质不能轻易渗透细胞壁,有些细菌素还可以抑制某些病毒的生长[24-25]。粪肠球菌可产生一类特异性细菌素,其抗菌谱窄,能够防止病原微生物接触肠黏膜细胞。并且粪肠球菌还可产生具有广谱抗菌特性的细菌素,对假单孢菌、沙门菌及志贺氏菌有较好的抑制作用。Hugas等[26]研究证实,粪肠球菌能够有效抑制金黄色葡萄球菌生长。候璐[27]通过给断奶仔猪中饲喂粪肠球菌,结果发现其粪便中大肠杆菌和金黄色葡萄球菌的数量减少。
本试验与上述研究结果相符,如表3所示,粪肠球菌EF1-mh所产抑菌物不但对产气荚膜梭菌有较强的抑制作用,且对大肠杆菌、沙门氏菌和金黄色葡萄球菌均有很好的抑制效果。具有抑菌能力的粪肠球菌上清会在牛津杯周围形成一个透明的抑菌圈,抑菌圈的直径越大,说明对应菌株对致病菌的抑制能力越强;不具备抑菌能力的粪肠球菌上清在牛津杯周围没有抑菌圈,细菌均匀生长。抑菌试验结果表明,粪肠球菌EF1-mh株上清液可有效抑制肠道致病菌的生长,对大肠杆菌、沙门氏菌、金黄色葡萄球菌和产气荚膜梭菌4株肠道致病菌都具有抑制作用,抑菌效果较好。其中产气荚膜梭菌抑菌圈直径最大,说明粪肠球菌EF1-mh对产气荚膜梭菌抑菌能力最强。益生菌对致病菌的抑制作用是益生菌的一个重要益生特征,理想的益生菌菌株应该是分离自同源动物胃肠道,具有一定的耐受能力[28]。不同动物肠道中的菌群具有特异性,菌株的来源与使用对象一致,可以更好地发挥益生作用[29],因此,从健康欧拉型藏羊肠道内容物中分离的粪肠球菌EF1-mh株具有很好的益生性,更易于在欧拉型藏羊肠道内定植并发挥作用,为后期开发欧拉型藏羊源微生态制剂提供了候选菌株。

表3 抑菌试验结果Table 3 Antibacterial test results
3 结论
本实验从健康的欧拉型藏羊肠道中分离得到了一株粪肠球菌EF1-mh,该菌株是无芽孢、无菌毛的革兰氏阳性球菌,能分解麦芽糖、葡萄糖、果糖等,不能分解甘露醇、山梨醇、棉子糖、L-鼠李糖、阿拉伯糖等,具有L-精氨酸双水解酶活性,胆汁七叶苷琼脂指示剂结果呈黑色,不产生硫化氢,吲哚试验、VP试验呈阴性,不利用西蒙氏枸橼酸盐和葡萄糖酸盐作为能源,不能还原硝酸盐。粪肠球菌EF1-mh株具有较强的生长能力和较弱的产酸能力。粪肠球菌EF1-mh株对苯唑西林、头孢呋辛、头孢氨苄、头孢拉定、多西环素、米诺环素表现出中度敏感;对呋喃唑酮、复方新诺明、头孢他啶、多粘菌素B表现出耐药,并且该菌株其上清液可明显抑制肠道致病菌,其中对产气荚膜梭菌的抑菌能力最强。
——中国益生菌信息与技术交流平台

