AMPK活化调控的能量代谢对宰后牦牛肉肉色稳定性影响的研究
陈炼红,王琳琳,高代微
(西南民族大学生命科学与技术学院,四川成都 610041)
肉色是影响鲜肉适销性的重要因素之一,而鲜亮的樱桃红色通常是消费者作为评价鲜肉新鲜和健康的标准。近年来,诸多学者对影响肉色及肉色稳定性的因素进行了广泛的研究,其中部分学者研究了线粒体在肉色及肉色稳定性中的作用。如Arihara等[1]研究发现高铁肌红蛋白还原酶(Metmyoglobin reductase activity,MetMbR)活性作为影响鲜肉在贮藏期间肉色稳定性的一个重要的因子,其主要存在于线粒体上,微粒体上很少;Joseph等[2]研究发现添加丙酮酸、乳酸盐、琥珀酸盐和苹果酸等三羧酸循环中间的代谢产物于宰后肌肉中,能够刺激肌肉再生烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NADH)的过程,进而提高高铁肌红蛋白(Metmyoglobin,MMb)的还原能力,维持肉色的稳定。
不同部位牦牛肉在宰后成熟过程中肉色稳定性具有的差异性。同时,本课题组在前期研究中已明确和其他部位相比,牦牛背最长肌肉色具有较好的稳定性。因此,本研究以牦牛背最长肌为研究对象,分别以AICAR和Compound C为激活剂和抑制剂,测定宰后成熟过程中肉色及能量代谢的相关指标的变化趋势,确定能量代谢指标与肉色指标之间的相关性,以期明确AMPK活化调控的能量代谢对宰后牦牛肉肉色稳定性的影响以及为阐明宰后牦牛肉肉色稳定性机理的研究提供理论基础。
1 材料与方法
1.1 材料与仪器
牦牛背最长肌 选取产自四川省红原县同一牧场,平均年龄3.5岁、生长发育良好、体重相近的牦牛4头,以宰后将牦牛背最长肌置于液氮中保存;AICAR、Compound C、磷酸二氢钠、磷酸氢二钠、氯化钠、氢氧化钠、浓盐酸、三氯乙酸、浓硫酸、硫脲、蒽酮、葡萄糖、蔗糖、乙二胺四乙酸(EDTA)、三羟甲基氨基甲烷(Tris)、硫酸铜、牛血清蛋白等 均为分析纯,成都康迪生物技术有限公司;牛MR ELISA试剂盒、牛磷酸化腺苷酸活化蛋白激酶(p-AMPK)ELISA试剂盒、牛NADH ELISA试剂盒、牛GS试剂盒 上海酶联生物科技有限公司;乳酸试剂盒、肌酸激酶试剂盒、己糖激酶试剂盒、LDH试剂盒 南京建成生物工程研究所。
FSH-2A可调高速组织匀浆机 金坛市华城海龙实验仪器厂;Thermo Scientific Revco ULT-1786-6V超低温冰箱 美国赛默飞科技公司;MP511 Lab pH计 上海三信仪表厂;UV2100紫外可见分光光度计 上海尤尼柯仪器有限公司;Centrifuge 5804 R高速冷冻离心机 德国Eppendorf公司;Rayto RT-6100酶标仪 济南骏驰生物科技有限公司;pH STAR胴体肌肉pH值直测仪 德国Ingenieurhuro R.Matthaus公司;CR-400便携式色差仪 日本Konica Minolta 公司。
1.2 实验方法
1.2.1 样本处理 将液氮中保存的肉样恢复至0 ℃左右,迅速剔除表面的脂肪和结缔组织,并将其迅速切成5×5×4 cm的肉块,随机分成三组,按照肉液比10:1(w/v)将溶液均匀的注射进肉样。第一组注射50 mmol/L AICAR溶液,第二组注射50 mmol/L Compound C溶液,第三组作为空白对照样品,并将样品放置于4 ℃条件下成熟,时间点分别设置为6、12、24、72、120、168 h,在相应时间点测定pH、肉色、MetMbR、AMPK活性、NADH含量、糖原合成酶(GS)活性和乳酸脱氢酶(LDH)活性等指标的测定[4]。
1.2.2 检测方法
1.2.2.1 AMPK活性测定 AMPK活性的测定参照董笑含[9]的方法。AMPK通过AMPKα亚基上的Thr172位点磷酸化被激活,因此本实验通过测定磷酸化腺苷酸活化蛋白激酶(p-AMPK)的水平来确定AMPK的活性,具体操作和结果计算参照牛p-AMPK酶联免疫检测试剂盒的说明进行。
1.2.2.2 肉色测定 在相应的成熟时间点取样,采用已经进行白板校正的色差仪测定肉色,每个肉样取5个不同的点测定其L*值、a*值和b*值,取其平均值。并计算H*,公式为:
在国外,融资租赁之所以发展快速,一方面是因为起步较早,另一方面是因为政府对该行业的扶持。而我国,政府近几年才对该行业重视,但人才的培养、市场环境的完善都需要时间,该行业缺乏一个整体、系统的政策支持。尤其是西部地区,西部市场经济没有东部发达,对外资的吸引力不强,这方面更加需要政府的帮助。目前,西部融资租赁业面临两大发展机遇:其一,正值“西部大开发”计划的第二阶段,是加快西部经济产业化以及市场化步伐的关键时期。其二,习总书记2013年提出的“一带一路”囊括了我国西部绝大部分地区,这对西部的发展又是一个强有力的推动。西部各级政府应借此机遇,助力融资租赁业的发展,进而促进经济的增长[6]。

1.2.2.3 pH测定 使用胴体pH计测定。取各样品3个不同位置点进行测定,计算并取其平均值。
1.2.2.4 总色素含量测定 参照Krzywicki等[10]的方法,略做修改。取肉样10 g,加入0.04 mol/L、pH6.8的磷酸盐缓冲液20 mL,匀浆25 s。匀浆液在4 ℃条件下静置1 h后,在3300 r/min条件下离心30 min。用滤纸过滤所取上清液并用上述缓冲液定容至25 mL,测定波长分别为525、545、565、572 nm处样品的吸光度。

式中:R1、R2、R3分别是吸光率比值A572/A525、A565/A525、A545/A525。
1.2.2.5 糖原含量测定 糖原标准曲线绘制:采用蒽酮比色法测定糖原含量并绘制标准曲线。选取6支20 mL试管作为标准管,编号后分别加入0、0.5、1.0、1.5、2.0、2.5 mL的葡萄糖标准液(1 mg/mL),再依次加入蒸馏水3、2.5、2、1.5、1、0.5 mL,再分别沿试管壁缓缓加入4 mL蒽酮试剂(0.2 g蒽酮和2.0 g硫脲溶解于100 mL浓硫酸),混合后震荡1 min,立即置冰水中冷却。将冷却好的试管放入沸水浴中煮沸15 min,取出试管立即放入冷水中充分冷却,将冷却好的液体倒入玻璃比色皿中,于620 nm波长下测定吸光度。制得的糖原标曲为y=2.2989x-0.0029,R2=0.9996。其中y为吸光值,x为糖原浓度(mg/mL)。
糖原含量测定:参照王琳琳[11]的方法并加以修改测定。准确称取肉样1 g,加入5%的三氯乙酸8 mL,研磨至固体消失。将研磨液在8000 r/min,4 ℃下离心20 min,将上清液转移定容至25 mL容量瓶中,震荡混匀;取2.5 mL上述溶液,加入4 mL蒽酮试剂,混合后震荡1 min,立即置冰水中冷却,冷却后再沸水浴15 min,充分冷却后,于620 nm波长下测定吸光度,之后操作步骤同上。用以下公式计算糖原含量:

式中:Y:糖原含量,mg/g;M:通过对照标准曲线查得1 mL提取液中的葡萄糖当量,mg/mL;0.9:将葡萄糖换算为糖原的系数;25:定容体积,mL。
1.2.2.6 NADH含量、MetMbR和GS活性测定NADH含量、高铁肌红蛋白还原酶活性和糖原合成酶活性测定均采用上海酶联生物科技有限公司的试剂盒进行,具体操作和结果计算参照各试剂盒的说明进行。
1.2.2.7 乳酸含量、LDH活性、己糖激酶活性和肌酸激酶活性测定 乳酸含量、乳酸脱氢酶活性、己糖激酶活性和肌酸激酶活性的测定均采用南京建成生物工程研究所的试剂盒进行,具体操作和结果计算参照各试剂盒的说明进行。
1.3 数据处理
所有数据均为三次重复测定的平均值,结果用平均值±标准差表示。利用SPSS20.0对数据进行统计分析获得平均值和标准差,采用Duncan多重比较进行显著性方差分析,显著性水平P<0.05。作图采用Microsoft 2016 Excel软件。
2 结果与分析
2.1 宰后成熟期间AMPK活性的变化
由图1可知:在宰后肌肉成熟过程中,三组AMPK的活力均呈先上升后下降的趋势,这个结果与高永芳等[12]研究结果相似。在成熟初期(6~12 h)AMPK活力显著上升(P<0.05),这是由于动物宰后氧气中断,肌肉进行糖酵解产生能量,ATP含量减少,而肌肉中ATP的消耗仍在继续,使得AMP:ATP的比值增加,从而激活AMPK[4]。成熟12 h后AMPK活力显著下降(P<0.05),这可能是由于胴体糖原含量有限,随着成熟时间的延长糖原逐渐被消耗完,糖酵解逐渐停止,AMPK活性不再升高,因此宰后AMPK被激活后不久,活性即开始下降[5]。
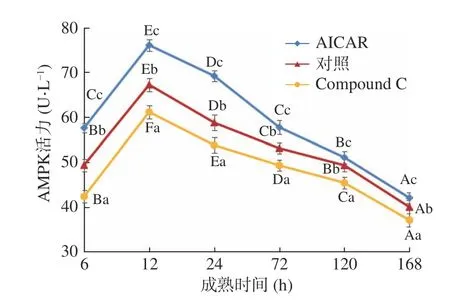
图1 成熟期间牦牛肉AMPK活力的变化Fig.1 Changes of AMPK activity of yak beef during postmortem aging
此外,在同一成熟时间点,AICAR组的AMPK活力显著高于其余两组(P<0.05),而对照组的AMPK活力显著高于抑制组(P<0.05)。说明AICAR对AMPK的活性起到了激活作用,成熟至12 h,AICAR组、对照组和Compound C组的AMPK活力均达到峰值,分别为76.07、67.22、61.15 U/L,与对照组相比,AICAR组AMPK活力提高了13.17%,而抑制组降低了9.03%。成熟至168 h,三者AMPK活力分别为42.01、39.95、37.03 U/L,与对照组相比,AICAR组AMPK活力提高了5.16%,而Compound C组降低了7.31%。表明随着成熟时间的延长,AICAR激活AMPK的能力逐渐下降,Compound C抑制AMPK的能力也逐渐下降[12]。该结果与高永芳等[12]研究结果一致。
2.2 AMPK活力对宰后成熟期间牦牛肉肉色的影响
由表1可知:在成熟过程中,AICAR组、Compound C组和对照组的L*值和a*值均呈先上升后下降趋势,且L*值在120 h达到峰值,a*值在12 h达到最大值,与高永芳等[12]指出的AICAR处理的牛肉和对照组在宰后成熟期间L*值和a*值的变化趋势基本一致。此外,在同一成熟时间点,三者L*值的大小依次为AICAR组>对照组>Compound C组,其中除12 h外,在其余时间点AICAR组的L*均显著高于Compound C组(P<0.05);而在同一成熟时间点,a*值的大小依次为AICAR组<对照组<Compound C组,其中除12、120、168 h以外,其余时间点Compound C组与对照组的a*值均显著高于AICAR组(P<0.05)。成熟后期L*值上升是由于pH到达等电点,肌球蛋白和肌动蛋白等蛋白质发生收缩和凝固而成为颗粒状,使得游离水增加导致肉的系水力下降,渗出至肉表面的水分增多,肉色发亮[13];a*值下降是因为肌肉中OMb与氧气接触,生成MMb(暗褐色),OMb(鲜红色)含量的降低以及MMb含量的增加导致a*值的下降[8,12]。由以上分析可知,在整个成熟阶段AICAR组的亮度更大,而Compound C组的肉色更红。
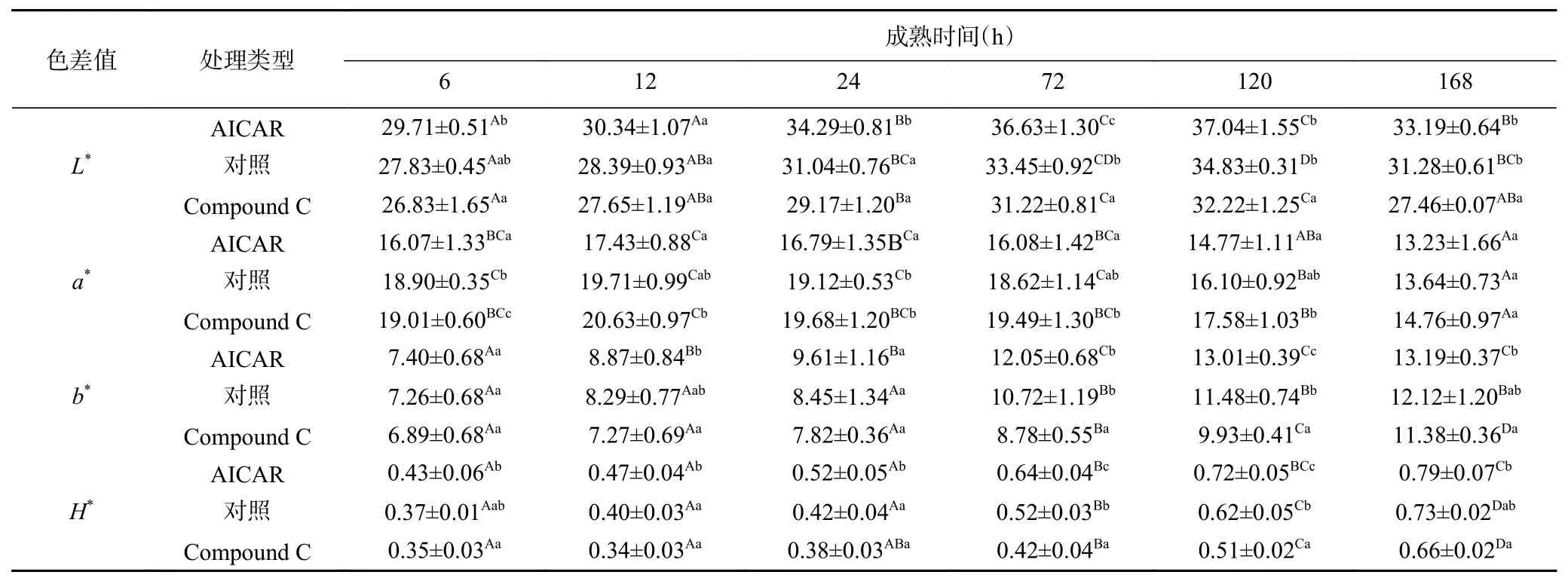
表1 成熟期间牦牛肉肉色的变化Table 1 Changes in meat color of yak beef during postmortem aging
随着成熟时间的延长,AICAR组、Compound C组和对照组的b*值和H*值均呈逐渐上升的趋势,其中b*值和H*值始终为AICAR组>对照组>Compound C组。并且除6、24 h以外,Compound C组的b*值均显著低于其余时间点AICAR组的b*值(P<0.05);而在整个成熟阶段,Compound C组的H*值均显著低于AICAR组(P<0.05)。由于H*值越低表示肉色越鲜红,由此可知Compound C组的肉色较其余两组鲜红。
2.3 AMPK活力对宰后成熟期间牦牛肉pH的影响
由图2可知,随着成熟时间的延长,处理组与对照组的pH均呈先下降后缓慢上升的趋势,在成熟6~72 h时间段内pH显著下降(P<0.05)。这是由于动物宰后生化反应还在继续,肌糖原酵解产生乳酸和蛋白质降解使得pH不断下降[14]。同时,磷酸肌酸系统的代谢产物肌酸以及ATP分解产生的磷酸也会使pH下降[15]。随着成熟时间的延长,Ca2+从肌质网中释放出来并且激活钙激活酶,作用于肌间蛋白质使其分解一些碱性物质造成成熟后期肌肉的pH升高[16]。在整个成熟过程中,三者的pH大小始终为AICAR组<对照组<Compound C组。并且在成熟至120 h时,AICAR组、Compound C组以及对照组的pH分别下降至最低值5.53、5.61和5.67。与对照组相比,AICAR组pH降低了0.08,Compound C组pH上升了0.06,说明AICAR组的pH下降速度较对照组快,Compound C组则与之相反。由此可知,AICAR加快了糖酵解进程,缩短了宰后牦牛肉成熟时间,Compound C则与之相反。这与袁倩等[17]报道的AMPK活性与不同极限pH牛肉的产生密切相关的结论相一致。

图2 成熟期间牦牛肉pH的变化Fig.2 Changes of pH of yak beef during postmortem aging
2.4 AMPK活力对宰后成熟期间牦牛肉色素含量的影响(TMb、OMb、MMb)
牦牛背最长肌在宰后成熟期间AICAR组、Compound C组和对照组的TMb含量变化结果如图3所示。在成熟期间三组TMb含量均成下降趋势,且6 h显著高于168 h(P<0.05)。这是由于随着排酸时间的延长,肌红蛋白周围失水,使其与氧气充分接触,氧化生成MMb[18]。与自身的L*值随着时间的延长呈先上升的后下降的趋势一致。AICAR组、Compound C组以及对照组成熟至168 h时,其TMb含量与6 h相比,分别下降了34.52%、31.63%和33.67%。说明Compound C组TMb含量下降的速度较对照组和AICAR组慢,Compound C组在成熟过程中牦牛肉色稳定性更佳。在同一成熟时间点,除72 h以外,三者之间差异均不显著(P>0.05)。但从趋势上可以看出,三者TMb含量高低依次为Compound C组>对照组>AICAR组。由于肌肉中肌红蛋白的含量与分布影响牦牛的色泽,因此可以推测在成熟过程中Compound C组的肉色较对照组和AICAR组更鲜红。

图3 成熟期间牦牛肉TMb含量的变化Fig.3 Changes of TMb content of yak meat during postmortem aging
图4 和图5描述了AICAR组、Compound C组和对照组在成熟期间肌红蛋白主要的两种氧化状态(OMb和MMb)相对含量的变化趋势。在成熟初期(6 h)牦牛肉中肌红蛋白主要以OMb的形式存在,AICAR组、Compound C组和对照组的OMb分别为55.67%、60.17%和59.13%,MMb含量分别为9.84%、10.06%和12.35%,三者之间均无显著性差异(P>0.05)。随着成熟时间的延长,三组OMb含量均呈显著下降趋势(P<0.05),而MMb含量呈显著上升趋势(P<0.05),OMb与MMb含量为“此消彼长”模式。该结果与陈骋[19]等研究结果相一致。这是由于该实验在未隔绝氧气的条件下成熟,因此DeoMb会快速与氧气结合,形成OMb或直接氧化为MMb,而MMb不能及时还原为OMb,造成MMb的积累,从而使得肉色逐渐向MMb的暗褐色发展[19]。与成熟6 h相比,AICAR组、Compound C组和对照组的OMb含量在第168 h时分别降低了41.38%、40.40%和40.57%,而MMb含量则分别上升了310%、291%和309%。在整个成熟过程中,Compound C组的OMb含量始终高于其余两组,且在24、72 h时差异显著(P<0.05);而Compound C组的MMb含量始终低于其余两组,12、24、72、168 h时差异显著(P<0.05)。说明在整个成熟过程中Compound C组肌红蛋白的氧化速率低于对照组和AICAR组,故Compound C组的肉色较对照组和AICAR组更鲜红,与2.2结果相一致。

图4 成熟期间牦牛肉OMb含量的变化Fig.4 Changes of OMb content of yak meat during postmortem aging

图5 成熟期间牦牛肉MMb含量的变化Fig.5 Changes of MMb content of yak meat during postmortem aging
2.5 AMPK活力对宰后成熟期间MetMbR活性的影响
图6 描述了牦牛背最长肌在成熟期间AMPK活力的变化对其MetMbR活性的影响。如图所示,AICAR组、Compound C组和对照组的MetMbR活性随着成熟时间的延长均呈下降趋势。成熟6 h时MetMbR活性显著高于168 h时(P<0.05),表明此时肌肉中MetMbR能够及时的将氧化的肌红蛋白还原,进而降低了MMb的积累速率。随着成熟时间的延长,成熟168 h时,AICAR组、Compound C组和对照组的MetMbR活性仅为6 h的39.74%、42.72%和41.41%。MetMbR活性在成熟期间的变化规律解释了图5中相应时期MMb含量迅速升高的原因。而在同一成熟时间内,三者MetMbR活性大小依次为Compound C组>对照组>AICAR组。说明在整个成熟过程中,Compound C组高铁肌红蛋白还原能力优于其余两组。Mckenna等[20]对牛肉宰后胴体的色泽稳定性的研究中指出,健康畜禽在屠宰后,其胴体中的MetMbR活性越高,相应的肉色稳定性就越高。由此可知,三者肉色稳定性依次为Compound C组>对照组>AICAR组,即AMPK活力的抑制有利于牦牛背最长肌在成熟期间肉色的稳定。

图6 成熟期间牦牛肉MetMbR活性的变化Fig.6 Changes of MetMbR activity of yak beef during postmortem aging
2.6 AMPK活力对宰后牦牛肉糖原的影响
由图7可知,AICAR组、Compound C组和对照组的糖原含量随着成熟时间的延长呈显著下降的趋势(P<0.05)。糖原是机体能量的主要来源,在动物屠宰以后,糖原进行无氧酵解提供各种生化过程所需的能量,糖原含量会逐渐减少,生成乳酸使得pH下降,直至抑制糖酵解酶的活性为止[21]。在成熟过程中,除6 h以外的其余时间点,Compound C组的糖原含量显著高于对照组和AICAR组(P<0.05)。说明AMPK的激活确实加速了糖原的分解,这与Kurth-Kraczek等[22]证实AMPK的激活可加速糖原分解,同时促进骨骼肌糖酵解的结论基本一致。这是由于AMPK可以通过作用于GS和糖原磷酸化酶以及GLUT4的移位,促进骨骼肌对葡萄糖的吸收,抑制肝糖原的异生以及促进骨骼肌糖酵解,从而影响肌肉中糖原的含量[23]。

图7 成熟期间牦牛肉糖原含量的变化Fig.7 Changes of glycogen concent of yak beef during postmortem aging
2.7 AMPK活力对宰后牦牛肉乳酸的影响
由图8可知,随着成熟时间的延长,AICAR组、Compound C组和对照组中乳酸的含量均呈上升趋势。在成熟初期(6~12 h),三组乳酸含量呈显著上升趋势(P<0.05);而在成熟后期(72~168 h),三组的乳酸含量非显著性增加(P>0.05)。这是由于动物宰后,糖酵解产生乳酸,而乳酸不能通过血液循环排除或在肝中合成肝糖原,因此大量的蓄积在肌肉中,使其含量逐渐升高[9]。在整个成熟过程中,Compound C组的乳酸含量始终低于对照组和AICAR组。在成熟6~72 h内,处理组和对照组之间乳酸含量差异不显著(P>0.05);而在成熟后期(120~168 h),AICAR组的乳酸含量显著高于Compound C组(P<0.05)。这是由于AMPK的激活会加快宰后肌肉的糖酵解速率,从而导致AICAR组的乳酸含量高于其余两组[4]。乳酸的不断累积是导致宰后肌肉pH下降的主要原因,而宰后胴体pH不正常的降低会容易出现白肌肉(PSE)肉和黑干肉(DFD),两种肉外观颜色均相对差,严重影响销售[5]。由此可以推断,控制宰后肌肉乳酸的积累速率,有利于保护肉色。

图8 成熟期间牦牛肉乳酸含量的变化Fig.8 Changes of lactic acid content of yak beef during postmortem aging
2.8 AMPK活力对宰后牦牛肉LDH活性的影响
LDH是糖酵解和糖异生过程中的关键限速酶,在辅酶NAD+或NADH辅助下,实现乳酸和丙酮酸之间的可逆转化,其活性的降低表明线粒体生理功能随成熟时间的延长逐渐减弱[14]。由图9可知,AICAR组、Compound C组和对照组中LDH活性随着成熟时间的延长逐渐下降。相较于成熟6 h,168 h时三组LDH的活性显著下降(P<0.05),且AICAR组、Compound C组和对照组的LDH活性较成熟6 h时依次下降了36.87%、32.98%和33.67%。说明Compound C组LDH活性下降速率慢于AICAR组和对照组。从整体上来看,在同一成熟时间点,三者LDH活性依次为Compound C组>对照组>AICAR组。并且,除168 h外,在其余时间点,Compound C组的活性均显著高于AICAR组(P<0.05)。说明AMPK的激活会抑制LDH的活性。由于LDH可以促进NADH的生成,从而促使还原酶还原MMb,维持肉色的稳定性[24]。同时,Kim等[25]在研究乳酸含量与肉色稳定性的关系中,得出LDH活性与a*值具有较为显著的正相关性(P<0.05),与MMb相对含量为显著的负相关性(P<0.05)。因此,可以得出AMPK活性的抑制可以提高LDH的活性,从而能够维持肉色稳定。

图9 成熟期间牦牛肉LDH活性的变化Fig.9 Changes of LDH activity of yak beef during postmortem aging
2.9 AMPK活力对宰后牦牛肉己糖激酶活性的影响
己糖激酶在糖酵解过程中以限速酶的身份存在,因此宰后糖酵解的程度和速度受其活性的影响。由图10可知,随着成熟时间的延长,AICAR组、Compound C组和对照组中己糖激酶的活性均呈先上升后下降趋势,与AMPK活性变化趋势相同。在成熟初期(6~12 h),三者己糖激酶活性显著上升(P<0.05),且AICAR组的己糖激酶活性显著高于其余两组(P<0.05),而Compound C组与对照组之间差异不显著(P>0.05);12 h后,三者己糖激酶活性显著下降(P<0.05),且在24~120 h时间段内,对照组的己糖激酶活性显著低于AICAR组(P<0.05),显著高于Compound C组(P<0.05)。宰后牦牛成熟过程中,己糖激酶活性与其AMPK活性变化趋势相一致,说明AMPK的活性可能影响己糖激酶的活性,从而促进糖酵解。Holmes等[26]连续5 d将AICAR注射入老鼠的体内,使AMPK慢慢活化,导致骨骼肌中己糖激酶活性显著增加,进而加速糖酵解的进程,该研究结果证实了上述猜想。

图10 成熟期间牦牛肉己糖激酶活性的变化Fig.10 Changes of hexokinase activity of yak beef during postmortem aging
2.10 AMPK活力对宰后牦牛肉肌酸激酶活性的影响
肌酸激酶与肌肉收缩、能量代谢和ATP合成等过程都具有一定的相关性,磷酸肌酸在肌酸激酶的催化下,能够在动物宰后较短时间内对ATP的消耗起到缓冲作用[9]。由图11可知,随着成熟时间的延长,AICAR组、Compound C组和对照组中肌酸激酶的活性均呈先下降后上升趋势,在成熟初期(6~12 h),三者肌酸激酶活性逐渐上升;12 h后,三者己糖激酶活性逐渐下降。与AMPK活性变化的趋势刚好相反。在整个成熟过程中,Compound C组的肌酸激酶活性始终显著高于AICAR组(P<0.05)。这是由于AMPK与磷酸肌酸供能体系之间存在一定的相互作用,AMPK可以通过磷酸化作用实现对肌酸激酶活性的抑制[9]。AMPK和磷酸肌酸供能体系都对ATP浓度的维持具有一定的作用,因此二者之间可能存在动态平衡,在供能方面具有互补性。

图11 成熟期间牦牛肉肌酸激酶活性的变化Fig.11 Changes of creatine kinase activity of yak beef during postmortem aging
2.11 AMPK活力对宰后牦牛肉GS活性的影响
由图12可知,AICAR组和对照组的GS活性随着成熟时间的延长呈先下降后上升趋势,而Compound C组的GS活性则在成熟6~72 h呈无规律变化,72 h后呈上升趋势。在整个成熟阶段,三者的GS活性始终为Compound C组>对照组>AICAR组,且在成熟6~24 h,Compound C组和对照组的GS活性始终显著高于AICAR组(P<0.05)。由于在离体骨骼肌细胞中,激活AMPK可使己糖激酶和磷酸果糖激酶活化,促使GS失去活性,加快葡萄糖氧化以及糖酵解进程,与此同时糖异生和糖原合成受到抑制[7]。说明AMPK活性的激活,会抑制GS的活性,从而影响糖原含量进而影响糖酵解及肉色。
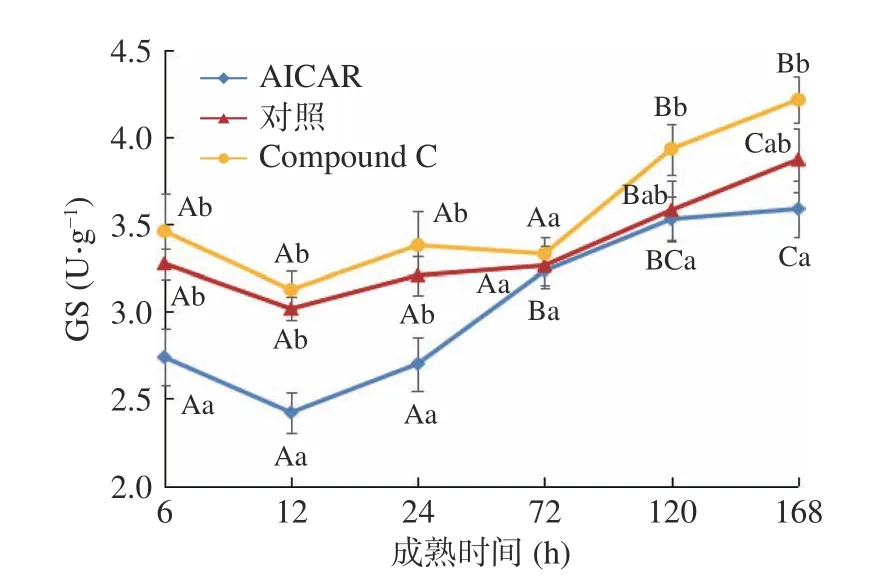
图12 成熟期间牦牛肉GS活性的变化Fig.12 Changes of GS activity of yak beef during postmortem aging
2.12 AMPK活力对宰后牦牛肉NADH含量的影响
由图13可知,AICAR组、Compound C组和对照组的NADH含量随着成熟时间的延长而显著下降趋势(P<0.05)。这是因为在肌肉组织中线粒体结构损伤引起的呼吸作用衰退导致NADH含量显著降低[19]。成熟6 h时,AICAR组、Compound C组和对照组的NADH含量分别为342.87、555.24和456.19 ng/g,成熟168 h时,三者NADH含量依次下降至131.78、306.70和274.75 ng/g。在同一成熟时间点,对照组的NADH含量显著低于Compound C组(P<0.05),且显著高于AICAR组(P<0.05)。由于NADH是MetMbR还原MMb过程中必不可少的一种辅酶[19]。MetMbR活性受NADH浓度变化的影响,当健康畜禽屠宰后胴体中的NADH浓度上升,肌细胞线粒体中的MetMbR活性也相应的有所提高[26]。由此可知,Compound C组MetMbR活性优于其余两组,该结果与图6结果一致。进一步说明肌肉组织中Compound C抑制AMPK的活化,提高了NADH的含量,使得MetMbR活性有所提高,从而增强了肉色的稳定性。

图13 成熟期间牦牛肉NADH含量的变化Fig.13 Changes in NADH content of yak beef during postmortem aging
2.13 能量代谢指标与肉色参数之间的相关系数
由表2可知,a*值与己糖激酶活性、乳酸脱氢酶活性、糖原含量和NADH含量呈极显著的正相关(P<0.01),与肌酸激酶活性和糖原合成酶活性呈极显著的负相关(P<0.01),与乳酸含量呈显著的负相关(P<0.05)。H*值与肌酸激酶活性、乳酸含量呈极显著的正相关(P<0.01),与GS活性呈显著正相关(P<0.05),与LDH活性、糖原含量和NADH含量呈极显著的负相关性(P<0.01)。由于a*值越高,H*值越低,表示肉色越鲜红,说明随着己糖激酶活性、乳酸脱氢酶活性的提高,糖原含量和NADH含量的增加,肌酸激酶活性和糖原合成酶活性及乳酸含量的下降均能在一定程度上使新鲜牦牛肉保持鲜红色。结合前文可知,AMPK活性的抑制能够提高乳酸脱氢酶活性、NADH含量和糖原含量,并且降低乳酸含量来维持肉色的稳定性。由此可以推断,在牦牛背最长肌在成熟过程中,AMPK活性的抑制通过增加NADH的含量、糖原含量、乳酸脱氢酶活性及降低乳酸含量来维持肉色的稳定性。
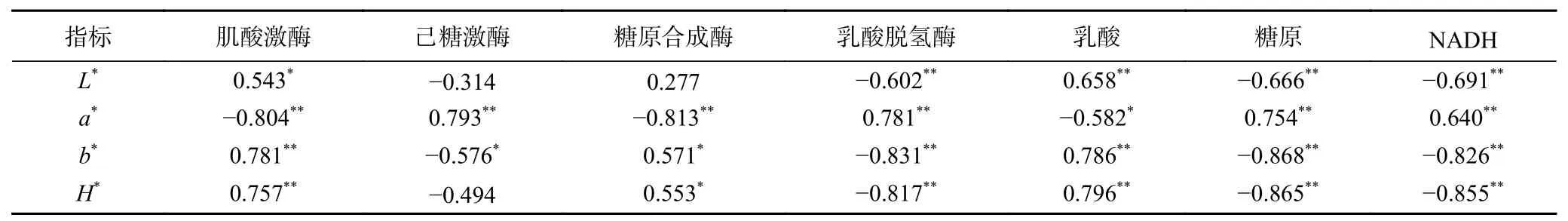
表2 能量代谢指标与肉色参数相关系数Table 2 Correlation coefficients of energy metabolism index and color parameters
3 结论
Compound C能够抑制牦牛宰后成熟过程中AMPK的活性,显著抑制糖原的降解(P<0.05),降低乳酸的积累速率,提高GS、肌酸激酶和LDH的活性,增加NADH含量,抑制己糖激酶活性,同时Compound C组的L*值、b*值、H*值以及MMb含量始终小于对照组,a*值、TMb、OMb含量和MetMbR活性高于对照组。由此可知,AMPK活性的抑制有利于牦牛背最长肌在成熟期间维持肉色的稳定。Compound C并不是肉品加工中普遍存在的试剂,要使牦牛肉肉色在宰后成熟期间维持良好的稳定性,还需要探究通过其他途径对AMPK的活性进行抑制。而代谢压力和导致细胞能量失衡的外源性化合物均可以改变AMPK的活性,比如在营养匮乏、剧烈运动或是热休克条件下都可以将其激活。因此,未来可以对以上几种情况做进一步的探究,从而更好的维持肉色的稳定性。

