小檗胺对牛病毒性腹泻病毒感染BALB/c小鼠的影响研究
付强,李泽宇,贺渊秀,塞力克·杰恩斯,杨莉,岳剑波,史慧君*
(1. 新疆农业大学动物医学学院,新疆 乌鲁木齐 830052;2. 香港城市大学生物医学系,香港 999077)
牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)属于黄病毒科瘟病毒属[1],主要感染牛、羊、猪、鹿等家畜动物及部分野生动物,感染可造成易感动物的牛病毒性腹泻/黏膜病(bovine viral diarrhoea/mucosal disease,BVD/MD)[2],并以幼龄动物易感性最高[3];主要临床表现为高烧、腹泻、白细胞减少、黏膜糜烂、孕畜流产、产死胎和畸形胎、繁殖机能障碍等[4]。尤其是非致细胞病变型(non-cytopathic biotype,NCP)感染妊娠早期母牛导致小牛出生后产生持续性感染(persistent infection,PI)[5],长期或终生带毒,并经常、反复、不定期向外排泄病毒,成为重要的传染源[6];同时PI犊牛一旦感染CP型BVDV[7],可造成严重的黏膜病,表现为严重的口腔、食管和肠道等部位的黏膜糜烂、脱落、溃疡、出血性炎症、脱水、运动失调等,致死率高达100%,而且BVDV常污染血清、冻精、冻胚等,对畜牧业的健康发展和牛源生物制品质量提高等造成巨大的威胁[8-9]。目前我国尚无有效的药物、疫苗和防控措施防控BVD[10]。
天然小分子化合物小檗胺(berbamine,BBM)是提取于小檗属植物中的一种双苄基异喹啉类生物碱[11]。目前,临床医学上BBM是一种成熟的化学药物,用于化疗、放疗及慢性苯中毒后的一种免疫调节剂[12],具有促进白细胞增生、抗炎、抗结核、抗矽肺、抗肿瘤[13]、降血压、抗心肌缺氧缺血、抗心律失常等作用[14]。BBM对细胞毒性T淋巴细胞有抑制作用[15],对小鼠体外自然杀伤细胞活性有明显促进作用,在体内外可诱生出较高水平白细胞介素II(IL-2)[16],可避免用大剂量IL-2治疗肿瘤时引起的毒副反应。此外,BBM还是一种钙调蛋白拮抗剂[17],BBM及其衍生物对脑恶性胶质瘤细胞、人宫颈癌细胞、腹水癌细胞及黑色素瘤细胞都有明显的抑制作用[18]。BBM也可以减少氧自由基的损害作用[19],减轻细胞内钙超载[20],对缺血组织有一定的保护作用以及作为一种自噬调节剂应用于人乳腺癌细胞的治疗[21]。
课题组前期研究发现天然小分子化合物小檗胺抑制BVDV在宿主细胞中的复制[22],而BBM是否抑制BVDV体内复制尚不明确。已有文献报道小鼠可作为BVDV感染模型,病毒感染可造成组织学病变[23]。本研究结合BBM的用药途径及治疗特性[24],在BALB/c小鼠开展BBM预防保护试验和治疗试验,为BBM用于BVD防治提供重要的依据。
1 材料与方法
1.1 病毒和实验动物
BVDV毒株TC由新疆农业大学动物医学院传染病实验室冉多良教授惠赠,BVDV TC为CP型,属于1b基因亚型。BALB/c小鼠购自新疆医科大学实验动物中心,体重约20 g,置于安静、温暖、避强光的环境中饲养。
1.2 试剂
BBM(HY-N0714A)、PEG300(HY-Y0873)和Tween 80(HY-Y1891)购自Med Chem Express公司;DMSO购自美国SIGMA公司;10%中性福尔马林固定液购自生工生物工程(上海)股份有限公司;SYBR Green荧光定量PCR试剂盒购自QIAGEN公司;PrimeScriptTMRT Master Mix(Perfect Real Time)(RR036A)试剂盒购自TaKaRa公司;TRIzol购自Ambion公司;苏木素伊红染色试剂盒(G1120-3)购自索莱宝公司。
1.3 BBM稀释
以50 mg/kg BBM为例,每只小鼠灌胃200 μL,按照以下方法进行稀释:1 mg BBM溶于10 μL DMSO溶液(终浓度5%),配制的母液浓度为100 mg/mL。取10 μL母液,加入60 μL PEG300(终浓度30%),混匀澄清后加入20 μL Tween 80(终浓度10%),混匀澄清后加入110 μL ddH2O,混匀澄清。0 mg/kg BBM中除不含BBM外其他成分剂量相同,100 mg/kg BBM中BBM为2 mg,其他成分剂量相同。
1.4 BBM预防保护试验
将24只BALB/c小鼠随机分成3组,每组8只,感染前使用0、50、100 mg/kg BBM灌胃小鼠,每只小鼠200 μL,每24 h灌胃1次,连续3次;第3次灌胃24 h后滴鼻感染105TCID50BVDV,每只小鼠滴鼻10 μL,48 h后再次感染,再次感染后继续每24 h灌胃0、50、100 mg/kg BBM;首次感染后第5和10天时处死小鼠,每次4只,取肝、脾、肾、小肠等组织,其中以0 mg/kg BBM为对照组,50、100 mg/kg BBM为试验组进行后续荧光定量PCR并于40倍镜下观察各组织病理变化。
1.5 BBM治疗试验
将24只BALB/c小鼠随机分成2组,每组12只,使用105TCID50BVDV滴鼻感染,48 h后再次感染,感染后分别使用0和100 mg/kg BBM灌胃小鼠,每24 h 1次,于首次感染后第3、6和10天时处死小鼠,每次4只,取肝、脾、肾、小肠等组织,其中以0 mg/kg BBM为对照组,100 mg/kg BBM为试验组进行后续荧光定量PCR并于40倍镜下观察各组织病理变化。
1.6 qPCR检测病毒载量
取肝、脾、肾、小肠等组织按田瑞鑫等[25]方法提取RNA反转录成cDNA,使用荧光定量PCR检测BVDV 5′UTR水平。检测Ct值并与标准曲线比对后使用GraphPad Prism 5.0软件作图。病毒载量(copies/mL)=(6.02×1023copies/mol)×(浓度g/mL)/(分子量 g/mol)。
1.7 组织病理切片检测各组织病变情况
取肝、脾、肾、小肠等组织按文献[26]制成组织切片,HE染色后使用中性树胶进行封片,显微镜下(40×)观察组织病理变化情况;各组织病理变化程度以“-”无病变,组织完整无出血点;“+”轻度病变,组织肿大,被膜紧张,有少量出血点;“++”中度病变,组织有大量出血斑并形成白色坏死灶;“+++”严重病变,组织严重出血坏死,质地软烂如泥等情况判定。
1.8 统计学分析
使用SPSS 17.0软件进行两独立样本t检验和单因素方差分析,数值以“平均值±标准误”,柱状图使用GraphPad Prism 5作图。
2 结果
2.1 BBM预防保护BALB/c小鼠感染BVDV
0 mg/kg BBM预处理然后感染BVDV的小鼠表现出现精神沉郁、腹泻等BVDV感染的示病症状。解剖可见肝脏有出血点,脾边缘发绀并伴有肿大,肠道内容物呈黄色水样状,肾脏表面充血、水肿质地变软。荧光定量结果如图1所示,在5 d和10 d对照组各组织中BVDV 5′UTR水平较50 mg/kg和100 mg/kg处理组显著升高;50 mg/kg BBM 预处理然后感染BVDV的小鼠精神状态良好,病理剖检可见肝、脾、肾、小肠等组织无出血点,各组织中BVDV 5′UTR水平较0 mg/kg的对照组显著降低,与其他组织相比,小肠中降低最为明显,而BVDV感染10 d时肾脏中5′UTR水平降低最明显,约降低72倍;BVDV感染50 mg/kg BBM处理小鼠精神状态良好,但被毛蓬乱,病理剖检可见肝、脾、肾、小肠等组织有少量血点,10 d时各组织中5′UTR水平均出现显著性降低,而5 d时肾脏和脾脏中5′UTR水平改变未出现显著性差异。

注:同一组织不同BBM剂量组与对照组(0 mg/kg)比较,*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。下同
取肝、脾、肾、肠4个组织进行HE染色,观察结果(图2)显示:BVDV感染可引起肾脏出血、肾小球充血水肿及炎性细胞增多等现象;100 mg/kg BBM处理小鼠5、10 d,可显著抑制肾脏出血及肾小球肿大;50 mg/kg BBM处理小鼠5、10 d,可有效减缓肾小球充血肿大,减少炎性细胞浸润,使肾小球和肾小管间质病变均匀。BVDV感染导致的肝脏出血、肝静脉充血、肝细胞中可见少量颗粒状物质,细胞质呈空泡状等;50 mg/kg BBM处理小鼠5、10 d,可减少肝脏出血、肝静脉充血;100 mg/kg BBM处理5 d可减轻上述症状;10 d可显著抑制肝脏出血、肝静脉充血,减少细胞中颗粒状物质产生及细胞质空泡状现象的发生,使肝小叶结构完整、中央静脉清晰、肝细胞索呈整齐的放射状。BVDV感染可致小鼠脾脏充血,红细胞显著增多,红髓与白髓界限不清晰,小梁增多;50 mg/kg BBM处理BALB/c小鼠5 d可减少脾脏充血,中性粒细胞增多;10 d时脾小梁减少,巨细胞增多,100 mg/kg BBM处理5 d可减少组织充血,白细胞增多,10 d时脾脏充血显著减轻且红髓与白髓界限清晰,出现少量巨细胞。BVDV感染可致小鼠小肠黏膜充血水肿,黏膜下层的炎性细胞增多,肠绒毛代偿性增宽且缩短,隐窝减少且形态改变;50 mg/kg BBM处理小鼠5 d可减少小黏膜下层的炎性细胞浸润,10 d可使隐窝增多,肠绒毛增长且隐窝增大;100 mg/kg BBM处理5、10 d可使肠绒毛上皮细胞由多层变为单层。对每组具体病变程度见表1,结果表明 BBM处理BALB/c小鼠可有效抑制BVDV感染。
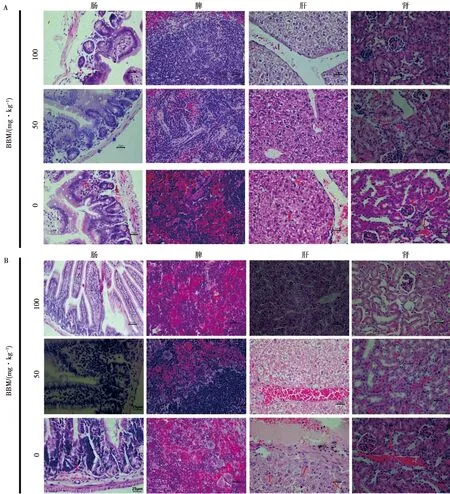
A. BVDV感染5 d;B. BVDV感染10 d
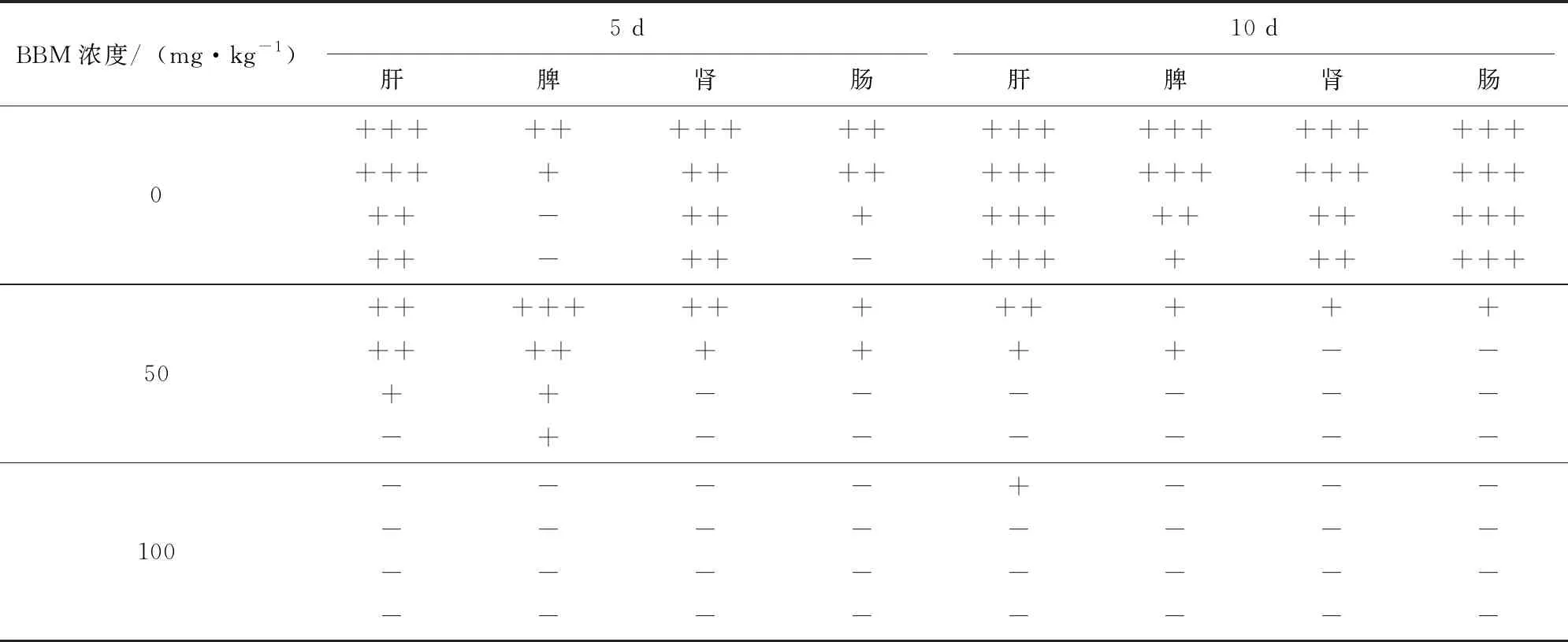
表1 BVDV感染BBM预处理BALB/c小鼠不同时间后各组织病理变化程度
2.3 BBM对BVDV感染的治疗作用
如图3所示,对照组中BVDV感染小鼠3、6和10 d后5′ UTR水平均较高,100 mg/kg BBM治疗后各组织中BVDV 5′ UTR水平显著性降低,其中BVDV感染10 d时,治疗组肝脏中5′ UTR水平下降最为明显,约降低26倍。

A. BVDV感染3 d;B. BVDV感染6 d;C. BVDV感染10 d
分别取肾、脾、肠、肝4个组织进行HE染色,病理变化结果如图4所示。与相应对照组相比:100 mg/kg BBM处理BALB/c小鼠3 d可抑制BVDV感染引起的肾脏出血现象,6 d可减轻肾小球充血水肿等症状,10 d可显著减少炎性细胞增多情况;BBM处理小鼠3 d 可减轻BVDV感染导致的小鼠脾脏中巨噬细胞增多的症状,6 d改善红细胞增多、小梁增多等现象,10 d可显著减少脾脏充血、减少脾小梁、改善红髓与白髓界限不清晰等情况,同时中性粒细胞、巨细胞、白细胞数量等增多;BBM处理小鼠3 d可减少小黏膜下层的炎性细胞浸润,使肠绒毛增长隐窝增多且增大,6 d可使肠绒毛上皮细胞由多层变为单层,10 d可显著抑制小肠黏膜充血水肿,黏膜下层的炎性细胞增多,肠绒毛代偿性增宽且缩短,隐窝减少且形态改变等情况;BBM处理小鼠3 d可减少BVDV感染导致的肝脏出血、肝静脉充血,6 d可使肝细胞索排列整齐,细胞质呈空泡状现象改善,10 d可显著抑制肝脏出血、肝静脉充血,减少细胞质空泡状现象的发生,使肝小叶结构完整、中央静脉清晰、肝细胞索呈整齐的放射状。对每组具体病变程度进行分析(表2),结果显示100 mg/kg BBM治疗能有效缓解BVDV感染所致的小鼠组织损伤。
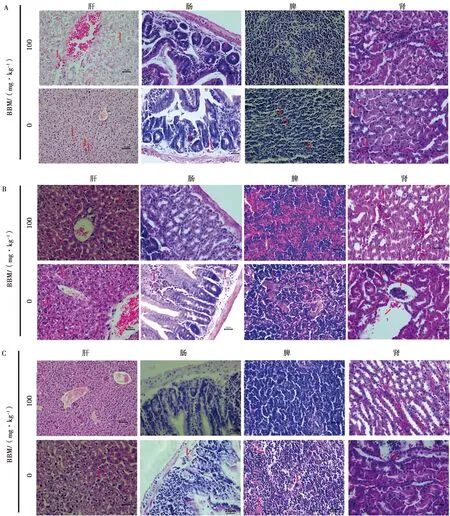
A. BVDV感染3 d;B. BVDV感染6 d;C. BVDV感染10 d

表2 BBM治疗BVDV感染BALB/c小鼠不同时间后各组织病理变化检测
3 讨论
BBM是一种双苄基异喹啉类生物碱,具有促进白细胞增生、抗炎、降血压、抗心肌缺氧缺血等功能,常用于免疫调剂化疗、放疗及慢性苯中毒后综合症[27]。而目前BBM是否具有抗病毒作用尚未见报道。课题组前期研究发现BBM可有效抑制BVDV在牛肾细胞(Madin-Darby bovine kidney,MDBK)中的复制[22],而BBM是否能防控BVDV感染BALB/c小鼠,尚未见报道。本研究开展BBM预防保护试验以阐明BBM预防BVDV感染BALB/c小鼠的作用,结果发现当使用100 mg/kg剂量BBM提前灌胃BALB/c小鼠可有效降低BVDV感染程度,减轻BVDV感染造成的各器官组织病理损伤;而前期研究发现使用BBM预处理MDBK能有效抑制BVDV在MDBK细胞内的双链RNA积累、5′UTR复制、致细胞病变效应(cytopathic effect,CPE)、滴度变化等,综上BBM不仅能抑制BVDV感染宿主细胞,而且能有效保护BALB/c小鼠阻止BVDV感染。此外,本研究使用BBM治疗BVDV感染的BALB/c小鼠,结果发现BBM处理后有效抑制BALB/c小鼠中BVDV的RNA复制,减弱BVDV感染BALB/c小鼠后造成的病理损伤。
Seong等[28]发现导致BVDV感染小鼠的组织病理变化存在一定差异,但原因尚不清楚,可能与研究中使用的病毒株的毒力强弱和组织的差异性有关,也有可能是病毒感染途径和攻毒剂量的不同所导致。根据BBM的用药方法及吸收-代谢机制,灌胃的BBM通过肠吸收后经肝脏代谢,故选择肝脏、肠;考虑BBM是否具有一定肾毒性,故选择肾脏;同时因BVDV感染特性严重影响其机体免疫,故选择免疫器官脾,关于脾脏病毒含量很低的原因或与感染途径相关,与Seong等[28]结果相似,但不同之处在于本试验使用的BVDV(CP型)株毒力较强,具有短时间致消化系统病变的特点。尽管如此,100 mg/kg BBM对该BVDV毒株仍具有预防及治疗作用。
BVDV、牛冠状病毒(bovine coronavirus,BCoV)、牛轮状病毒(bovine rotavirus,BRV)、牛肠道病毒(bovine enterovirus,BEV)等感染是犊牛腹泻的主要致病因素。而在大群密集饲养时,犊牛腹泻发生率常达90%以上,死亡率最高可达50%以上,对养牛业的发展威胁严重[29]。而BVDV、BCoV、BRV、BEV均属于RNA病毒,那么BBM是否具有抑制BCoV、BRV、BEV感染的作用,值得进一步研究。
综上,本研究从BBM预防保护试验和治疗试验两个角度证实了BBM对BVDV感染BALB/c小鼠的防控作用,为探讨BBM防控BVD提供有力的依据。

