注水结肠镜下黏膜切除术治疗结直肠无蒂大息肉的疗效及安全性分析
陈风娟 杨晓军 江苏省无锡市锡山人民医院消化内科 214000
结直肠息肉是指结直肠表面隆起,并凸向肠腔内的病变,其可分为有蒂息肉、压蒂息肉和无蒂息肉,其中无蒂息肉发生癌变风险更大[1-2]。结肠镜下电切术具有微创、价格低廉等优点,结肠镜下可直接观察息肉位置、形态、大小,初步判断息肉病理类型,切除息肉,疗效确切,已成为临床治疗结肠息肉的常用术式[3]。注水结肠镜下黏膜切除术是将适量生理盐水向肠腔内灌注,利用水的浮力作用将固有肌层和黏膜下层分开,无须实施黏膜下注射,便能将结直肠息肉安全切除。本文分析注水结肠镜下黏膜切除术治疗结直肠无蒂大息肉的疗效及安全性,为临床对结直肠无蒂大息肉治疗方案的制定提供参考。报道如下。
1 资料与方法
1.1 一般资料 选择2018年6月—2020年6月就诊于我院的结直肠无蒂大息肉患者126例,按随机数字表法分为试验组和对照组,各63例。试验组年龄20~83岁,平均年龄(57.32±3.14)岁;男41例,女22例;息肉部位:乙状结肠25例,直肠23例,降结肠4例,升结肠3例,横结肠8例。对照组年龄22~81岁,平均年龄(57.28±3.09)岁;男43例,女20例;息肉部位:乙状结肠26例,直肠22例,降结肠3例,升结肠1例,横结肠11例。对比两组一般资料,无统计学差异(P>0.05)。
1.2 入选标准 (1)纳入标准。息肉最大直径24mm;经超声或CT检查确诊为结直肠无蒂大息肉;临床资料完整;多发息肉。(2)排除标准。重要器官功能障碍;凝血功能障碍;感染性疾病;内镜治疗禁忌证;免疫功能缺陷;家族性腺瘤性息肉病。
1.3 方法 试验组行注水法结肠镜下黏膜切除术,对照组结肠镜下电切术治疗。术前,所有患者均实施常规肠道准备,2 000ml温水冲服复方聚乙二醇电解质散2袋,分别于术前1d 20点和术日早6点服用。对照组患者取仰卧位,将奥林巴斯H290结肠镜插入至回肠。息肉充分显露后,对内镜角度旋钮调节,改变身体方向,完全将息肉保留在视野范围内,对息肉的底部、大小观察。将高频电源打开,息肉底部用调整erbevio-200d 高频电切发生器夹住,缓慢拧紧,完成电切。若存在残余切口,需用热活检或圈套器切除处理,以充分止血。移除病变实施病理检查。再次将结肠镜置入,观察有无出血、残留病灶等。若患者存在出血现象,可按照创面深度和大小实施缝合。检查腹部、身体,观察所有伤口有无出血,确认患者无腹痛、腹胀后停止治疗。试验组患者取仰卧位,将结肠镜置入,仔细寻找息肉位置,对病变表面和周围黏膜充分冲洗后,将肠腔内气体吸尽后,经注水泵注入适量生理盐水,一般为100~300ml,确保生理盐水完全浸泡息肉,待病变部位呈水草般漂浮状时,用圈套器将息肉基底部套住后收紧,通电切除,电凝25W,电切30W。若息肉过大,则可以采用分片切除法将息肉切除。结肠镜下观察创面及其周围组织,若有残留病变,则使用氩离子凝固术或高频电热活检钳处理。术后,所有患者均接受禁食6h、卧床休息、常规补液、给予营养补充和水电解质补充等处理。
1.4 观察指标 (1)比较两组围术期指标,即术中出血量、手术时间、息肉完全切除率、术后住院时间。完全切除:病灶边缘与切除口距离有2mm。(2)比较两组并发症发生情况,包括穿孔、迟发性出血、腹痛等。
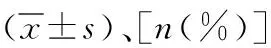
2 结果
2.1 围术期指标 试验组息肉完全切除率为98.41%(62/63),高于对照组的87.30%(55/63),有统计学差异(χ2=4.308,P=0.016)。试验组术中出血量较对照组少,有统计学差异(P<0.05);两组术后住院时间、手术时间相比,无统计学差异(P>0.05)。见表1。
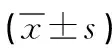
表1 两组围术期指标对比
2.2 并发症 试验组并发症发生率较对照组低,有统计学差异(χ2=6.952,P=0.008<0.05)。见表2。

表2 两组围术期并发症发生情况对比[n(%)]
3 讨论
结直肠息肉发生可能与遗传因素、病毒感染、慢性机械刺激等因素有关,其导致患者发生一定程度的腹胀、便秘、腹泻等症状,若治疗不当或不及时,随着病情进展可引起黑便、血便。大便习惯或性状改变等,甚至会诱发肠套叠、消化道出血、肠梗阻等[4-5]。结直肠无蒂大息肉是结直肠息肉中切除难度最大的一类病变,其基底广,易出现穿孔、大出血等严重并发症,且癌变风险较大[6]。与传统开腹手术相比,结肠镜下电切术具有创伤小、费用低、手术时间短、安全简便、确保完整切除息肉等优点,逐渐成为治疗结直肠息肉的首选手段。但术中会向肠腔内注入气体,因气体的强流动性和不可预见性,易造成肠壁变薄,穿孔风险较大,同时术中利用电灼效应产生高温,蒸发水分,凝固蛋白质,易出现电凝过度的情况,组织损伤程度进一步加深,焦痂脱落后,易形成较深的溃疡,导致患者发生迟发性出血等并发症[7]。
本文结果显示,试验组息肉完全切除率高于对照组,术中出血量较对照组少,并发症发生率较对照组低;两组手术时间、术后住院时间相比无明显差异,提示注水结肠镜下黏膜切除术治疗结直肠无蒂大息肉能够提高息肉完全切除率,减少术中出血量,提高手术安全性。对于常规内镜下黏膜切除术而言,圈套时常需负压吸引,因腔内气压变化的影响会造成肠腔变形,术野受到影响,并会增加黏膜肌层误入圈套器风险,而注水结肠镜下黏膜切除术能够避免上述现象发生,被水充盈的肠腔能够为术者提供良好的视野,便于观察肠腔转折处的息肉,同时水对病灶所在的黏膜下层、黏膜层产生与“浮力”相似的作用,可易化其与固有肌层游离过程,加上水能够吸收和传递热能,可有效减少息肉周围肠壁烧伤的风险[8-10]。临床在实施注水结肠镜下黏膜切除术治疗时需注意以下几点:(1)水作为介质,具有放大病灶的作用,术前须充分注水,便于确定息肉边界;(2)尽量选择冰生理盐水灌注,其具有更好的散热作用和收缩血管作用,能够降低深层组织损伤致穿孔风险、减少出血可能。(3)息肉完整切除后,用氩离子凝固术处理创面所有岛状隆起、小血管,并于创面切缘外约2.5cm处喷凝,若病灶>30mm需分片处理,且圈套器收紧时需提起病变组织,避免对深层组织误套而发生穿孔。
综上所述,结直肠无蒂大息肉接受注水结肠镜下黏膜切除术治疗具有出血量少、息肉完全切除率高、并发症少等优点,值得临床推广。

