精脒对衰老兔骨髓间充质干细胞成骨分化的影响及机制研究
张广维,侯 颖,吴方丽,毕丽霞,李 爽,党瑞杰,田萧羽,朱 彪 火箭军特色医学中心 口腔科,北京 00088; 首都医科大学附属复兴医院 口腔科,北京 0008; 解放军总医院第一医学中心 口腔科,北京 0085
随着全球人口老龄化的快速发展,老年性骨质疏松症患病率逐年升高,已成为严重威胁人类生存健康的重大公共卫生问题之一[1]。老年性骨质疏松是口腔种植手术的相对禁忌,改善老年性骨质疏松症对于提高种植手术成功率具有重要意义[2]。骨髓间充质干细胞(bone-marrow mesenchymal stem cells,BMSCs)是骨形成的重要细胞来源[3]。促进BMSCs向成骨细胞分化是改善老年性骨质疏松的重要手段。在机体衰老进程中,BMSCs也表现出增殖缓慢、生长停滞并丧失分化能力等特征[4]。多胺是一类广泛分布于哺乳动物细胞内的脂肪族小分子化合物,包括腐胺、精胺和精脒(Spermidine)等[5-6]。动物实验发现,Spermidine可延长老龄小鼠的寿命且具有心脏保护功能;临床试验也表明,Spermidine可降低血压并减少心血管疾病的患病率[7]。但Spermidine能否促进衰老BMSCs成骨分化尚不清楚。因此,本研究拟探讨Spermidine对衰老兔BMSCs成骨分化的影响及其作用机制,为临床改善老年性骨质疏松提供实验基础。
材料与方法
1 细胞、试剂与仪器 冻存的新西兰大白兔BMSCs(解放军总医院转化医学中心实验室);D-半乳糖组(D-galactose,D-gal;北京索莱宝科技有限公司);Spermidine(美国Sigma公司);α-MEM培养基(美国Gibco公司);MTT(国药集团);成骨诱导液(苏州赛业生物科技有限公司);小牛血清(杭州四季青生物工程材料有限公司);胰酶、锥虫蓝(美国Sigma公司);青霉素及链霉素(石家庄华北制药);烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)/还原型NAD+(NADH)试剂盒(上海碧云天生物);Sirt1抗体(货号:Sc-15404,稀释比例1∶300;美国Santa cruz公司);β-actin抗体(货号:BM0627,稀释比例1∶200;武汉博士德生物工程有限公司)及山羊抗兔二抗(美国Cell Signaling Technology公司);CD11b、CD44、CD45、CD31、CD34、CD73、CD90、CD105、CD29抗体(美国BD公司);BCA测定试剂盒(武汉博士德生物工程有限公司);PVDF膜(美国Millipore公司)。Herocell 180型CO2恒温培养箱(上海润度生物科技有限公司);SW-CJ-1FD型生物净化工作台(苏州安泰);TD5K-Ⅱ型低速离心机(长沙东旺实验仪器);Biophotometer核酸蛋白测定仪(德国Eppendorf公司);CytoFLEX型流式细胞仪(美国Beckman Coulter公司);DYY-7C型电泳仪、DYCZ-40型转膜仪(北京六一仪器厂);LW300LFT型正置 荧光显微镜(日本Olympus公司)。
2 流式细胞术鉴定BMSCs表型 复苏培养兔BMSCs,采用0.5%胰酶消化第3代BMSCs制成单细胞悬液备用。于BMSCs单细胞悬液中分别加入荧光标记的抗CD11b、CD29、CD31、CD34、CD44、CD45、CD73、CD90、CD105抗体[8],4℃避光孵育30 min。PBS缓冲液洗去未结合的抗体 ,上机检测并用FlowJo软件进行数据分析。
3 NAD+/NADH比例测定 将第3代BMSCs分为3组:对照组(Vehicle,培养基中不加入任何药物),D-gal诱导衰老组(培养基中加入40 g/L D-gal诱导BMSCs衰老),Spermidine组(培养基中加入40 g/L D-gal + 3 µmol/L Spermidine处理BMSCs)。加药后各组细胞继续培养3 d,倒掉培养板中的培养液,每孔加入200 µL NAD+/NADH提取液,轻轻震荡培养板促使细胞裂解。测定NAD+&NADH时,20 µL NAD+/NADH提取液加入90 µL现配的乙醇脱氢酶工作液,37℃避光孵育10 min(在无CO2的环境中操作),再加入10 µL显色液避光孵育30 min,于酶标仪450 nm处检测吸光度值。测定NADH时,首先将NAD+/NADH提取液于60℃下水浴30 min,其余实验步骤同测定NAD+&NADH。N AD+/NADH=(NAD+&NADH-NADH)/NADH。
4 MTT法检测细胞增殖活性 将Vehicle组、Dgal诱导衰老组和Spermidine组细胞以1.0 × 103/孔的密度接种于96孔板,接种后连续9 d测定细胞的增殖活性。测定时,每孔加入20 µL 5% MTT溶液,继续培养4 h。吸出培养液,每孔加入100 µL DMSO,置摇床上振荡10 min,于酶标仪492 nm处 检测吸光值。
5 Western blot检测Sirt1蛋白的表达 将Vehicle组、D-gal诱导衰老组和Spermidine组细胞成骨诱导7 d后检测Sirt1的表达。以β-actin为内参,检测 实验步骤参照文献[9-10]。
6 qPCR检 测 成 骨 相 关 基 因 的 转 录 表 达 将Vehicle组、D-gal诱导衰老组、Spermidine组、Sirt1基因沉默组(Si Sirt1,40 g/L D-gal + 3 µmol/L Spermidine + 50 nmol/L siRNA Sirt1)和基因沉默对照 组(Si Control,40 g/L D-gal + 3 µmol/L Spermidine + 50 nmol/L siRNA Control)细胞成骨诱导培养7 d后提取RNA。然后检测Runt相关转录因子(runt-related transcription factor 2,Runx2)、锌指结构转录因子(osterix,Osx)、碱性磷酸酶(alkaline phosphatase,ALP)和骨钙素(osteocalcin,OCN)的转录表达。基因引物由上海申工合成,序列 见表1。

表1 成骨相关基因引物序列Tab. 1 Primer sequences of osteogenic genes
7 统计学处理 使用SPSS 26.0软件进行数据处理,正态分布的计量资料以 x±s表示,组间比较采用单因素方差分析,如果方差齐采用LSD法进一步比较,如果方差不齐采用Tamhane’s T2法进一步比较。方差齐性检验采用Levene’s检验,检验 水准α=0.1。P<0.05为差异有统计学意义。
结 果
1 体外衰老兔BMSCs细胞模型的建立 流式细胞术结果显示(图1A),BMSCs低表达造血干细胞表面标志物CD11b(4.84%)、CD31(1.09%)、CD34(1.23%)和CD45(3.72%);高表达间充质干细胞表面标志物CD29(99.0%)、CD44(99.6%)、CD73(91.9%)、CD90(99.4%)和CD105(99.5%)。上述实验结果表明,我们成功分离并培养出了兔BMSCs。细胞内NAD+/NADH水平下降是细胞衰老的一个重要特征。图1B显示,与Vehicle组相比,D-gal诱导衰老组BMSCs细胞内NAD+/NADH比例显著降 低,这表明采用D-gal成功诱导兔BMSCs衰老。
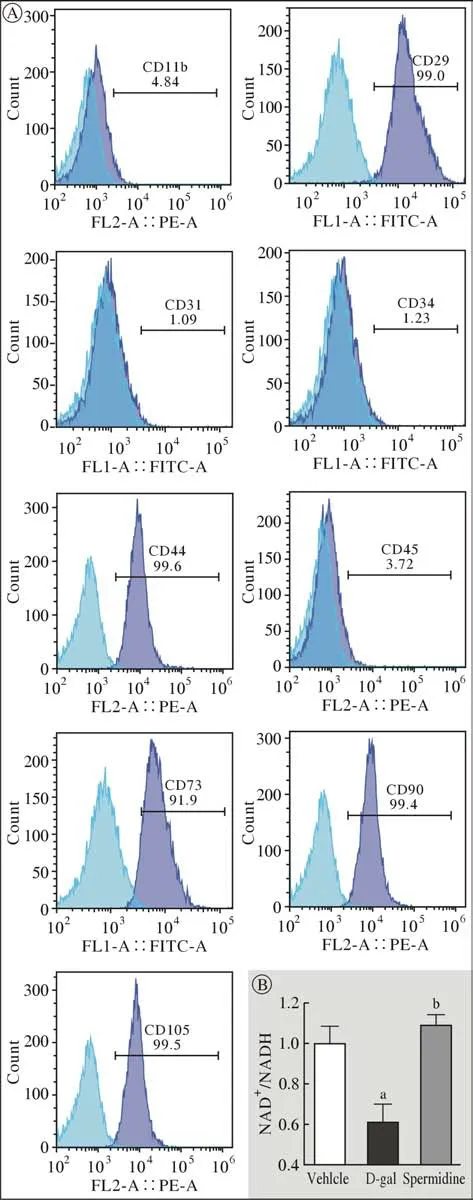
图1 兔BMSCs细胞衰老模型的建立A:兔BMSCs细胞表面标志物的鉴定;B:BMSCs细胞NAD+/NADH比例(aP < 0.05,vs Vehicle组;bP < 0.05,vs D-gal组)Fig.1 Cell senescence modeling of rabbit BMSCs A: Flow cytometric analysis of surface markers of rabbit BMSCs; B:NAD+/NADH (aP < 0.05, vs vehicle group; bP <0.05, vs D-gal group)
2 Spermidine对衰老BMSCs细胞增殖的影响 如图2所示,各组细胞的生长曲线均呈“S”形。与Vehicle组相比、D-gal诱导衰老组BMSCs的增殖活性显著降低。在培养的第8天BMSCs的增殖活性达到峰值;Spermidine干预可显著提高衰老B MSCs的增殖活性。
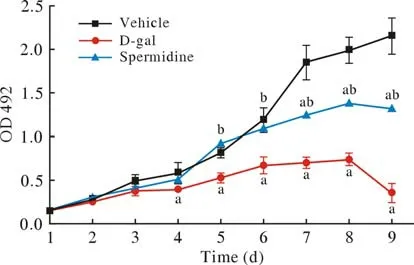
图2 Spermidine对衰老BMSCs细胞增殖的影响(aP < 0.05, vs Vehicle组; bP < 0.05, vs D-gal组)Fig.2 Effect of spermidine on senescent BMSCs growth (aP < 0.05,vs vehicle group; bP < 0.05, vs D-gal group)
3 Spermidine对Sirt1蛋白表达的影响 如图3所示,在成骨分化的过程中,与Vehicle组相比,D-gal诱导衰老组BMSCs细胞内Sirt1蛋白的表达显著降低(P<0.05),而Spermidine组衰老BMSCs细 胞内Sirt1表达有升高的趋势。

图3 Spermidine对衰老BMSCs细胞内Sirt1表达的影响(aP <0.05, vs Vehicle组)Fig.3 Effect of spermidine on Sirt1 expression in senescent BMSCs(aP < 0.05, vs vehicle group)
4 Spermidine对成骨相关基因转录表达的影响 如图4所示,在BMSCs成骨分化的过程中,与Vehicle组相比,D-gal组成骨相关基因Runx2、Osx和ALP的转录水平明显下调(P<0.05);而Spermidine干预可提高Runx2、Osx和ALP的转录表达水平(P<0.05);当使用siRNA抑制Sirt1蛋白的表达后,Spermidine上调Runx2、Osx和A LP的转录表达的作用明显减弱(P<0.05)。
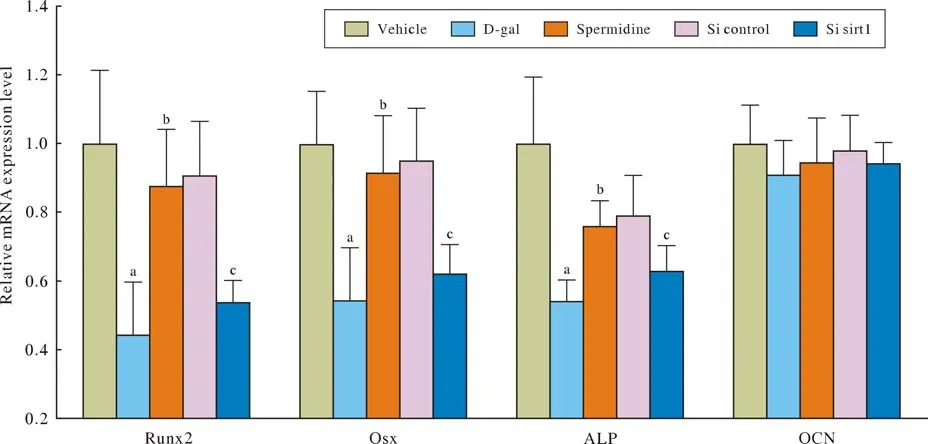
图4 Spermidine对成骨相关基因转录表达的影响(aP < 0.05, vs Vehicle组; bP < 0.05, vs D-gal组;cP < 0.05, vs Spermidine组)Fig.4 Effect of spermidine on osteogenic gene expression (aP < 0.05, vs vehicle group; bP < 0.05, vs D-gal group, cP < 0.05, vs spermidine group)
讨 论
本研究首次发现,Spermidine可提高衰老BMSCs细胞内NAD+/NADH水平,促进衰老BMSCs增殖与成骨分化。Spermidine促进衰老BMSCs成骨分化的作用与激活Sirt1有关。
NAD+是活细胞内糖酵解、三羧酸循环和氧化磷酸化等代谢途径中脱氢酶的辅酶,具有传递氢和电子的功能[11]。NAD+广泛参与机体物质与能量代谢、DNA损伤修复等生理或病理过程的调节[12]。本研究发现,衰老BMSCs细胞内的NAD+/NADH比例下降,而Spermidine可提高细胞内NAD+/NADH水平。同时,NAD+也是多种NAD+依赖性水解酶的底物,如Sirt1与CD38等[13]。细胞内NAD+/NADH比例升高可激活Sirt1。Sirt1这种NAD+依赖性的去乙酰化酶在衰老的过程中表达下调,而且Sirt1是抗衰老的关键酶之一[14],激活Sirt1可改善高脂饮食小鼠的寿命并提高其生活质量[15]。本研究在发现Spermidine可提高衰老BMSCs细胞内NAD+/NADH水平的基础上进一步证实Spermidine可在某种程度上恢复衰老细胞内Sirt1蛋白的表达水平。
增殖能力下降是细胞衰老的一个主要表型[16]。本研究显示,D-gal诱导衰老后BMSCs增殖能力显著下降,而Spermidine可提高衰老BMSCs的增殖能力。既往研究也发现,采用多胺合成的限速酶鸟氨酸脱羧酶抑制剂α-二氟甲基鸟氨酸降低细胞内的腐胺和Spermidine水平后,BMSCs的增殖能力显著下降[17],这与本研究中MTT检测BMSCs增殖活性的实验结果一致。成骨分化能力下降是BMSCs衰老的另一个重要表型[18]。本研究qPCR结果显示,D-gal诱导后BMSCs成骨分化能力减弱,而Spermidine可提高衰老BMSCs的成骨分化能力。且抑制Sirt1后,Spermidine提高衰老BMSCs成骨分化能力的作用明显减弱,说明Spermidine提高衰老BMSCs成骨分化的能力部分是通过激活Sirt1实现的。
D-gal是一种广泛存在于水果和蔬菜中的单糖,在衰老研究中被用于诱导衰老[19]。文献报道,D-gal诱导衰老的主要机制是诱导细胞内的氧化应激损伤[4,20-21]。但本研究未进一步验证Spermidine提高衰老BMSCs成骨分化的能力是否与缓解细胞内的氧化应激损伤有关,这是本研究的一个局限。氧化应激损伤在Spermidine提高衰老BMSCs成骨分化能力中的作用值得深入探讨。
综上所述,本研究发现Spermidine可在体外提高衰老BMSCs的成骨分化能力,且这种作用与激活Sirt1有关。

