吉马酮调控JAK2/STAT3信号通路对卵巢癌SKOV3细胞增殖、迁移、侵袭的影响
何超月,任黔川
西南医科大学附属医院,四川泸州 646000
卵巢癌是女性生殖系统常见的恶性肿瘤之一,发病率仅次于子宫颈癌及子宫体癌,其早期病变一般无明显症状及体征,且早期筛查缺乏敏感度,病情进展较快,死亡率居各类妇科肿瘤的首位,严重威胁广大妇女生命健康[1]。目前卵巢癌的一线治疗方式为先行标准的肿瘤细胞减灭术,术后进行以紫杉醇和铂类药物为主的化疗。虽然化疗药物的作用机制明确,疗效显著,但有一定的毒性及耐药性[2]。近年来国内外文献大量报道一些中药治疗卵巢癌具有多靶点、多途径、不良反应小、经济有效等优势[3-4],吉马酮是从莪术中提取的一种单环倍半萜类天然化合物,具有抗病毒、抗菌、抗炎、抗氧化等药理作用[5-6]。本文主要研究吉马酮对卵巢癌SKOV3细胞增殖、迁移、侵袭的影响及其作用机制,以期为研究吉马酮治疗卵巢癌提供实验基础。
材料与方法
1 实验试剂与仪器 吉马酮(上海源叶生物,货号B20589)分子式C15H22O,规格20 mg,纯度HPCL ≥ 98%。二甲基亚砜(DMSO)溶解吉马酮,并经直径0.22 µm除菌滤器过滤分装后作为母液,置于-20℃冰箱保存备用。人卵巢癌SKOV3细胞(第4代,由西南医科大学中心实验室提供);人正常卵巢上皮细胞IOSE-80(第4代,广州佰汇生物,货号FH1132)。McCoy’5A培养基(普诺赛,货号PM150710),RPMI1640培养基(Gibco,货号c11875500bt),胎牛血清(杭州四季青,货号11011-8611),CCK8试剂盒(同仁化学,货号CK04),Transwell小室(康宁,货号P0012),基质胶(康宁,货号356234),BCA蛋白浓度测定试剂盒(碧云天,货号P0012),ECL发光液(葆光生物,货号GB0001),兔抗人JAK2、STAT3、p-JAK2、p-STAT3、MMP2、MMP9抗体(万类生物,货号WL01836),HRP标记的山羊抗兔IgG(万类生物,货号WLA023)。超净工作台,酶标仪,倒置相差显微镜,BIO-RAD垂直电泳仪等。
2 细胞培养 将SKOV3细胞培养于McCoy’5A培养基(含1%青霉素-链霉素双抗,10%胎牛血清),将人正常卵巢上皮细胞IOSE-80培养于RPMI 1640培养基(含1%青霉素-链霉素双抗,10%胎牛血清),37℃、5% CO2孵箱培养,当细胞 生长密度达到80%~90%时,进行传代培养。
3 CCK-8法检测细胞活性 设置浓度70 µmol/L、140 µmol/L、210 µmol/L、280 µmol/L、350 µmol/L吉马酮组,对照组(0 µmol/L)和空白对照组(无卵巢癌SKOV3细胞、正常卵巢IOSE-80细胞)。取呈对数生长期的SKOV3细胞及IOSE-80细胞,分别用相应的完全培养基重悬细胞,接种于96孔板中,每孔5 000个细胞,每组设置3个复孔。置于37℃、5% CO2培养箱中培养24 h使细胞贴壁后更换为完全培养基配置的各个浓度吉马酮溶液,继续培养24 h、48 h、72 h。弃培养基,每孔加入新鲜培养基100 µL及CCK8试剂10 µL,放入孵箱孵育0.5 h、1 h、2 h和4 h后分别检测OD值。发现在2 h时测得的OD值大小适宜,后续实验选取2 h作为测定时间点。用酶标仪检测各组细胞在450 nm处的吸光度(OD值),计算细胞抑制率。根据CCK8实验结果选择0 µmol/L、1 40 µmol/L、280 µmol/L吉马酮用于后续实验。
4 细 胞 划 痕 实 验 设 置 浓 度140 µmol/L、280 µmol/L吉马酮组,对照组吉马酮浓度0 µmol/L,每组设置3个复孔。在12孔板的背面划5条相互平行的直线,横行穿过培养孔,每根直线距离约为0.5 cm。接种SKOV3细胞于12孔板,每孔1×105个细胞。置于培养箱中过夜使细胞贴壁。弃旧培养基,以0 µmol/L、140 µmol/L、280 µmol/L吉马酮处理细胞24 h,用200 µL枪头在孔底垂直划线,用PBS清洗掉被划下的细胞,加入含2%FBS培养基,拍照记录此时的划痕面积。将12孔板置于孵箱中再培养24 h,再次拍照记录划痕面积 ,并计算划痕愈合率。
5 Transwell迁移实验 取处于对数生长期SKOV3细胞种植于6孔板,每孔2×105个,在培养箱中培养过夜,细胞贴壁后弃去旧培养基,分别以0 µmol/L、140 µmol/L、280 µmol/L吉马酮处理细胞24 h,收集药物处理后的细胞,无血清McCoy’5A培养基将细胞密度调至2×105/mL。取24孔板配套Transwell小室,24孔板中加入含20% FBS培养基700 µL,放入Transwell小室,1 h后分别加入200 µL各组细胞悬液至Transwell上室,每组设置3个复孔。置于培养箱中培养24 h,取出小室,PBS轻柔清洗1次,4%多聚甲醛固定10 min,PBS洗涤2次,1%结晶紫染色30 min,PBS洗去多余结晶紫,用棉签轻轻擦去上室内侧细胞,晾干用显微镜下拍照(100×)计数,同一倍镜选取5 个不同视野细胞数取平均值。
6 Transwell侵袭实验 细胞处理方式同5,将基质胶(Matrigel)在4℃提前1天融化,Transwell小室、24孔培养板、枪头置于-20℃冰箱过夜预冷。用新鲜培养基稀释基质胶(冰上操作),将4℃预冷的含20% FBS的McCoy’5A培养基加入24孔板中,每孔700 µL,放入Transwell小室(避免产生气泡),加入100 µL基质胶于Transwell上室底部,置于37℃孵箱4~5 h,基质胶聚成后取出24孔板,加入100 µL单纯培养基水化30 min,分别加入各组细胞200 µL于Tanswell上室培养24 h,后 续步骤同5。
7 Western blot检测相关蛋白 以浓度0 µmol/L、140 µmol/L、280 µmol/L吉马酮处理细胞24 h,弃去旧培养基,4℃预冷PBS清洗3次,加入含蛋白酶抑制剂(PMSF)的裂解液裂解30 min,收集裂各组细胞解液,超声机粉碎,4℃ 12 000 r/min下离心15 min,收集上清液。BCA法测定蛋白浓度后将各组蛋白浓度调整一致,加入5×上样缓冲液,100℃金属浴15 min。制胶,每孔上样15 µL,进行电泳、转膜。5%脱脂奶粉封闭PVDF膜2 h后置于一抗孵育液中,4℃摇床孵育过夜。PBST洗膜3次,放入HRP山羊抗兔二抗中孵育1 h。PBST洗膜3次,滴加适量ECL发光液曝光分 析。
8 统计学处理 应用SPSS19.0统计学软件对实验数据进行统计学处理,计量数据以 x¯±s表示,CCK8中不同浓度、不同时间下吉马酮对SKOV3细胞的影响采用多因素方差分析,其余多组实验数据采用单因素方差分析,两两比较采用LSD-t检 验,P<0.05为差异有统计学意义。
结 果
1 吉马酮对卵巢癌SKOV3细胞增殖能力的影响 不同浓度的吉马酮作用于卵巢癌SKOV3细胞及正常卵巢IOSE-80细胞24 h、48 h、72 h后,结果显示,同一浓度下,随着时间的延长,SKOV3细胞增殖抑制率逐渐增加,呈时间依赖性,但当吉马酮浓度为70 µmol/L、140 µmol/L时,24 h和48 h的SKOV3细胞抑制率差异无统计学意义(P>0.05);相同时间下,各浓度吉马酮对SKOV3细胞抑制率均显著增高(P<0.05),呈浓度依赖性。在相同浓度及作用时间下,吉马酮对正常卵巢IOSE-80细胞的增殖抑制作用明显低于卵巢癌SKOV3细胞(P<0.05),见图1。吉马酮作用于卵巢癌SKOV3细胞及正常卵巢IOSE-80细胞24 h的IC50分别为3 64.7 µmol/L、1 661.0 µmol/L。

图1 不同浓度吉马酮作用24 h、48 h、72 h时SKOV3细胞增殖抑制率(A) (aP<0.05, vs 70 µmol/L 24 h; bP<0.05, vs 70 µmol/L 48 h;cP<0.05, vs 70 mmol/L 72 h)、SKOV3细胞与IOSE-80细胞的增殖抑制率(B) (aP<0.05, vs SKOV3, 70 µmol/L; bP<0.05, vs IOSE-80,70 µmol/L; cP<0.05, vs SKOV3)Fig.1 Proliferation inhibition ratio of SKOV3 cells (A. aP<0.05, vs 70 µmol/L, 24 h; bP<0.05, vs 70 µmol/L, 48 h; cP<0.05, vs 70 mmol/L,72 h), SKOV3 cells and IOSE-80 cells treated with different concentrations of germacrone at 24 h, 48 h and 72 h (B. aP<0.05, vs SKOV3, 70 µmol/L; bP<0.05, vs IOSE-80, 70 mmol/L; cP<0.05, vs SKOV3)
2 吉马酮对SKOV3细胞迁移能力的影响 浓度0 µmol/L、140 µmol/L、280 µmol/L吉马酮组细胞划痕愈合率分别为69.00% ± 6.76%、40.33% ± 5.21%、13.79% ± 9.23%,药物组与对照组相比,细胞划痕愈合率显著降低(P<0.05),差异有统计学意义。Tanswell迁移实验中浓度0 µmol/L、140 µmol/L、280 µmol/L的吉马酮组穿过小室的细胞数分别为466.5 ± 47.7、319.4 ± 41.2、149.7 ± 26.3。药物组与对照组相比,穿过小室的细胞数明显减少(P<0.05),呈浓度依赖性,见图2。说明吉马酮能减 弱SKOV3细胞迁移能力。

图2 吉马酮对SKOV3细胞迁移能力的影响A:细胞划痕图片(40 ×);B:细胞迁移图片(100 ×);C:细胞划痕统计图;D:细胞迁移统计图(aP<0.05,vs 0 µmol/L)Fig.2 Effect of germacrone on the migration of SKOV3 cellsA: Images of cell scratch assay (40 ×); B: Images of cell migration (100 ×); C: Statistical analysis of cell scratch assay; D: Statistical analysis of cell migration (aP<0.05, vs 0 µmol/L)
3 吉 马 酮 对SKOV3细 胞 侵 袭 能 力 的 影 响 0 µmol/L、140 µmol/L、280 µmol/L在Tanswell侵袭实验中,吉马酮组穿过小室的细胞数分别为278.6 ± 71.8、161.0 ± 35.4、70.1 ± 24.9。药物组与对照组相比,穿过小室的细胞数明显减少(P<0.05),呈浓度依赖性,见图3。说明吉马酮可减弱细 胞侵袭能力。

图3 吉马酮对SKOV3细胞侵袭能力的影响A:细胞侵袭图片(100 ×);B:细胞侵袭统计图(aP<0.05,vs 0 µmol/L)Fig.3 Effect of germacrone on the invasion of SKOV3 cellsA:Images of cell invasion (100 ×); B: Statistical analysis of cell invasion (aP<0.05, vs 0 µmol/L)
4 Western blot法 检 测JAK2、STAT3、p-JAK2、p-STAT3、MMP2、MMP9蛋白表达 0 µmol/L、140 µmol/L、280 µmol/L吉马酮处理SKOV3细胞24 h后各组细胞JAK2、STAT3蛋白表达无统计学差异(P>0.05),组间两两比较均无统计学差异。p-JAK2、p-STAT3、p-JAK2/JAK2、p-STAT3/STAT3、MMP2、MMP9差异有统计学意义(P<0,05),对照组最高,140 µmol/L吉马酮组次之,280 µmol/L吉马酮组最低,组间两两比较均有统计学差异。见表1,图4及图5。

图5 各组细胞蛋白MMP2、MMP9蛋白表达(aP<0.05, vs0 µmol/L)Fig.5 Comparison of MMP2, MMP9 protein expressions between each group (aP<0.05, vs 0 µmol/L)
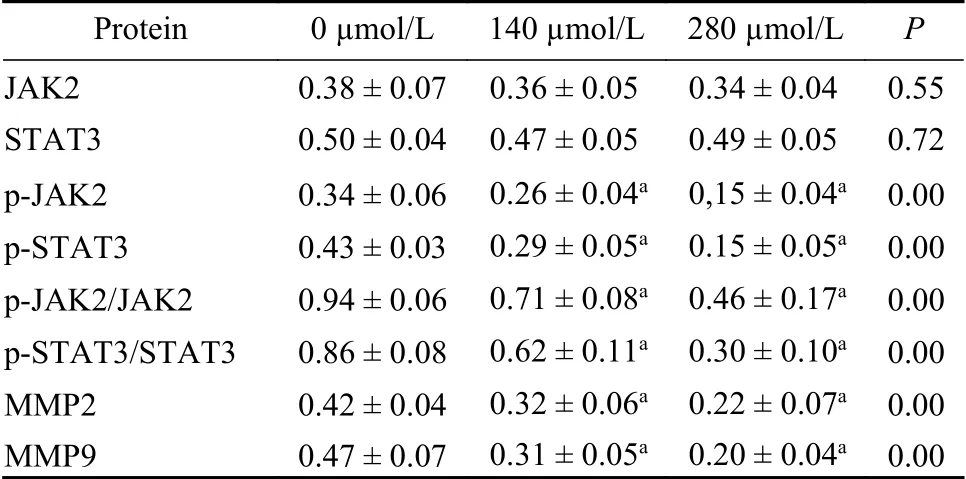
表1 不同浓度吉马酮处理SKOV3细胞相关信号通路蛋白表达比较Tab. 1 Expressions of signaling pathway related proteins in SKOV3 cells treated with different concentrations of germacrone

图4 各组细胞p-JAK2、p-STAT3、p-JAK2/JAK2、p-STAT3/STAT3蛋白表达比较(aP<0.05,vs 0 µmol/L)Fig.4 Comparison of p-JAK2, p-STAT3, p-JAK2/JAK2, p-STAT3/STAT3 protein expressions between each group (aP<0.05, vs 0 µmol/L)
讨 论
中药因在抗肿瘤方面的独特优势,近年来有关中药抗卵巢癌的研究热点逐渐增加。研究报道,在体外细胞实验中,吉马酮对肝癌、肺癌、乳腺癌、食管癌、胃癌、脑胶质瘤、前列腺癌、人慢性粒细胞白血病、宫颈癌细胞均有抑制作用[7-14]。其抗肿瘤细胞效应涉及多个靶点,如吉马酮可通过抑制JAK2/STAT3通路、调节PTEN-AKT通路抑制肝癌细胞的增殖[8];可抑制周期蛋白CyclinB1、CyclinA及周期蛋白依赖性激酶CDK1表达诱导肝癌细胞G2/M周期阻滞[7];吉马酮可通过上调促凋亡蛋白BAX,下调抗凋亡蛋白Bcl-2促进肺癌细胞、宫颈癌细胞凋亡[15-16];可调控hbxion介导的细胞周期、凋亡,促进自噬体形成,抑制胃癌细胞增殖[13];可通过诱导细胞G1期阻滞诱导脑胶质瘤细胞凋亡[11];可抑制MMP9表达抑制食管癌细胞的迁移[12];可逆转乳腺癌细胞、人慢性粒细胞白血病细胞对阿霉素的耐药性,增加其化疗敏感度等[17-19]。
JAKs家族JAK是一类重要的酪氨酸激酶,由JAK1、JAK2、JAK3和TYK1四个成员构成。JAK的下游信号是STAT,有STAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B、STAT6七个成员。其中JAK2/STAT3信号转导通路直接影响细胞的增殖、分化、凋亡过程,该通路异常激活可致细胞异常增殖和恶性转化,在多种实体肿瘤中起关键作用[20]。许多文献证实在卵巢癌细胞体外研究中均表达为STAT3的高磷酸化,卵巢癌JAK2/STAT3信号转导通路通过调控其下游靶基因的转录,促进卵巢癌细胞增殖,抑制卵巢癌细胞凋亡,促进其侵袭转移,抑制这一通路可能是治疗卵巢癌的候选途径[21]。
卵巢的预后与肿瘤的复发转移密切相关,肿瘤的侵袭转移过程包括细胞的黏附、迁移、侵入以及细胞外基质蛋白的降解。金属基质蛋白酶由肿瘤细胞分泌,它可以降解细胞外基质,破坏肿瘤细胞侵袭的组织学屏障,促进细胞侵袭转移,目前MMPs家族已分离出28个成员(MMP1 ~MMP28)。其中MMP2、MMP9是当前研究的热点,其高表达与卵巢癌的发生发展、侵袭转移呈正相关[22]。
吉马酮是否具有抗卵巢癌细胞的作用尚不清楚。本研究首先通过CCK8法检测发现吉马酮能显著抑制卵巢癌SKOV3细胞的增殖能力,抑制作用随着时间、浓度的增加不断增强,存在浓度和时间依赖性。再进行划痕实验,结果显示吉马酮处理后的癌细胞其划痕愈合率显著低于对照组。Transwell迁移及侵袭实验表明吉马酮处理后的卵巢癌细胞穿过小室的细胞数较对照组明显减少,说明吉马酮可显著抑制其迁移侵袭能力。已有研究发现吉马酮可以通过抑制JAK2/STAT3信号通路来抑制肝癌细胞的增殖,可以通过降低MMP9的表达抑制食管癌细胞的迁移侵袭。为探究吉马酮抑制卵巢癌细胞增殖、迁移侵袭能力是否也与抑制JAK2/STAT3信号通路、降低MMP2、MMP9蛋白表达相关,故进行了Western blot实验,探究不同浓度吉马酮作用于卵巢癌SKOV3细胞后相关蛋白的表达情况。Western blot实验结果显示吉马酮作用于SKOV3细胞后可抑制p-JAK2、p-STAT3蛋白表达,下调p-JAK2/JAK2、p-STAT3/STAT3。说明吉马酮抑制卵巢癌细胞的增殖与抑制JAK2/STAT3信号通路活性有关,其对酪氨酸激酶的激活有特异性抑制作用,进而减少了其下游的STAT3发生磷酸化,这条在卵巢癌中异常激活的信号通路被阻滞,从而抑制了癌细胞的异常增殖。Western blot法显示不同浓度吉马酮作用于SKOV3细胞后可不同程度地抑制MMP2、MMP9表达,说明吉马酮抑制SKOV3细胞侵袭迁移能力可能是通过抑制MMP2、MMP9蛋白表达实现的。
综上所述,本实验证实了吉马酮可明显抑制卵巢癌SKOV3细胞的体外增殖、迁移、侵袭能力,其机制可能与抑制JAK2/STAT3信号通路、下调MMP2和MMP9蛋白表达有关。可为研究吉马酮治疗卵巢癌提供一定的实验依据,但吉马酮抑制卵巢癌细胞增殖迁移、侵袭是否有其他信号途径参与,以及这些信号通路是否与JAK2/STAT3信号通路相关尚不清楚,其是否通过多靶点抑制卵巢癌尚需进一步研究。

