大鼠肾脱细胞支架的制备研究
肖昀明,汤黎峰,耿光瑞,张 颖,朱 飞,沈婉君,李清刚,陈香美 解放军医学院,北京 008; 解放军总医院第一医学中心 肾脏病医学部,解放军肾脏病研究所,肾脏疾病国家重点实验室,国家慢性肾病临床医学研究中心,肾脏疾病研究北京市重点实验室 北京008; 广东药科大学中药学院,广东广州 0006; 南开大学医学院,天津 0007; 解放军总医院第一医学中心 超声科,北京 008
目前终末期肾病的治疗方案是以肾移植为主的肾替代治疗,而肾移植受限于供体肾源短缺[1]。为解决此问题,世界范围内展开了肾再生技术的研究。近年来,源自天然肾的细胞外基质引起研究者们的兴趣,并将其作为再生支架广泛应用于生物人工肾工程中,已成为肾再生技术的研究热点之一。近年来经过众多学者们的努力,2009年首次报道的通过SDS溶液制备肾脱细胞支架,能够成功脱细胞的器官有软骨、骨骼肌、心脏、血管、肺、肝、胰腺等[2-8]。但专家学者们对基于完整器官的脱细胞支架制备方案并没有共识,具体的灌注洗脱的流速与方式也没有统一标准[9],也尚无系统研究比较暴露时间和不同方法对DNA去除、脱细胞支架宏观和微观结构损失的影响[10]。本研究通过不同流速的洗脱剂灌注大鼠肾,从而制备脱细胞支架。并记录不同流速下脱细胞所需要的时间、脱细胞支架的干重和鲍曼氏囊面积等,探究制备肾脱细胞支架所使用灌注液的最佳流速,评价肾脱细胞支架的完整性和安全性。
材料与方法
1 实验动物 120只SPF级别10周龄雄性SD大鼠,购自斯贝福生物技术有限公司。饲养条件:饲养于解放军总医院实验动物中心,白天12 h/黑夜12 h循环,自由饮食饮水,饲养温度为20℃~24℃,相对湿度为40%~60%。本实验经解放军总医院实验动物伦理委员会审批通过(2020-X 16-34)。
2 主要实验设备及材料 气体麻醉机(MSSN6089);体式显微镜(TOPCON);蠕动泵(SENZ 310HT);真空冷冻干燥机(科旺达生物仪器有限公司ZLGJ-10);超声仪(迈瑞M9,7 ~ 13 MHz线性列阵探头);电子天平(赛多利斯科学仪器);激光酶标仪(TECAN);组织研磨仪(QIAGEN);紫外分光光度计(Nanodrop2000c);SDS(VWR 0227);磷酸盐缓冲液(CORNING 21-031-CV);注射用六氟化硫微泡(SonoVue);24G动静脉留置针(BRAUN);苏木素-伊红(HE)染色试剂盒、过碘酸-希夫氏(PAS)染色试剂盒、MASSON染色试剂盒(索莱宝生物技术有限公司);DNA提取试剂盒(QIAGEN);SDS检测试剂盒(Sangon Biotech);细胞计数试剂盒(MCE HY-K0301);永生化人肾小管上皮细胞(ATCC HK-2);Anti-Collagen Ⅳ抗体(ABCAM a b236640)。
3 脱细胞支架的制备方法 30只大鼠用于制备肾脱细胞支架。大鼠麻醉后尾静脉注射1 mL肝素浓度为250 U/mL的0.9%氯化钠注射液,腹部正中切口,游离左肾及动静脉。近心端夹闭左肾动脉后剪断,用24G留置针插入左肾动脉,3-0丝线结扎固定。夹闭并剪断左肾静脉及输尿管。将肾完全浸没于0.9%氯化钠注射液中,使用蠕动泵经肾动脉留置针灌注肝素氯化钠注射液直至整个肾变为灰白色。将肾完全浸没于在含有抗生素的磷酸盐缓冲液中,置于-80℃低温冰箱中。24 h后取出解冻,将解冻后的肾连接至蠕动泵,将肾整个浸没于0.9%氯化钠注射液中,0.5% (w/v) SDS溶液灌洗,将蠕动泵流速分别调整为0.1 mL/min(S0.1)、0.5 mL/min (S0.5)、1 mL/min (S1)、5 mL/min (S5)、10 mL/min (S10)、20 mL/min(S20),每组5个肾。观察并记录肾变透明时间,待肾变透明后将蠕动泵入口的液体更换为纯水,灌 洗12 h。
4 脱细胞支架冻干及称重 30只大鼠用于天然肾和脱细胞支架的冻干及称重。纯水冲洗脱细胞支架12 h后剪去留置针,和天然肾一起放置于冷冻干燥机内,开启冷冻模式4 h后转为真空模式,干 燥24 h后取出称重,每个肾称量3次。
5 常规病理学观察 30只大鼠用于脱细胞支架的常规病理学染色、免疫组织化学染色和透射电镜检查。将纯水冲洗12 h后的各组脱细胞支架和天然肾置于10倍组织体积的固定液中固定24 h。组织经梯度乙醇脱水后,氯仿透明、浸蜡、包埋后切片。观察脱细胞支架是否将细胞洗脱干净,行HE染色:常规脱蜡后苏木素浸染2 min、盐酸乙醇分化3 s、氨水反蓝后伊红浸染3 s,乙醇梯度脱水、二甲苯浸泡透明后封片。观察肾中胶原纤维的保留情况、细胞核成分的残留和计算鲍曼氏囊面积,行PAS染色:过碘酸1 h、希夫氏液40 min、温水浸泡30 min后浸染苏木素,经盐酸乙醇和氨水分化反蓝,脱水、透明并封片。观察胶原纤维的保留情况行Masson染色:媒染剂20 min、苏木素染色并分化反蓝,Masson染液浸染10 min后1%醋酸洗,再经过2.5%磷钨酸、2%橘黄G、1%苯胺蓝染色,脱水、透明并封片。鲍曼氏囊面积使用image J软件对PAS染色结果 中的进行描边测算。
6 免疫组织化学染色 脱细胞支架和天然肾石蜡切片常规脱蜡后,1 mol/L枸橼酸钾溶液浸泡,微波炉加热修复抗原。山羊血清封闭后,加入一抗CollagenⅣ(1∶100),4℃孵育过夜,二抗孵育后,DAB显色。苏木素复染后脱水封片。上镜观察并对比天然肾和脱细胞支架的Ⅳ型胶原蛋白的分 布。
7 透射电镜检查 脱细胞支架经固定、脱水、干燥处理,在包埋胶囊中用环氧树脂包埋剂包埋样本。组织固化后,超薄切片机切片,厚度50 nm。用醋酸铀饱和溶液、枸橼酸铅溶液染色。上机观察 肾小球毛细血管袢、基底膜和鲍曼氏囊的完整性。
8 DNA和SDS残留检测 30只大鼠用于脱细胞支架的DNA和SDS残留检测。脱细胞支架经纯水灌洗12 h后,使用真空冻干机冻干脱细胞支架和天然肾,按照DNA提取试剂盒操作说明提取脱细胞支架和天然肾的DNA,使用Nanodrop2000c对所提取的核酸进行定量后对比DNA洗脱率。将冻干后脱细胞支架和天然肾在组织研磨仪中研磨,按照SDS残留试剂盒说明书操作萃取组织中的SDS并转移至96孔板中,使用酶标仪测量499 nm下各孔的OD值,根据标准曲线计算各组S DS残留量。
9 DNA琼脂糖电泳 配置1%琼脂糖溶液(w/v),微波炉中大火加热3 min至均一透明,按照1∶10 000的比例加入核酸染料,混匀后倒入配胶槽并插入梳子。将配好的凝胶转移至水平电泳槽,倒入TAE电泳液。第1个孔内上样6 µL DNA Ladder。将提取出的DNA加入DNA Loading Buffer,混匀后上样,每孔上样10 µL。第2~6孔加入天然肾提取的DNA,第7~11孔加入脱细胞支架提取的DNA。80 V恒压电泳。上机拍照凝胶 ,观察各组的DNA条带的分布。
10 超声及超声造影检查 脱细胞支架经纯水灌洗12 h后,使用鲁尔接头将蠕动泵硅胶管与三通阀和肾动静脉留置针相接,注射器连接在三通阀上。将肾完全浸于0.9%氯化钠注射液中,超声探头伸入液面以下,进行灰阶检查观察支架是否完整。开启蠕动泵流速0.5 mL/min,造影检查用0.5 mL 0.9%氯化钠注射液稀释50倍的微泡造影剂,1 s内推注完毕,开始推注造影剂的同时采集超声造影视频,观察支架内血管网络强化速度和支 架表面是否有造影剂渗漏。
11 细胞毒性实验 细胞毒性实验设置实验组和对照组。实验组培养基按照GB/T 16886.5-2017中的方法制备脱细胞支架浸提液:将纯水灌洗12 h后的脱细胞支架浸泡在5%含血清培养基中,置于37℃恒温箱中浸提72 h。对照组培养基不加入脱细胞支架,与实验组放置于相同条件下72 h。96孔板中接种HK-2细胞(3 000/孔),实验组和对照组各6个复孔,第2天待细胞贴壁后更换为各组的培养基100 µL/孔,放入二氧化碳孵箱中培养48 h,每天换液。48 h后每孔加入10 µL CCK8试剂,放入孵箱中2 h后使用酶标仪测量各孔450 nm处的OD值,对比两组OD值判断脱细胞支 架的细胞毒性。
12 统计学方法 采用SPSS统计软件进行统计分析,GraphPad Prism进行绘图,计量资料以 x¯±s表示,组间比较使用t检验,多组数据之间比较使用单因素方差分析(one-way ANOVA),P<0.05为差 异有统计学意义。
结 果
1 脱细胞支架的大体观 在脱细胞过程中,可观察到肾静脉有深棕色的液体排出。随后可观察到整个肾从皮质至髓质逐渐分段变为透明,前期肾皮质区域的脱细胞速度较快,后期髓质区域的脱细 胞速度较为缓慢,直至整个肾变为透明状(图1)。
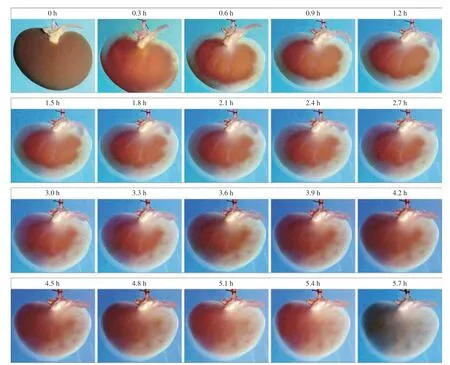
图1 液体环境中的脱细胞时序变化(流速0.5 mL/min)Fig.1 Decellularization changes over time in liquid environment (flow rate 0.5 mL/min)
2 不同流速下肾脱细胞支架 通过不同的灌注流速洗脱肾制备脱细胞支架,可以观察到随着流速的增加,脱细胞的时间呈下降趋势(图2A)。当流速为0.1 mL/min时,脱细胞的时间约1 h,当流速大于10 mL/min时,脱细胞时间整体降为3 h以内。采用明显超出SD大鼠肾动脉生理流速的20 mL/min时,时间减小至1 h以内,制得的肾脱细胞支架发白、透光度较差。不同流速下制备的肾脱细胞支架经冻干后称重,各组间无明显差异,均在10 mg左右(图2B)。相同的天然肾干重则 高达300 mg。

图2 不同流速下的脱细胞表现A:不同流速下各流速组脱细胞所需要的时间(n=5);B:天然肾和不同流速下制备的脱细胞支架的干重(n=5);C:天然肾和不同流速下制备的脱细胞支架的鲍曼氏囊面积(n=5)。NK:天然肾;aP<0.000 1Fig.2 Decellularization results at different flow ratesA: The time required for decellularization at different flow rates (n=5); B: The dry weight of decellularization at different flow rates(n=5); C: The area of Bowman's area decellularized at different flow rates (n=5). NK: natural kidney; aP<0.000 1
3 不同流速下脱细胞支架的鲍曼氏囊面积 经PAS染色的鲍曼氏囊面积计算发现,不同流速下肾脱细胞支架的鲍曼氏囊面积随着流速增加而增大。以1 mL/min为分界线,当流速小于1 mL/min时,鲍曼氏囊平均面积为2 000 µm2;当流速超过1 mL/min后,肾脱细胞支架的鲍曼氏囊面积明显增加(图2C)。PAS染色中可见低流速各组(S0.1、S0.5、S1)中肾皮质和髓质中肾小球饱满,基底膜完整,鲍曼氏囊完整,可见明显的血管极和尿极。高流速组(S5、S10、S20)中发现有结构萎缩的肾小球,球内有紫色细胞核成分残留。S20组中可观察到鲍曼氏囊有破碎和不完整(图3)。提示制备脱细胞支架的最佳流速应为低流速,为了保证支架微结构的完整性,我们在后续的试验中采取了 0.5 mL/min流速。
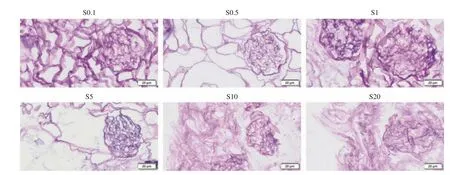
图3 光镜下不同流速制备的脱细胞支架的鲍曼氏囊PAS染色(200 ×)F ig.3 PAS staining of Bowman's capsule of decellularized scaffolds prepared at different flow rates under light microscope (200 ×)
4 病理染色及电镜 病理染色可见,0.5 mL/min流速下的HE染色无细胞成分,PAS染色可见鲍曼氏囊结构完整,基底膜连续且清晰,肾小管分布均一。通过Masson染色和Ⅳ型胶原免疫组化染色可见各组脱细胞支架均有胶原纤维网状结构保留(图4A)。电镜可见鲍曼氏囊和基底膜连续且完整 ,且未观察到有细胞成分的残留(图4B)。
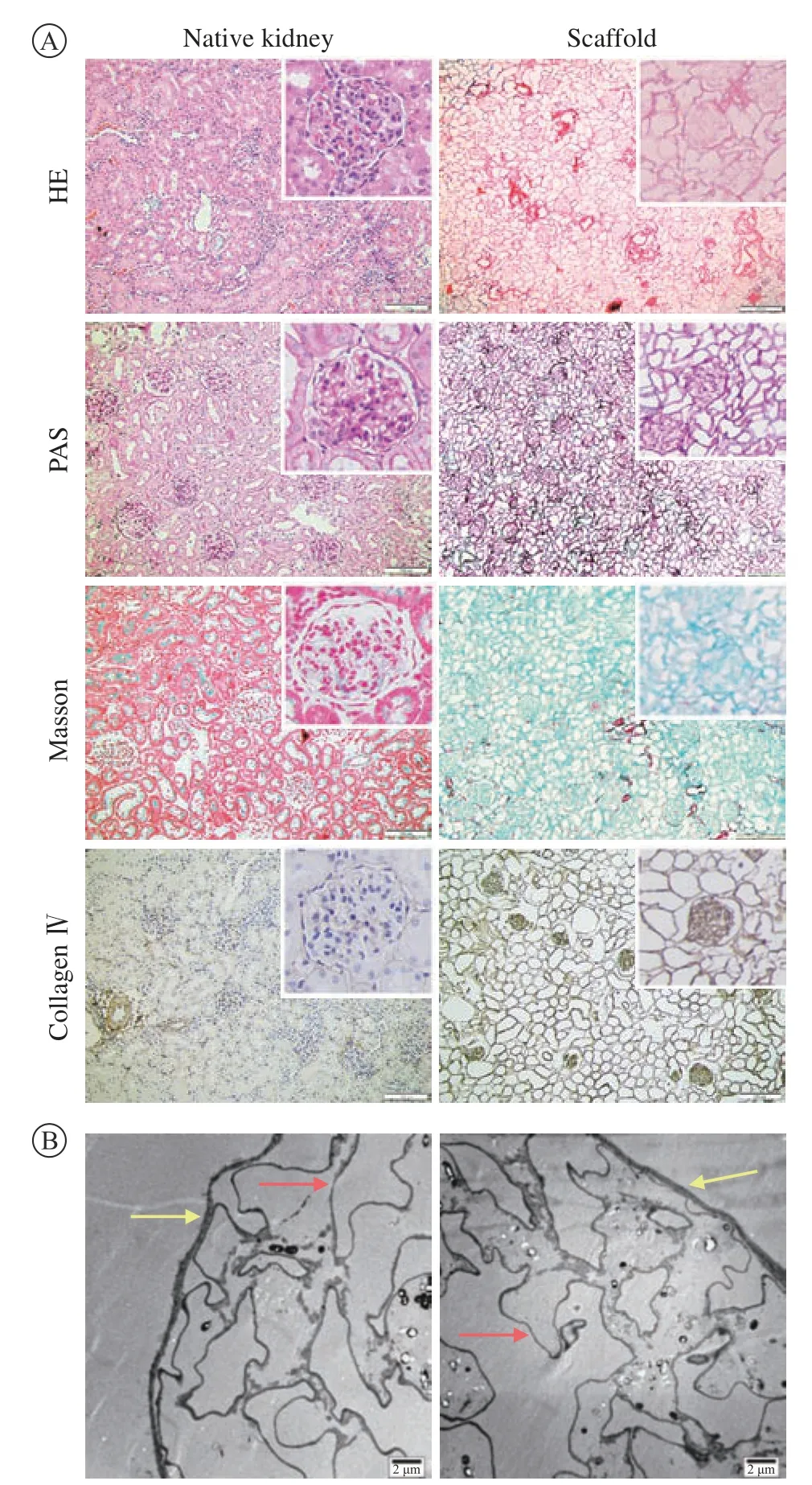
图4 0.5 mL/min流速下制备的脱细胞支架光镜和电镜下形态A:光镜下脱细胞支架的常规病理染色和Ⅳ型胶原蛋白染色显示0.5 mL/min流速下的脱细胞支架无细胞核成分,细胞外基质结构完整,有胶原蛋白的保留(标尺=100 µm,200 ×);B:肾脱细胞支架的透射电镜,鲍曼氏囊(黄色箭头)和基底膜(红色箭头)连续且完整(标尺=2 µm)Fig.4 Light and electron microscopy results of the decellularized scaffold prepared at a flow rate of 0.5 mL/min A: The conventional pathological staining of the decellularized scaffold and Ⅳ collagen staining under light microscope showed that the decellularized scaffold at a flow rate of 0.5 mL/min had no nuclear components, the extracellular matrix structure was intact, and collagen was retained (scale bar=100 µm, 200 ×); B: the transmission of the kidney decellularized scaffold electron microscope showed that the Bowman's capsule (yellow arrow) and basement membrane (red arrow) were continuous and intact (scale bar=2 µm)
5 超声及超声造影表现 脱细胞支架内血管和肾盂呈高回声影,肾实质部分呈低回声影,脱细胞支架结构完整(图5A)。肾脱细胞支架超声微泡造影检查可见整个肾均匀迅速强化,从皮质区域开始强化,逐渐扩大到肾髓质,肾皮质强化明显,血 管网络通畅,肾表面无造影剂泄露(图5B)。
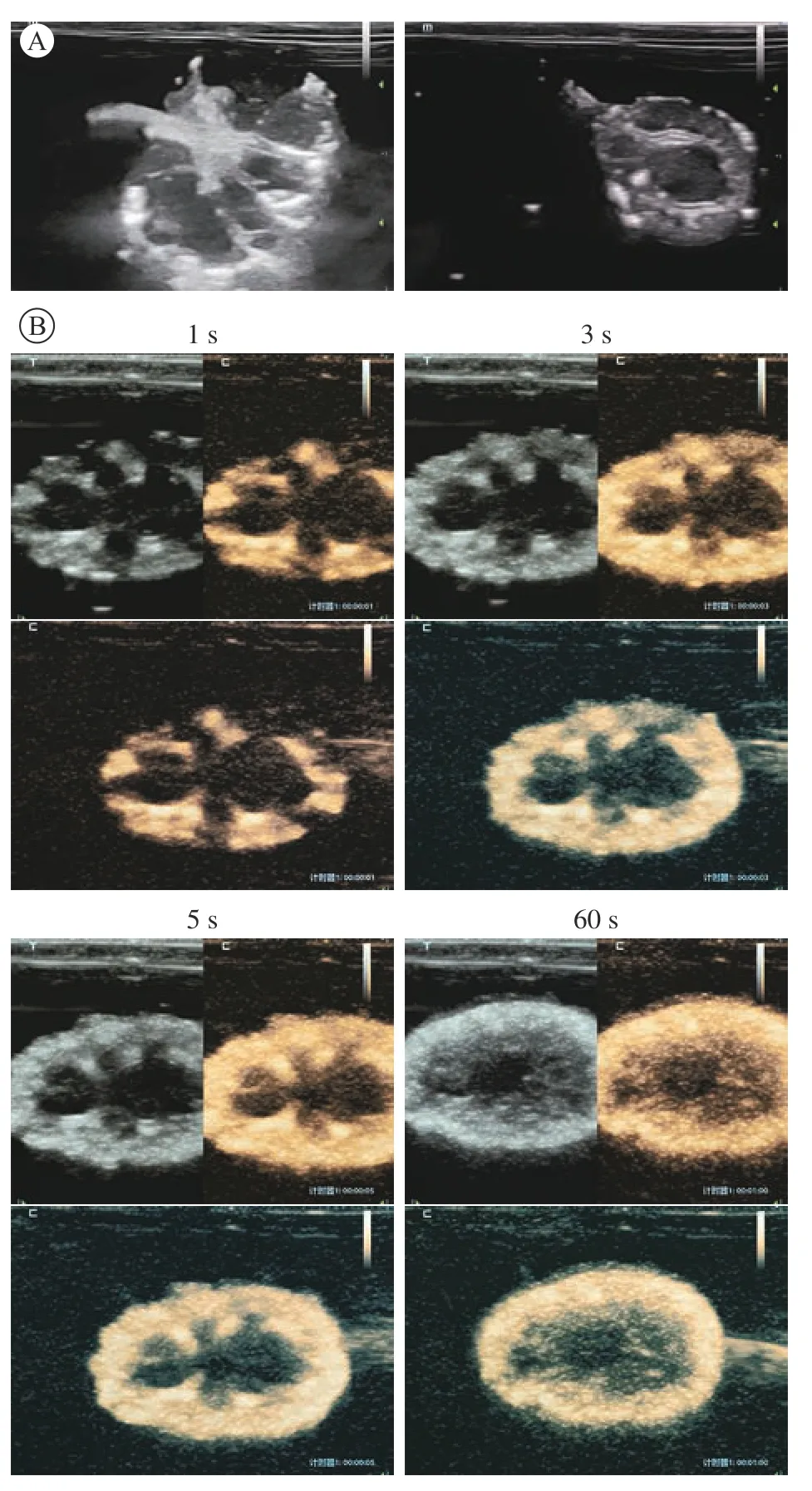
图5 0.5 mL/min流速下制备的肾脱细胞支架超声及造影表现A:脱细胞支架超声检查显示血管和肾盂呈高回声影,肾实质部分呈低回声影,脱细胞支架结构完整;B脱细胞支架超声微泡造影显示整个肾均匀迅速强化,肾表面无造影剂泄露Fig.5 Ultrasound and contrast-enhanced ultrasound examination of kidney decellularized scaffold A: Ultrasound examination of the decellularized scaffold showed that the blood vessels and renal pelvis were hyperechoic, the parenchymal part of the kidney was hypoechoic,and the structure of the decellularized scaffold were integrity; B: Decellularized scaffold ultrasound microbubble contrast showed that the entire kidney was rapidly strengthened, and no contrast agent was leaked from the kidney surface
6 DNA及SDS残留量 经过测量,对照组天然肾DNA含量为(1 624 ± 315.91) ng/mg干重,0.5 mL/min脱细胞组DNA含量为(35.2 ± 12.13) ng/mg干重(图6A)。琼脂糖电泳显示S0.5脱细胞组未见明显长核酸链(>100 bp)的残留(图6B)。脱细胞支架纯 水冲洗12 h后,SDS残留低至本底水平(图6C)。
7 安全性 相比对照组,肾脱细胞支架的含血清培养基浸提液对细胞增殖无显著影响(图6D)。表明我们制备的脱细胞支架本身无细胞毒性,制得的肾脱细胞支架符合现行的医疗器械生物学评价标 准[11]。
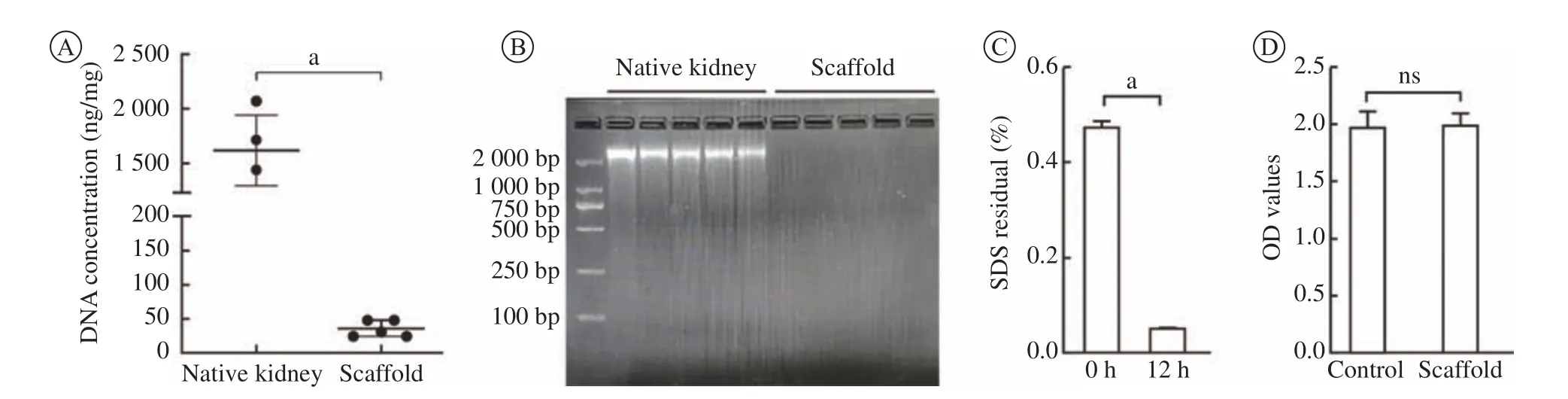
图6 肾脱细胞支架DNA和SDS残留检测和安全性检测A:脱细胞支架与天然肾相比,脱细胞支架核酸残留低于50 ng/mg干重;B:琼脂糖电泳未见脱细胞支架组大于100 bp DNA条带;C:SDS溶液脱细胞后冲洗12 h,SDS残留低至本底水平;D:脱细胞支架浸提液的细胞毒性验证显示与对照组无差异。aP<0.000 1Fig.6 Renal decellularized scaffold residue detection and safety detectionA:Compared with native kidney, the residual nucleic acid of the decellularized scaffold is less than 50 ng/mg dry weight; B: Agarose electrophoresis showed that there was no DNA band larger than 100 bp in the scaffold group (Scaffold); C: SDS solution was decellularized and rinsed for 12 hours, the residue was as low as the background level; D: The cytotoxicity verification of the decellularized scaffold extract showed no difference when compared with the control group. aP<0.000 1
讨 论
脱细胞支架是生物组织和器官在经过表面活性剂和酶的作用下去除细胞成分,同时又不影响细胞外基质的情况下获得的生物支架,随后通过不同的接种策略使无细胞的支架得以再细胞化,以重现组织或器官功能[12]。与人工支架相比,肾脱细胞支架的优势包括:1)脱细胞支架具有独特且精细的三维结构,难以人工实现;2)脱细胞支架中包含可促进细胞生长和黏附的蛋白和生长因子;3)包含天然的动静脉和输尿管结构,可用于细胞植入和血液灌流[13]。
既往众多文献中研究者们将离体器官和组织快速冰冻后解冻,这样可以在细胞内形成冰晶破坏细胞膜,在灌注过程中可以有效地将细胞碎片冲出肾内部,且快速冰冻形成的小冰晶不会影响后续的支架再细胞化过程[14-15]。但我们实践发现,反复冻融并不会有效提高脱细胞效率,因此我们仅将离体肾快速冰冻24 h以保证能将肾完全冰冻。
目前灌注洗脱剂制备脱细胞支架的流速还未达成共识,我们查阅文献发现常用的灌注流速为1 mL/min以下。因此我们主要观察的实验流速设定为0.1 mL/min、0.5 mL/min、1 mL/min,并同时设置了5 mL/min、10 mL/min、20 mL/min作为对比。我们通过以上不同流速对肾进行洗脱细胞,发现随着灌注流速的增加,脱细胞时间减少,但较高的灌注速度会造成鲍曼氏囊面积增大,以至于破裂,导致肾小球的细胞无法洗脱干净。表明脱细胞过程中在一定范围内提高灌注流速可以有效减少脱细胞时间。我们在本研究中采用的是与传统悬吊法脱细胞不同的脱细胞方案,即将整个肾浸泡在液体中进行脱细胞。我们发现,相较传统悬吊法,在0.5 mL/min的流速下液体环境中脱细胞时间明显缩短。可能原因是液体环境中的肾由于浮力的存在,可以给肾组织一个良好的支撑,使血管处于充盈状态,洗脱试剂可以更好地灌注到肾内部。
肾脱细胞支架的完整性关系到再细胞化效率[15-16]。为了更好地观察到脱细胞后支架内部的结构情况,我们使用了超声检查和超声造影检查评估肾脱细胞支架的结构和血管网络。灰阶检查结果显示支架外形结构完整,造影检查可见整个肾在1 s内迅速强化,血管网络通畅。由于超声微泡无细胞毒性,残留的微泡可在后续灌注培养中离开支架内部[17]。所以我们认为超声微泡造影可以作为肾脱细胞支架使用前的无创预先检查手段,有效避免在后续实验中发现血管网络不通畅和灌注细胞时的泄露问题。我们认为可以用于肾再生技术的合格脱细胞支架应至少符合以下条件:1)在进行脱细胞程序前对目的肾进行灰阶及彩色多普勒超声检查,确认肾形态、结构无异常,血流通畅,排除占位性病变;2)超声检查可见脱细胞支架完整,可见结构完整的高回声血管网络;3)超声微泡造影检查支架迅速强化,血管网络通畅;4)超声造影检查支架表面无造影剂渗漏。
由于移植后不良反应的主要原因是支架内残留的DNA,因此支架内DNA残留是极为关键的因素[16]。本研究中制备的脱细胞支架符合脱细胞指标要求。同时,SDS对细胞具有一定的毒性,在用纯水灌洗脱细胞支架12 h后,支架内的SDS平均残留量低于安全水平(133 µg/g)[18]。最后我们对脱细胞支架浸体液和对照进行细胞培养后测试毒性,两组间无显著差异。因此我们制备的肾脱细胞支架安全、无细胞毒性,可以用于后续的再细胞化培养。
虽然已经有膀胱和真皮等组织器官的脱细胞支架用于临床使用阶段,但由于肾脱细胞方法的不确定性以及肾脱细胞支架结构的复杂性,肾脱细胞支架的临床应用还有很大的挑战[19-21]。目前尚未见肾脱细胞支架应用于人体的报道,但已经有很多团队将肾脱细胞支架应用于动物模型。在肾脱细胞支架的临床应用之前依然有较多问题亟待解决,包括保留更多天然肾生物学特征的脱细胞方法、对肾脱细胞支架进行化学物理修饰以产生足够的生物学活性、适当地将细胞重新种植于脱细胞支架特定区域的细胞接种方案等。相信随着技术的进步和实验方案的优化,会有力地促进生物人工肾的研制。
综上,本研究通过不同流速灌注肾制备脱细胞支架,发现液体环境下0.5 mL/min是制备大鼠肾脱细胞支架的最佳流速,并提出了将超声检查和超声微泡造影检查作为脱细胞支架使用前的预先检查手段,有助于脱细胞支架的后续应用。

