植物镁离子转运及镁胁迫响应机制研究进展
陈良碧,蔡 丹,张林安,宋绍文,罗 璇,陈依君,李俊峰,许 涛,毛丹丹
(湖南师范大学生命科学学院作物不育资源创新与利用湖南省重点实验室,中国湖南长沙410081)
镁离子(Mg2+)是植物细胞中含量十分丰富的二价阳离子,在植物生长发育中参与一系列重要生理生化过程,比如:它是叶绿素的组成成分,参与光合作用及碳水化合物代谢;是RNA酶、ATP酶等多种酶活反应的催化剂;参与活性氧代谢等过程[1~3]。自然环境中各种镁胁迫因素的存在严重威胁植物生长发育,制约着农业可持续发展[4~6]。因此,植物细胞中Mg2+稳态平衡对于维持植物正常生长发育极其重要。目前,植物Mg2+的吸收和转运、植物响应Mg2+胁迫的分子机制的研究取得了较好的进展。本文阐述了目前植物Mg2+转运以及应答镁营养胁迫的相关研究进展,以期推动植物镁营养利用的研究。
1 镁离子的生理功能
1.1 镁离子参与植物光合作用
光合作用是有机生命体能量和物质的来源,受到外部环境和内部信号的双重调控[2]。Mg2+是植物生长的必需元素,对光合作用至关重要。叶绿体是进行光合作用的主要场所,植株地上部约35%的镁被运输到叶绿体进行光合作用。这些镁不仅作为叶绿素的组成参与光反应,而且能够激活光合酶参与光合碳固定[2,4~7]。
Mg2+促进叶绿体类囊体膜的垛叠和类囊体之间的结合,抵御不良因子对类囊体膜的破坏,维持类囊体膜的正常生理功能,保证光能有效吸收、传递和转化[2,4~8]。另外,Mg2+能通过增加可变荧光与固定荧光的比值,提高光系统PSⅡ活性和原初光能转化效率[4],并且能调节激发能在叶绿体光系统PSⅠ和光系统PSⅡ之间的分配。研究还发现,Mg2+能诱导叶绿素蛋白复合体向光系统PSⅡ的转移,增加光系统PSⅡ的光合面积,提高植物对光能的利用效率[4,9~18]。然而,当叶绿体缺 Mg2+时,光合电子传递受到抑制,光合作用显著下降,导致植物生长发育受损[9~19]。
1.2 镁离子是植物体内多种酶的活化剂
激酶和磷酸化酶等一系列参与重要生理反应的酶需要Mg2+作为辅助因子来被活化。比如ATP酶就是通过Mg2+的桥接作用被活化[9]。大多数ATP酶的底物是Mg-ATP。在Mg2+-ATP或ADP的焦磷酸盐结构和酶分子之间形成一座桥梁。ATP酶利用这些复合物转移高能磷酰基,促进ATP或ADP水解释放出磷酸和能量。Mg2+通过改变ATP酶的构像,促进底物与酶的结合,重新合成ATP[9]。缺镁会影响ATP的合成,进而影响能量代谢等一系列生理生化反应[9]。
几乎每种碳同化过程中的磷酸酶都需要Mg2+来激活。缺镁会影响植物碳同化效率,进而影响到光合效率。在光合作用的暗反应中,Mg2+主要表现在对RUBP(ribulose-1,5-bisphosphate)羧化酶的调控作用。RUBP羧化酶活性高度依赖Mg2+和pH。Mg2+与RUBP羧化酶的结合显著增加RUBP羧化酶活性,从而促进RUBP羧化酶对底物CO2的亲和力和最大反应速率。光照条件下,叶绿体类囊体的Mg2+从膜内泵出到基质,提高基质中Mg2+浓度,而H+从基质中泵入类囊体膜,提高类囊体中H+浓度,为RUBP羧化酶提供最适条件,从而促进CO2的固定和同化。黑暗时Mg2+与RUBP羧化酶的活化作用则相反。Mg2+通过上述方式连续活化RUBP羧化酶,促进碳水化合糖分和淀粉的合成。Mg2+还可以激活植物体内参与光合作用、呼吸作用、糖酵解、三羧酸循环及硝酸盐还原等过程的酶,以维持植物体内各种生化反应的正常进行[9,20]。
1.3 镁离子促进蛋白质合成及氮代谢
核糖体是蛋白质合成的关键结构,而Mg2+作核糖体亚单位联结的桥接元素,是蛋白质合成的先决条件[21]。在核糖体合成过程中,40S核糖体和60S核糖体以Mg2+作为结构聚力成80S核糖体。镁缺乏会导致80S核糖体失去内聚力,从而分解成40S和60S核糖体。Mg2+浓度恢复时,40S和60S核糖体重新结合聚合成80S核糖体。继续增加Mg2+浓度会引起80S核糖体聚合形成120S核糖体。而当透析掉Mg2+时,120S核糖体会重新分解成80S核糖体。因此,Mg2+能稳定核糖体构型,对维持核糖体前体状态极其重要[21]。此外,Mg2+还能促使氨基酸形成多肽链,这直接影响蛋白质合成[9]。
Mg2+能通过调节硝酸还原酶(NR)等氮代谢过程中一系列酶的活性影响氮代谢进程。比如,Mg2+可通过提高氮代谢过程中的关键限速酶NR的活性来影响整个氮素代谢过程[20~21]。此外,Mg2+还能通过活化谷酰胺合成酶促进氮的吸收和同化。缺镁时,蛋白质合成受阻,蛋白质中氮占总氮的比例下降。Mg2+显著影响RNA聚合酶的聚合力,对核RNA的形成至关重要。缺镁引起RNA的净合成停止、蛋白质合成下降,间接导致氮素代谢紊乱[20~21]。
1.4 镁离子对植物活性氧代谢的影响
在逆境胁迫条件下,植物体内产生超氧化物自由基O2·-和过氧化氢(H2O2)等形式的活性氧。活性氧具有很强的氧化能力,能引发和加剧生物膜脂过氧化,破坏膜系统,引起膜透性改变、细胞内环境紊乱,最终导致植株生长发育受损[22]。氧化胁迫是植物矿质营养缺乏诱导胁迫的因素之一[23]。丙二醛是脂膜过氧化的一个重要指标,其含量表示细胞膜脂质过氧化程度和植物对逆境条件反应的强弱[7,13]。有研究表明,大豆[13]、菜豆[7]、黄瓜[24]、玉米[25]、辣椒[26]和桑树[27]等植株在镁缺乏条件下,体内的丙二醛含量显著增加,导致脂质过氧化,影响到植株生长。
缺镁时淀粉和蔗糖在叶绿体中的累积可导致活性氧的增加,从而使光合作用的光氧化上调和光保护机制启动[25]。这与植物缺钾时只积累蔗糖和缺氮或缺磷时只积累淀粉的机制不同[25]。但缺镁诱导叶绿体活性氧产生的机制至今尚不清楚。Marschner等[1]提出,在缺镁情况下,植物叶绿素含量的下降不是因为胞内缺镁,而是由于缺镁导致蛋白质合成受阻所致。缺镁会导致蔗糖在叶片中的积累。叶片中高浓度的蔗糖能够抑制CAB2(编码叶绿素a/b蛋白)的合成[12],导致叶绿素含量和光合能力降低,阻碍CO2的固定[13~17]。而这些变化会导致活性氧的积累[18],最终导致叶绿素组分的变化[18~19]。因此缺镁时,植物会表现出叶片失绿、产生黄斑、坏死等症状。
1.5 镁离子对其他离子跨膜转运的影响
植物细胞的离子动态平衡对于维持细胞内环境稳定至关重要,当处于高温、盐碱、冻害等逆境条件下时,细胞内离子动态平衡紊乱,影响植物正常代谢过程[28]。Mg2+缺乏会影响Mg2+正确调节离子的跨膜转运。研究表明 Mg2+能与 Ca2+、K+、H+等多种离子发生拮抗作用[28],比如Mg2+和Ca2+可彼此拮抗。在天然蛇纹石土壤中,低Ca-Mg比可能会限制许多植物的生长或生存。通过遗传筛选,研究人员在拟南芥中证实Ca2+-Mg2+具有拮抗作用,cax1等位基因的功能缺失植株对蛇纹石土更耐受[28]。cax1突变体液泡Ca2+/H+交换活性的降低导致进入液泡的Ca2+降低,而在代谢池中保留更多的Ca2+以拮抗过量的Mg2+。减少外部Ca2+供应可减轻缺乏Mg2+转运蛋白突变体的缺陷表型[28]。虽然通常认为Ca2+和Mg2+可能竞争相同的底物,如酶和转运蛋白,但仍需更多的研究来揭开植物细胞中Ca2+-Mg2+拮抗作用的分子基础。Mg2+还可与Na+、Mn2+、Al3+等与根质外体负电荷结合的一些阳离子产生拮抗,从而影响植物生长[28]。此外,在酸性环境下,Mg2+能与H+、Al3+产生拮抗作用,影响植株正常生长[28]。
2 植物中镁离子转运:MGT家族
植物细胞中自由态的Mg2+浓度维持在0.2~1.0 mmol/L,受到精确的调控[29]。为维持各种组织细胞中Mg2+的最佳水平,植物已进化出有效的Mg2+转运和调节机制。植物根从外界环境中吸收Mg2+,将Mg2+装载至木质部导管中,随着蒸腾流被长距离运输到地上部分并参与地上部分的再分配[28],这些过程均由定位于细胞膜和不同细胞器膜的镁离子转运蛋白介导,而这些转运蛋白活性的调控是提高植物镁营养利用效率的基础。但迄今为止,介导上述过程的相关镁离子转运蛋白及其转运机制还了解较少。
随着模式植物拟南芥基因组测序的完成,2000年有两个实验室同时在拟南芥中鉴定出一个与细菌CorA同源、蛋白质结构类似的AtMRS2/AtMGTs家族[30~31]。AtMGTs家族含有 10 个成员(At-MGT1~AtMGT10)(图1)。各成员之间氨基酸序列具有多样性,进化分析显示各成员序列同源性在15%到89%。AtMGTs蛋白的结构类似细菌CorA蛋白,含有两个跨膜区,在第二个跨膜区上具有Mg2+转运蛋白必需的保守基序GMN[31]。另外,At-MGTs与酵母中的镁离子转运蛋白MRS2[31]、ALR1和ALR2[31],在结构上也有一定的相似性。AtMRS2/AtMGTs也是目前在植物中鉴定出来的主要镁离子转运体家族。
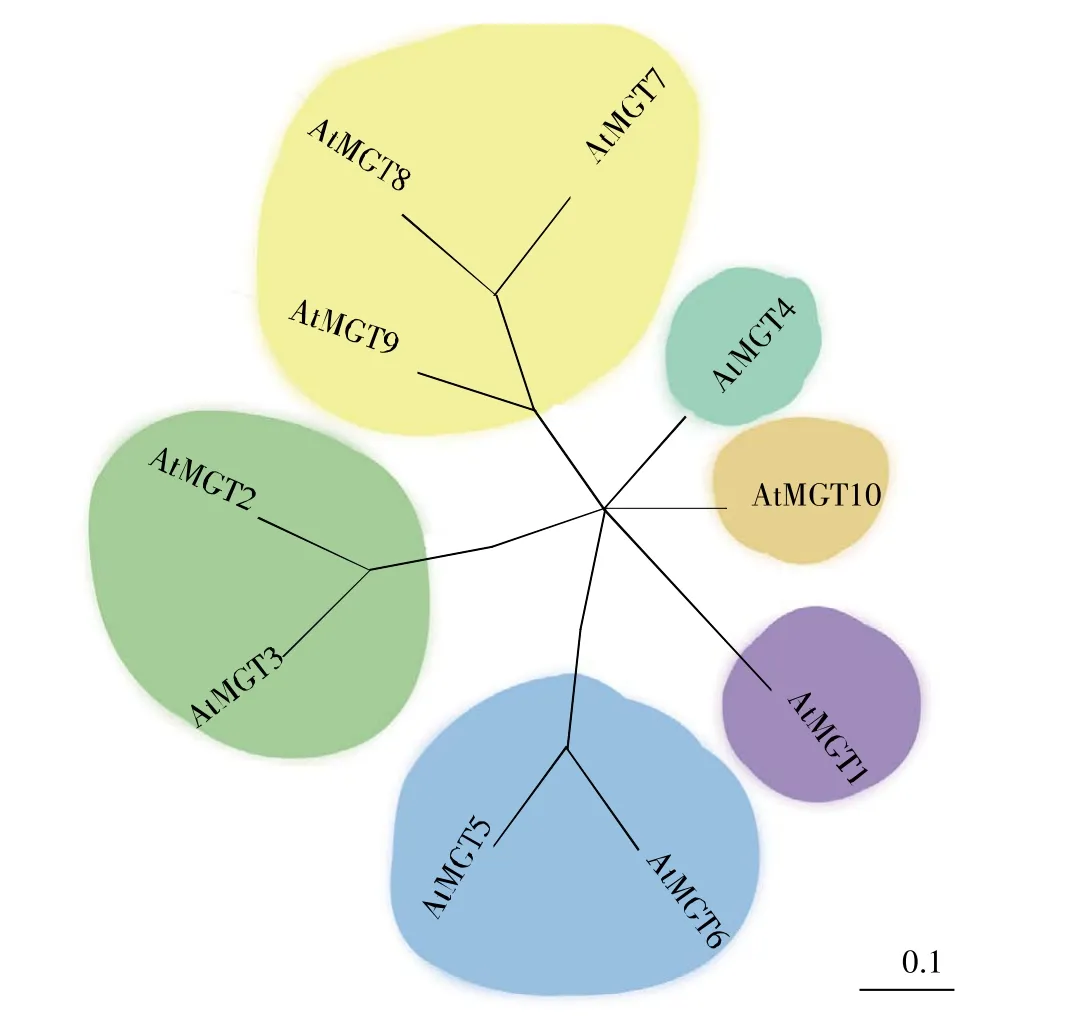
图1 AtMGTs家族成员的系统进化树Fig.1 The phylogenetic tree of the AtMGTs gene family
通过多年的研究,AtMGTs部分成员的Mg2+转运活性得到初步阐明。以Mg2+亲和能力为依据,AtMGTs家族存在3种对Mg2+不同亲和特性的转运蛋白:高亲和性Mg2+转运蛋白(AtMGT1、AtMGT2、AtMGT10)、低亲和性 Mg2+转运蛋白(At-MGT3、AtMGT4、AtMGT6、AtMGT7、AtMGT9) 和双亲和性Mg2+转运蛋白(AtMGT5)。同位素示踪的结果显示,AtMGT8蛋白在细菌MM281突变系统中不具有Mg2+转运活性。放射性示踪剂(63Ni2+)分析表明,MGT还能转运其他二价阳离子。尽管已报道了细菌CorA蛋白的通道样晶体结构,然而,植物MGT是否作为Mg2+通道尚未得到充分证实[28,31~36]。
植物根系的Mg2+吸收可能包括高亲和性与低亲和性转运系统。在拟南芥中,MGT6干扰植株在低镁条件下的生长受到抑制,MGT6介导微摩尔范围内的高亲和性Mg2+吸收[32]。此外,根中优先表达的MGT7基因在植物适应低Mg2+环境中也起重要作用[36~37]。最近的研究表明,在正常和高Mg2+条件下,MGT6和MGT7在植物Mg2+平衡中发挥重要作用[38],然而,具体的分子机制尚不清楚。Mg2+缺乏可由土壤中低水平的Mg2+条件或抑制其吸收的其他因子引起。在酸性土壤中,Al3+可通过直接结合Mg2+通道而强烈抑制Mg2+吸收,并能快速诱导水稻根中OsMGT1的表达,而osmgt1突变植株对Al3+胁迫敏感增强,可能是Mg2+吸收受损所致[39]。
从土壤吸收后,Mg2+被转运到木质部以实现从根到茎的长距离运输。Mg2+在韧皮部具有高度的移动性,因此Mg2+可从老组织到幼组织、从源到库,并可在连续的补充循环中从茎向下运输到根部。然而,参与这些过程的相关Mg2+转运蛋白还未得到鉴定。在细胞水平上,如同许多其他离子一样,游离的Mg2+主要储存在液泡中,以达到平衡。Mg2+流入液泡被认为由Mg2+/H+交换体(MHX)介导[40]。研究发现,AtMGT2和AtMGT3参与叶肉细胞Mg2+分配到液泡的过程[41]。然而,这些研究还需要更多的遗传学实验来了解其生理功能。在绿色组织中,绝大部分的Mg2+与叶绿体形成复合体参与光合作用。最近有研究发现,水稻中OsMGT3在叶绿体中的表达具有明显的昼夜节律,Os-MGT3突变引起其在叶绿体镁的节律性振荡消失,导致Rubisco酶活以及光合作用速率的下降,最终抑制水稻生长。另外,在叶肉细胞中特异性地过表达 OsMRS2-6/OsMGT3,可以增强叶绿体镁的输入以及光合固碳的能力,从而提高光合效率,暗示了该基因在提高光合作用上的潜能[42~43]。但到目前为止,镁是如何进入叶绿体,又是怎样调控光合作用的问题还缺乏深入研究。Mg2+在生殖过程中也起着重要作用。研究报道,包括定位于内质网的AtMGT4、定位于线粒体的AtMGT5和AtMGT9在内的几种MGT蛋白,在花粉发育和雄性生殖方面起着重要作用[28,33~35]。
不同MGT成员的亚细胞定位仍然是一个悬而未决的问题。最近的研究显示,同一MGT成员的定位会出现不同的定位结果,并且在瞬时过表达系统中,几个MGT与ER膜相关联,需要指出的是,许多膜蛋白被翻译,并在过表达时于内质网上积累。因此,为确定它们的生理功能,需要对拟南芥以及其他植物中所有MGTs蛋白进行全面的功能分析。除CorA/MRS2外,细菌和动物中其他家族的Mg2+通道或转运蛋白也被鉴定出。证明其同源基因是否存在于植物界并参与植物细胞的Mg2+转运将极大提升我们对植物中Mg2+转运的认识。
3 植物响应镁胁迫的分子机制
迄今为止,植物如何应对低镁胁迫的分子机制尚未被解析,但有关植物响应高镁胁迫的机制研究有一定进展。
有研究报道ABA参与对高镁胁迫信号的响应。在镁毒害条件下,ABA合成和信号转导相关基因的表达受到诱导,ABA含量上升,高浓度ABA促进DELLA蛋白在细胞核中积累,导致植物主根延伸受到抑制。研究还发现,DELLA蛋白通过调控碳水化合物代谢及Mg2+转运等相关基因的表达,影响植物Mg2+吸收效率、碳水化合物等物质的合成。因此,DELLA能通过ABA相关信号通路来调节Mg2+吸收及其相关基因的表达,以实现植物对高镁毒害的响应[28]。
另外,有研究发现Ca2+信号在植物适应高Mg2+胁迫中也发挥重要功能[43~45]。外部高 Mg2+诱导植物细胞质基质中Ca2+瞬时升高。特定的Ca2+信号可被两个定位于液泡膜的钙调磷酸酶B亚基蛋白CBL2和CBL3感知。CBL2和CBL3功能冗余,可激活CIPK3/9/23/26激酶,随后CIPK磷酸化液泡膜Mg2+转运系统以实现对液泡Mg2+的储存,从而保持细胞质中无毒的Mg2+水平。研究还发现,这些CIPK激酶可与ABA响应途径中起关键作用的几种蔗糖非发酵相关激酶(SnRK2)相互作用[43~45]。今后需重点解决以下问题:高Mg2+胁迫是如何诱导植物细胞中特异的Ca2+信号以及Ca2+和ABA信号在靶转运蛋白调控植物Mg2+平衡中的可能交叉点。
上述研究说明,ABA信号和Ca2+信号等因子是植物应答镁毒害的信号因子,其相互间的作用机理还有待深入研究。
4 展望
镁是植物生长发育必需的营养元素之一,镁缺乏或高镁都会影响植物的正常生长发育。目前对植物镁营养元素的研究多集中在镁离子转运体的功能、缺镁和镁毒害生理等方面,且在光合作用、碳代谢、减轻铝毒害等方面取得了一定的进展。然而,我们对植物Mg2+转运还了解较少。迄今为止,植物Mg2+转运蛋白的作用及晶体结构,Mg2+与其他离子的相互作用机制,植物对Mg2+转运的规律及体内稳态,Mg2+胁迫信号的转导和调控等分子水平的研究还知之甚少。未来需要设计新的筛选方法来鉴定更多植物Mg2+营养及Mg2+信号相关基因,以加深对植物Mg2+转运机制的认识。人类膳食中的主要Mg2+营养来源于植物,因此揭示植物Mg2+转运及镁胁迫响应的分子机制将有助于改善作物的营养特性,从而提高作物产量和品质,最终提高人类健康水平。

