马铃薯间作玉米对土壤细菌群落的影响研究
李光文,李 倩,崔慧珍,伏云珍,马 琨
(1.宁夏大学 农学院,宁夏 银川 750021;2.宁夏大学西北土地退化与生态恢复国家重点实验室培育基地,宁夏 银川 750021)
间作是一种有效的土地利用方式,被广泛应用于农业生产中[1]。它能通过作物种内、种间的竞争与互利关系,促进田间植物群落多样化,在实际生产中往往比单作更易获取光、水和养分资源[2-3]。间作下土壤微生物能通过参与碳、氮循环来影响农业生产系统的可持续性,通过改变土壤养分有效性来影响植物的生长[4]。因此,植物、土壤和微生物之间的相互作用被认为是农业生态系统的主要驱动力[5]。
目前,有关间、套作对土壤微生物影响的研究多集中在豆类、禾谷类作物之间。Bossio等研究认为,土壤细菌群落的多样性在作物生长和产量形成中具有重要作用[6]。研究证实,豆类-禾谷类间作、燕麦-紫云英间作可改变土壤细菌群落结构,提高细菌群落多样性[7-8];影响土壤革兰氏阳性菌(G+)与革兰氏阴性菌(G-)的比值[9];增加土壤短芽孢杆菌属、芽孢杆菌属、土芽孢杆菌属和喜盐芽孢杆菌属等有益菌属所占比例,降低链球菌属、奈瑟菌属、梭菌属和支原体属等潜在致病菌属的比例[10]。Zhang等[11]发现,玉米间作蚕豆明显改变了土壤细菌群落结构,但没有影响土壤细菌的多样性。Taschen等[12]发现,小麦间作豌豆诱导的作物种间协同作用能通过减少土壤α-变形菌门(Proteobacteria)和酸杆菌门(Acidobacteria)的表达,增加放线菌门(Actinobacteria)的表达,改变土壤细菌的群落结构,并认为,土壤细菌群落结构和多样性变化是由单作或间作根际分泌物的数量、性质所驱动[12]。也有研究指出,玉米间作马铃薯[13-14]、马铃薯间作蚕豆和马铃薯间作荞麦[15]也会影响土壤细菌的分布,引起土壤细菌群落组成的变化,在一定程度上能够提高细菌多样性,改变土壤微生物的群落结构。土壤微生物对间作作物根系分泌物的选择作用,是导致土壤微生物群落结构存在差异的主要原因[16-17]。可见,间作作物种类及种间关系差异会导致不同的研究结果。
间、套作对土壤细菌群落影响的研究虽然已有许多报道[7-8,10,12-17],但由于土壤类型、作物种类、种间关系等差异,有关马铃薯间作玉米对土壤细菌群落多样性的影响仍然缺乏[9-10]。本研究以连续4年马铃薯、玉米单作及间作的农田土壤为对象,利用TRFLP和磷脂脂肪酸的方法,分析持续马铃薯、玉米单作及间作下的土壤细菌群落组成、多样性以及土壤主要微生物群落组成的变化规律,以期为合理间、套作栽培及作物选择提供理论依据。
1 材料与方法
1.1 试验地概况
试验地位于宁夏隆德县沙塘镇和平村,(106°0′37″E,35°35′11″N),海拔1 883 m,年均降水量502 mm,年均蒸发量1 370 mm。土壤类型为黑垆土,成土母质为黄土。供试土壤基础理化性状为:全氮1.65 g/kg,全磷1.35 g/kg,有机质33.28 g/kg,碱解氮70.00 mg/kg,速效磷49.24 mg/kg,速效钾380.00 mg/kg,pH值为8.37(水土比5∶1)。
1.2 试验设计
试验开始于2014年4月,前茬作物为马铃薯。2014—2017年,采用单因素随机区组设计,利用田间定位栽培,设3个处理,4次重复:马铃薯单作(P)、玉米单作(M)和马铃薯间作玉米(M||P),小区面积为4 m×4 m=16 m2。每小区种4幅,幅宽为1 m,玉米采用宽窄行覆膜种植,宽行60 cm、窄行40 cm、株距35 cm,每幅种3行。间作马铃薯采用平作种植,行距50 cm、株距40 cm,马铃薯与玉米间的行距为25 cm。间作下的马铃薯、玉米各种2幅,条带比为2∶3。单作马铃薯每小区种4幅,每幅种两行,行距50 cm、株距40 cm。供试玉米品种为长城706,马铃薯为青薯9号。基施尿素98.44 kg/hm2,磷酸氢二铵325 kg/hm2,全生育期不再追肥。
1.3 样品采集及处理
2015年和2017年,均采用5点取样法,在作物收获前采集作物行间0~20 cm土层土壤样品,间作处理采集马铃薯与玉米相邻行间的土壤。本试验共采集12个土壤样本,各样本独立,低温保存带回实验室后过1 mm筛,将过筛后的土壤样本各分为2份,一份保存在-40℃冰箱,用于土壤微生物群落结构分析;一份保存在-80℃冰箱,用于土壤样品的长期保存。2017年的一部分土壤样本用于土壤细菌群落多样性分析;一部分土样自然风干,用于土壤理化性状分析。
1.4 测试项目与方法
1.4.1 土壤理化性质的测定 土壤全氮(TN)采用半微量凯氏法;有机质(OM)采用重铬酸钾氧化外加热法;全磷采用HClO4-H2SO4消煮,钼锑抗比色法;碱解氮采用碱解扩散法;速效磷采用NaHCO3浸提-钼锑抗比色法;速效钾采用NH4OAc浸提-火焰光度法;土壤pH采用酸度计测定,(水土比5∶1)[18]。
1.4.2 土壤细菌群落组成及多样性测定 土壤微生物脂肪酸的测定采用PLFAs分析,通过Agilent 7860型气相色谱仪,MIDI Sherlock脂肪酸图谱微生物鉴定系统分析待测样品[19]。样品提取主要通过前提黑暗培养、浓缩、固相萃取、酯化等过程。
土壤细菌群落结构及多样性采用T-RFLP的方法。土壤总DNA提取采用OMEGA公司的试剂盒,按照操作说明进行。细菌通用引物序列为:前引物8F(5′-AGAGTTTGATCCTGGCTCAG-3′),后引物926R(5′-CCGTCAATTCCTTTRAGTTT-3′)。扩增产物经SanPrep柱式DNA胶回收试剂盒纯化回收,分别用HaeⅢ和MspⅠ两种限制性内切酶(上海生工)进行酶切,扩增体系、程序以及酶切体系参见秦越等的研究方法[20]。荧光标记(FAM)引物由上海生工合成,扩增所用的Taq Plus DNA聚合酶为天根生化科技有限公司生产,酶切产物低温避光委托上海生工经毛细管电泳分离,在ABI自动测序分析仪上记录样品片段信息,比较细菌群落差异。
采用香农-维纳(Shannon-Weiner)指数(H)和均匀度指数(E)描述土壤细菌群落结构多样性,计算公式参见Dunbar J的方法[21]。
H0=-∑pi lnpi,其中,pi为限制性内切酶酶切的特定长度末端片段相对峰面积(i峰的峰面积/所有峰面积的总和);群落的均匀度E=H/Hmax,其中Hmax=log2(S)表示对应群落中所有分类群都同样丰富时的群落多样性。
1.5 数据处理
选择荧光强度大于50个相对荧光单位(RFU)且长度在50~500 bp之间的末端片段(T-RFs)作为有效片段进行后期数据处理[22];采用Biodap软件计算土壤细菌群落的Shannon-Weiner指数及Evenness指数。为减少实验误差,T-RFLP方法测定的数据均为HaeⅢ和MspⅠ两种内切酶的均值;DPS 7.05软件进行单因素方差分析的LSD法多重比较(P<0.05),Canoco 5.0软件进行RDA分析。
2 结果与分析
2.1 马铃薯玉米单作及间作栽培对土壤细菌群落的影响
由图1可见,2015年收获期,持续马铃薯单作、玉米单作及间作栽培下土壤细菌、G+和G-脂肪酸含量无显著差异,而马铃薯单作的G+/G-比值与玉米单作及间作栽培间差异显著(P<0.05)。2017年收获期,除对应土壤G-脂肪酸含量在玉米单作和马铃薯单作间有显著差异外(P<0.05),土壤细菌、G+和G+/G-在不同处理间均无显著差异。试验中,随单作及间作栽培时间的延长,2017年度,以PLFAs表征的土壤细菌、G+和G-生物量较2015年有一定幅度的下降。其中,玉米单作、马铃薯单作以及马铃薯间作玉米体系下土壤细菌的脂肪酸含量分别降低了20.14%、39.02%和42.53%;土壤G+的脂肪酸含量分别下降了24.90%、21.60%和32.47%;土壤G-的脂肪酸含量分别下降了16.99%、46.82%和47.14%。2017年较2015年相比,除马铃薯单作的土壤细菌和G-外,其他处理的土壤细菌和G-脂肪酸含量均有显著差异(P<0.05),且G-在间作栽培的年度间有极显著差异(P<0.01)。除间作栽培下G+和G+/G-有显著差异外(P<0.05),其他处理的年度间G+和G+/G-均无显著差异。
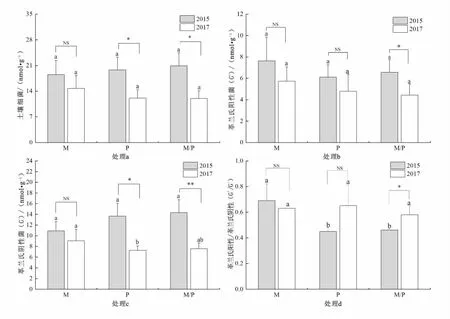
图1 马铃薯、玉米单作及间作栽培对土壤细菌群落的影响
总体上,在同一年内,各处理的土壤细菌脂肪酸含量波动幅度很小,但年际间,马铃薯间作玉米栽培模式下的土壤细菌、G-和G+的脂肪酸含量以及G+/G-比值均有显著性差异,以PLFAs表征的G-生物量变化对栽培模式和时间的长短比G+更敏感,年际间的差异较年度内的变化更明显。
2.2 间作栽培对土壤细菌群落多样性的影响
由图2可见,与单作马铃薯、单作玉米相比,连续马铃薯玉米间作4年后,土壤细菌群落的香农-维纳指数和均匀度指数分别提高了6.25%~8.97%和2%。但马铃薯间作玉米及单作栽培模式下的土壤细菌群落多样性及均匀度指数间均无显著差异。可见,连续马铃薯、玉米单作及间作在短期内并没有改变土壤细菌群落的多样性。

图2 马铃薯、玉米单作及间作栽培对土壤细菌多样性的影响
2.3 马铃薯玉米间作及单作栽培对细菌菌群结构组成的影响
试验中将T-RFs末端片段与细菌16S rRNA核糖体数据库进行比对,结果表明,马铃薯单作、玉米单作及间作下所鉴定出的土壤细菌分属20门,其中单作玉米土壤细菌分属14门,单作马铃薯土壤细菌分属16个门,马铃薯间作玉米细菌分属17门。相对丰度百分比较高的前10门细菌,土壤细菌厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)为不同栽培模式下的土壤细菌优势菌门(图3),且不同处理间均无显著差异。连续玉米单作下,对应土壤厚壁菌门的相对丰度百分比达到37.3%,较马铃薯单作和马铃薯间作玉米分别高出22.69%和34.17%;土壤变形菌门的相对丰度百分比较单作马铃薯、马铃薯间作玉米也分别高出19.25%和7.63%;拟杆菌门的相对丰度则分别高出27.16%和40.4%。然而,整个土壤细菌群落中,相对丰度百分比较低的柔膜菌门(Tenericutes)、疣微菌门(Verrucomicrobia)、浮霉菌门(Planctomycetes)却表现为马铃薯间作玉米均高于单作处理,但各处理间均无显著差异。可见,不同栽培模式下,土壤细菌群落组成在门水平的相对丰度百分比上存在差异,持续马铃薯间作玉米降低了土壤中厚壁菌门细菌的相对丰度百分比,影响了土壤细菌门水平上的群落组成。
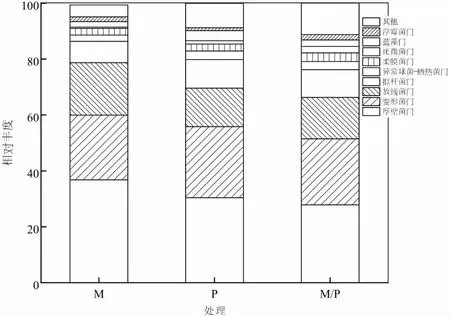
图3 马铃薯、玉米间作栽培影响下的土壤细菌门水平分类学组成及分布
2.4 马铃薯间作玉米对土壤细菌功能菌群的影响
由表1可见,间作模式下参与土壤氮循环、碳循环、纤维素降解以及硫循环过程的T-RFs所对应功能菌属的丰度百分数,整体高于玉米单作和马铃薯单作处理所对应的土壤。长度为89、159、150 bp的T-RFs片段,归属为土壤亚硝化单胞菌属、节杆菌属和固氮螺丝菌属,均与土壤氮循环有关,为马铃薯间作玉米模式下所特有;不同处理下,长度为125、128 bp的T-RFs片段所对应的中慢生根瘤菌属细菌相对丰度百分比也以马铃薯间作玉米栽培模式最高。与土壤碳循环有关的T-RFs片段分别为125、141、142、159、160、169、195、200、203 bp,其对应的土壤细菌优势菌群归类为链霉菌属,其丰度百分比较玉米单作、马铃薯单作分别高出2.78倍、1.84倍。此外,参与碳循环,并且归属为醋杆菌属130 bp的TRFs片段和拟杆菌属93、95、171 bp的T-RFs片段的细菌相对丰度百分比也以间作处理较高。
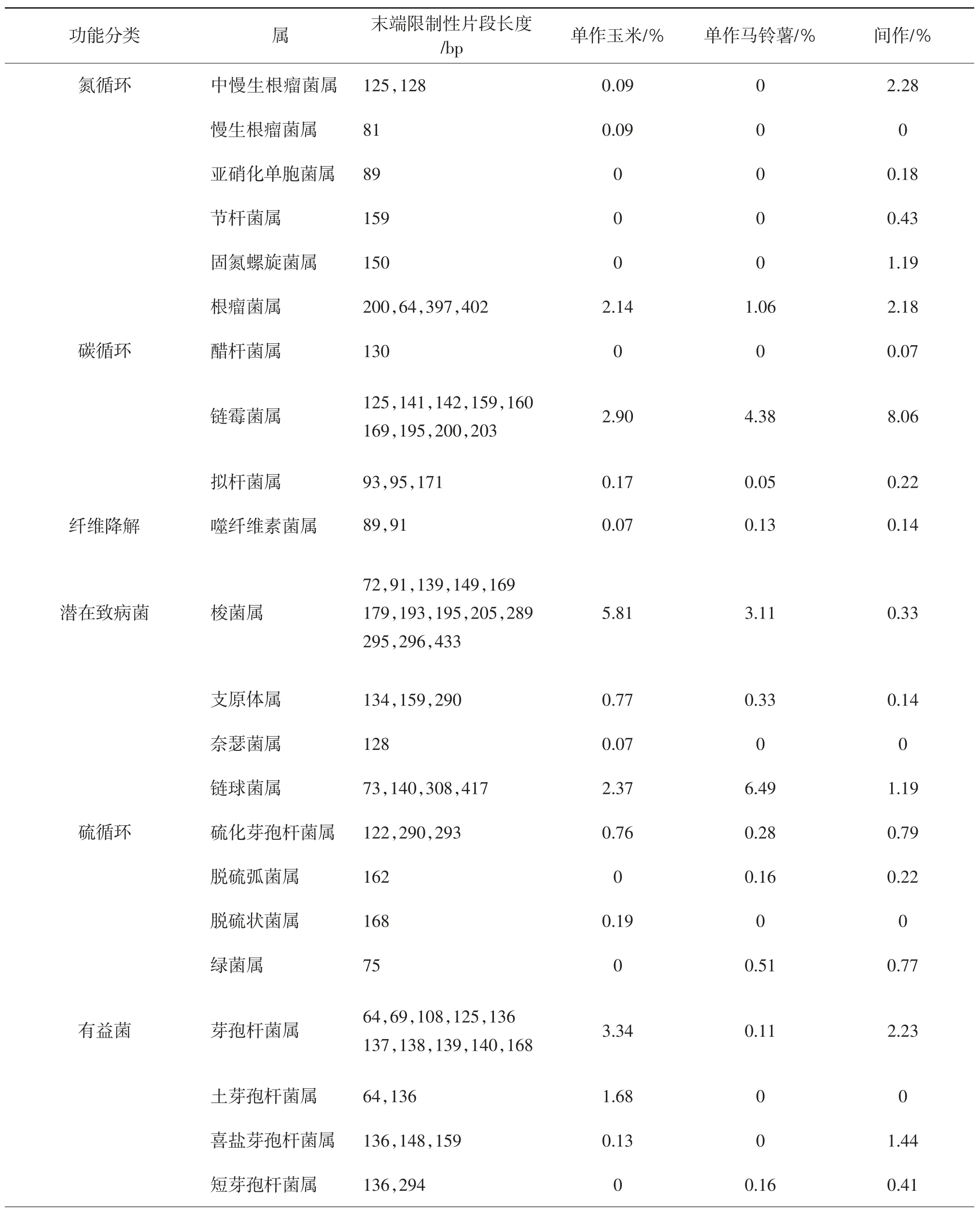
表1 土壤细菌T-RFs对应的功能菌群相对丰度百分比
间作模式下,T-RFs片段长度为200、364、397、402 bp的根瘤菌属相对丰度百分比较单作玉米高出了1.87%,是单作马铃薯的2.06倍;中慢生根瘤菌属的丰度百分比为单作玉米的25.33倍,高出单作马铃薯2.28%。间作处理中有益菌属的喜盐芽孢杆菌属、短芽孢杆菌属丰度百分比较单作玉米、单作马铃薯也有显著增加。马铃薯间作玉米下土壤潜在致病菌的梭菌属、支原体属、链球菌属的丰富百分比均低于单作玉米和单作马铃薯;其相对丰度百分比仅相当于对应微生物菌属的5.68%~10.61%、18.18%~42.42%、18.34%~50.21%;奈瑟菌属仅出现在单作玉米处理。
可见,间作能通过影响与碳、氮、硫循环有关的土壤细菌群落丰度百分比而影响细菌群落的组成。间作在一定程度上降低了潜在致病菌所占比例。
2.5 马铃薯间作玉米下土壤细菌群落组成与土壤理化性状间的相互关系
RDA分析表明(图4),全部排序轴能够在累积变量74.24%上揭示单作及间作体系对土壤细菌门水平分类学组成差异的影响,其中第一排序轴解释变量为56.81%,第二排序轴解释变量为17.43%。厚壁菌门相对丰度的改变与土壤全氮呈正相关,而变形菌门、栖热菌门、拟杆菌门、疣微菌门相对丰度的改变与土壤有机质和速效钾呈正相关,放线菌门相对丰度的改变与土壤全氮、全磷呈正相关,与土壤有机质和速效钾呈负相关。但蒙特卡罗检验表明,马铃薯单作、玉米单作及马铃薯间作玉米栽培4年后的土壤各理化性状指标与土壤细菌群落组成相对丰度间的相关性均不显著(P>0.05)。本试验条件下,土壤理化性质的差异并不是驱动土壤细菌群落组成中各主要微生物类群相对丰度差异的主要原因。
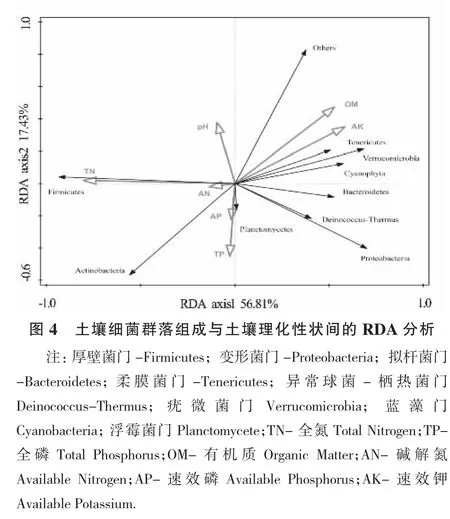
3 讨论
3.1 间作栽培对土壤细菌主要类群生物量的影响
试验中,马铃薯间作玉米下土壤细菌PLFAs与同一年限马铃薯单作、玉米单作均没有差异,这与Li[23]对玉米间作花生的研究结论一致。在相同栽培年限下,以PLFAs表征的G+生物量在马铃薯单作、玉米单作及马铃薯间作玉米间无显著差异,但G-的脂肪酸含量在单作玉米与单作马铃薯间有显著性差异。Esperschütz等[24]、Buyer等[25]研究表明,相对G+,G-对共生营养条件较敏感,往往更加依赖根系分泌的碳化合物,能主导枯落物碳的同化[26]。分析认为,玉米根系与马铃薯根系的分泌物都能为G-提供更丰富的可利用碳源,但单作玉米地上部生物量远大于单作马铃薯,这可能有助于更多的玉米枯落物进入土壤;由于G-优先利用输入土壤系统的新鲜植物枯落物和根系分泌的低分子量有机碳化合物,而G+被认为偏好于较老的以及经微生物转化的土壤有机质为碳源[27-28]。因此,这可能就是马铃薯单作与玉米单作间,以PLFAs表征的G-生物量有显著差异的主要原因。
试验中,相比2015年,2017年各处理下以PLFAs表征的细菌、G+和G-生物量呈现下降趋势,且间作栽培下降最为显著,G-较G+脂肪酸含量在年际间的差异较年度内的变化更明显;G+/G-比值除单作玉米外,其他处理在年际间有上升的趋势,且马铃薯间作玉米显著上升。杨敏等[29]发现,魔芋连作会使根际土壤中细菌数量明显增多,这与本试验结果相反;而刘莹莹等[30]在黄瓜连作中发现,随着栽培年限的增加,土壤细菌、G-细菌PLFAs量呈降低趋势,这与本试验结果一致。可见,随着栽培年限增加,不同作物对土壤细菌、G+和G-生物量的影响不同,而间作栽培由两种作物共同参与,更有益于土壤细菌、G+和G-生物量的调节。土壤中G+/G-比值能反应农田生态系统的稳定性,G+/G-比值越大,土壤生态系统越稳定[31];G+/G-比值的高低也能表明腐殖化碳源的多少[32]。可见,相比2015年,2017年马铃薯间作玉米的G+/G-比值显著上升的主要原因是马铃薯间作玉米栽培更有利于土壤生态系统的稳定,并能腐殖化更高的碳源。
3.2 间作栽培对土壤细菌群落组成、多样性及功能的影响
单作马铃薯、单作玉米及马铃薯间作玉米下土壤厚壁菌门、变形菌门和拟杆菌门为土壤细菌优势菌门;马铃薯间作玉米表现出较高的相对丰度,这与Zheng等[33]的研究结果一致。相关研究认为,间作作物类型不同,改变了菌门相对丰度的百分比,却未改变优势菌门的类型,这可能是处于相同生长环境中的土壤微生物类群具有相似性[34]。赵雅效等[35]在紫花苜蓿间作小黑麦中发现土壤细菌的优势菌门是变形菌门和拟杆菌门,并发现间作能改变土壤变形菌门和拟杆菌门的相对丰度,提高土壤细菌丰富度和多样性,这与Zhang等[36]桑树间作紫花苜蓿的研究结果一致。同时,变形菌门在土壤细菌群落中具有较高的相对丰度[37],并且是碱性土壤的优势种群[38-39]。本试验中,厚壁菌门、变形菌门和拟杆菌门相对丰度的改变,可能是种植模式和作物不同导致的[40],其改变了土壤根际微环境,改善了细菌菌门多样性,使相对丰度发生了变化。也可能受土壤类型的影响[41],存在对土壤微环境敏感性强的细菌,能刺激特定菌门细菌的生长,并成为优势菌门,具体原因有待进一步研究。
本研究表明,与单作相比,马铃薯间作玉米下土壤细菌群落的多样性和均匀度指数间无差异。这同樊晓刚等[42]土壤微生物群落通常具有比较稳定的多样性特征的研究结论一致。但Li等[23]、Latati等[43]研究认为,间作作物地下交互作用导致根际土壤微生物群落的物种组成具有特异性。实际上,在间作条件下,植物根系不是完全孤立而是相互交织在一起,通过作物根系活动、分泌物、根际沉积特征的影响以及豆科作物根际土壤特异性细菌,刺激作物根际的过程,导致根际化学特性的变化,是间作下土壤细菌多样性产生明显差异的主要原因。然而,试验中,马铃薯间作玉米下土壤微生物群落多样性与前人研究结果的差异表明,间作体系对土壤微生物群落的调控是一个缓慢的过程,在多种因子综合作用下,随种植年限延长,间作与单作对土壤微生物多样性的影响差异,才有可能逐渐表现出来。
试验中,间作下参与碳循环的拟杆菌属细菌相对丰度显著增加,相关研究也证实,土壤厚壁菌门、变形菌门和拟杆菌门细菌与土壤碳的降解有关[44]。因此,这也间接说明土壤拟杆菌属细菌是重要的有机物分解者。间作模式下,马铃薯、玉米地下种间作用可能有利于提升土壤细菌的分解能力。有研究证实,细菌群落结构的变化显著影响了由专性微生物介导的固氮和硝化作用等功能过程[45]。Song等[46]的研究结果表明:禾谷类作物和豆科作物间作,能改变固氮菌的优势种,影响土壤微生物的群落组成,进而促进豆类作物结瘤固氮。玉米花生间作,较单作显著增加了与固氮有关的土壤细菌的相对丰度,是因为玉米花生间作减少了与反硝化作用有关的基因拷贝数,显著缓解了化学氮肥对结瘤和N2固定的抑制效应[17]。本研究中,脱硫弧菌属相对丰度的显著增加,也表明马铃薯间作玉米能促进土壤硫循环,改善土壤理化性质以及土壤硫元素的有效性,这同Muyzer和Stams[47]有关脱硫杆菌属(Desulfobacterium)的描述类似。总体上,马铃薯间作玉米增加了与土壤碳、氮、硫循环以及纤维素分解有关细菌菌属的相对丰度。增加了有益菌,降低了有害菌的丰度。但在禾本科(玉米)与茄科作物(马铃薯)的种间作用下为什么能产生与禾本科、豆科间作类似的微生物功能效应,还需要进一步研究。
试验中,土壤厚壁菌门相对丰度与全氮呈正相关,土壤变形菌门、拟杆菌门相对丰度与土壤速效钾、有机质呈正相关。这是因为厚壁菌门、拟杆菌门细菌能参与土壤养分的循环,对土壤全氮、速效钾和有机质具有一定的消解作用,使其快速转变为作物生长所需的营养物质[48]。此外,厚壁菌门是在作物根际土壤中存在的一种固氮菌,能很好地参与土壤氮素的转化[49]。变形菌门属于异养型细菌,是与植物共生的固氮细菌,能增强土壤的固氮能力,其丰富度的高低能在一定程度上反应土壤有机质含量的高低[34]。拟杆菌门是有机碳的主要矿化者[50],能为土壤细菌的活动提供一定的碳源,这与本研究中变形菌门、拟杆菌门与有机质呈正相关的结论相吻合。因此,土壤全氮、速效钾和有机质含量能影响相应菌门相对丰度的变化。但本研究中,RDA检验表明,土壤各理化性状指标与土壤细菌群落组成相对丰度间的相关性不显著,故土壤理化差异不是驱动土壤细菌群落组成变化的主要原因。可见,驱动间作土壤细菌变化是土壤环境整体变化的结果,它可能由种植模式、作物种类、气候因子、土壤环境因子以及作物间的种竞争互利关系等因素共同决定。
4 结论
马铃薯玉米间作及单作栽培在短期内没有影响土壤细菌群落的多样性,但改变了土壤细菌群落组成,不同栽培模式下的土壤细菌群落相对丰度差异没有受到土壤理化性质差异的显著影响。玉米单作下土壤革兰氏阴性菌(G-)对土壤环境变化的影响比马铃薯单作和马铃薯间作玉米对土壤的影响更敏感。马铃薯间作玉米提高了土壤中有益细菌菌属的丰度百分比、降低了潜在致病菌属的丰度百分比。

