不同FMR1基因的CGG重复数及血栓前状态基因多态性的女性生育结局分析
董 微,张 博(通讯作者),梁 婧,邵 超,戴君妹
(1广安门医院南区妇科 北京 102600)
(2广安门医院南区针灸科 北京 102600)
(3广安门医院南区肛肠科 北京 102600)
脆性X染色体智力缺陷1基因(FMR1)被发现其5'端非编码区的CGG重复序列在传代过程中出现异常扩增会引起脆性X综合征。该区CGG重复超过200个以上经常会随着甲基化引起FMR1基因沉默,进而使新生儿因缺乏脆性X智力减退蛋白而出现智力障碍情况[1]。携带FMR1前突变者出现卵巢功能早衰的风险性将会明显增大,但是轻度卵巢早衰也可能出现在中间区,甚至是在正常范围之内,故而FMR1基因CGG重复数可能同卵巢储备功能相关。血栓前状态会增加静脉血栓栓塞风险,导致胎盘灌注不足,进而出现不良妊娠情况[2]。但是在其基因多态性同不良妊娠方面的研究较少,仍需开展深入研究。为此,本文分析有不良孕产史的育龄期女性FMR1基因的CGG重复数以及血栓前状态基因多态性情况,现报道如下。
1.资料与方法
1.1 一般资料
将2018年9月—2020年12月本院收治的200例育龄期孕妇作为研究样本,依据其有无不良孕产史将其分成常规组(无不良孕产史,100例)以及实验组(有不良孕产史,100例)。常规组与实验组孕妇中,平均年龄分别为(30.68±2.11)岁、(30.73±2.15)岁。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法
(1)提取全血基因组DNA,采集孕妇2 mL上臂静脉血,使用磁珠法全血基因组提取试剂盒(NanoMagBio NMG0121),完全按照试剂盒说明书对全血样本进行基因组DNA提取。仪器:NanoMagBio S-96自动核酸提取仪。(2)PCR扩增,PCR体系有FMR1引物、高GC聚合酶溶液以及高GC扩增缓冲液。除高GC聚合酶试剂外全部试剂实施解冻和涡旋,依据说明书添加相应剂量后实施离心以及涡旋混匀。在96孔PCR检测板中添加20 ng/ul DNA模板1 μL,将其充分混合后密封,重复进行涡旋以及离心。之后利用ABI-9700型定量PCR仪(采购自美国ABI)实施扩增。将384PCR板放置在384pcr仪加热模块上,核对程序信息,程序如下:94 ℃2 min,之后以 94 ℃ 20 s、56 ℃ 30 s、72 ℃ 1 min 形式开展45次循环,随后72 ℃ 5 min,12 ℃长期。用虾碱性磷酸酶(SAP)将Pre-PCR反应后体系中剩余的dNTPs去磷酸化,使其转化为dNDPs,防止dNTPs影响下一步的延伸反应。在ddNTPs存在的条件下,通过多重PCR反应使引物延伸一个碱基,从而得到目的基因片段中的待测位点——单碱基延伸反应。核对程序信息,程序如下:94 ℃ 30 s,之后以 94 ℃ 5 s、52 ℃ 5 s、80 ℃ 5 s 形式开展45次循环,其中以52 ℃ 5 s、80 ℃ 5 s形式开展5次循环,随后72 ℃ 3 min、12 ℃长期。质谱检测实验中的阳离子交换树脂纯化实验步骤,通过阳离子交换树脂纯化去除PCR产物中的阳离子等。(3)血栓前状态基因检测,采集孕妇外周静脉血2 mL,将其置于乙二胺四乙酸试管内。通过核酸分离纯化和加样系统(采购自罗氏公司),选择200 μL全血中基因组DNA开展纯化,并选择100ngDNA,对其中凝血因子Ⅱ基因、凝血因子Ⅴ基因、纤溶酶原激活剂抑制物-1基因5 G/4 G、亚甲基四氢叶酸还原酶(MTHFR)基因677位点基因型、MTHFR基因1298位点基因型以及甲硫氨酸合成还原酶(MTRR)突变位点实施探究。
1.3 观察指标
(1)分析CGG重复序列分布情况。(2)对比两组孕妇前突变以及灰区分布情况。(3)分析两组孕妇前突变核型的CGG重复数目。(4)分析不同基因位点同风险等级之间关联性。(5)对比不同风险等级孕妇生育结局。
1.4 统计学方法
采用SPSS 22.0统计软件进行数据处理。正态分布的计量资料采用均数±标准差(±s)表示,组间比较采用t检验,计数资料用频数和百分比(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2.结果
2.1 CGG重复序列分布情况
在200例孕妇中,不同CGG重复数目检测结果为35种,其中CGG重复数目变异区间是20~200。CGG重复数目排列前三位分别是31(65例,32.50%)、28(55例,27.50%)、35(30例,15.00%)。
2.2 两组孕妇前突变以及灰区分布情况比较
实验组灰区以及前突变占比均高于常规组,差异有统计学意义(P<0.05),见表1。
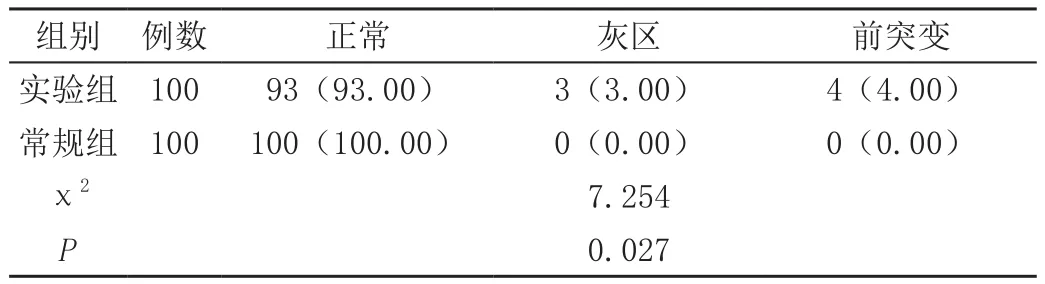
表1 两组孕妇前突变以及灰区分布比较[n(%)]
2.3 实验组孕妇血栓前状态发生风险情况
在100例实验组孕妇中,12例(12.00%)属于低风险、59例(59.00%)属于中风险、29例(29.00%)属于高风险。
2.4 不同基因位点同风险等级的相关性
伴随血栓前状态发生风险程度的提升,PAI-1基因675位点基因型5 G/5 G以及MTHFR基因677位点基因型TT占比逐渐升高,见表2。
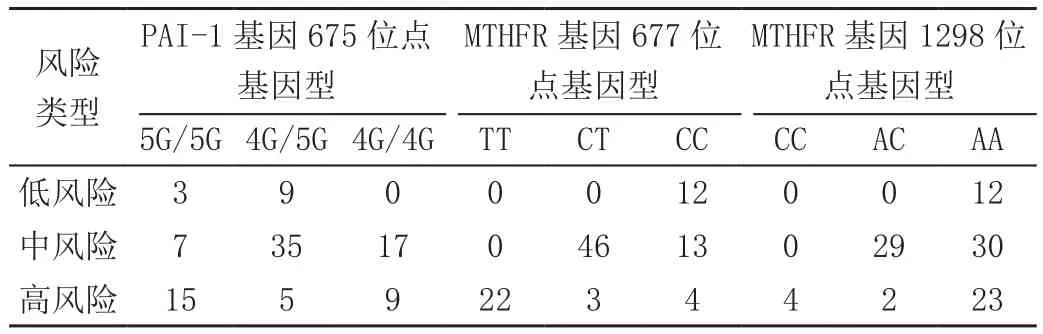
表2 不同基因位点同风险等级之间关联性(例)
2.5 不同风险等级孕妇生育结局情况比较
低风险孕妇中,1例(8.33%)流产;中风险孕妇中,5例(8.47%)流产;高风险孕妇中,8例(27.59%)流产。三组流产率差异有统计学意义(χ2= 6.262,P<0.05)。
3.讨论
当卵巢储备功能下降时,则说明卵巢内存留的可募集卵泡数量降低,使得卵母细胞质量下降,进而出现不孕或生育功能下降等情况。对于存在无诱因反复流产的患者而言,相较于正常人,其卵巢储备功能有明显下降,并且其出现胚泡非整倍体概率增大。伴随产前诊断和基因检测技术在临床的应用,发现存在不良孕产史的女性,其胎儿染色体异常和基因异常存在明显关联性[3]。
卵巢储备功能降低同FMR1基因存在相关性,并且CGG序列重复数在判断卵巢功能受损程度方法具有重要作用。在本次研究中,常规组灰区以及前突变占比均低于实验组(P<0.05)。提示存在不良孕产史的女性中,实施FMR1基因筛查,对预测其妊娠结局具有重要作用。当FMR1基因发生前突变时,会加速卵泡闭锁,导致卵泡数量下降,进而出现卵巢功能减退情况。妊娠早期若出现血栓前状态,则会表现为自然流产;而妊娠晚期出现血栓前状态,则会引起胎盘早剥、胎儿宫内发育迟缓和死产等情况[4]。本次研究中发现,伴随血栓前状态发生风险程度的提升,PAI-1基因675位点基因型5 G/5 G以及MTHFR基因677位点基因型TT占比逐渐升高。高风险孕妇流产率均高于低风险、中风险。MTHFR是调节四氢叶酸以及半胱氨酸代谢的重要酶,PAI-1活性上升会导致纤维蛋白溶解,使得血液呈高凝状态,进而诱发血栓前状态[5]。因此,当上述两基因位点基因型占比升高时,孕妇发生血栓前状态的风险性则显著升高,出现不良妊娠结局的概率增大。
综上所述,FMR1基因前突变的风险性升高常见于有不良孕产史的女性,而血栓前状态基因多态性会导致血栓出现,进而引起流产等不良妊娠结局。

