基于NRG/ErbB通路探讨三七总皂苷对偏头痛大鼠的作用机制*
李祥欣, 张保朝, 刘义锋, 刘少哲, 裴 双, 余 洋, 温昌明
(南阳市中心医院,河南南阳 473000)
偏头痛临床表现为头部搏动样疼痛的中枢神经系统功能障碍疾病,病程复杂,反复发作,常伴有恶心、呕吐等症状,严重影响患者生活质量[1],但发病机制目前尚不明确。目前临床上常用曲普坦类药物治疗偏头痛,但效果不佳,且不能从根本上治疗疾病[2],因此寻找新的治疗方案对于缓解疾病意义重大。三七总皂苷(total saponins ofPanax notoginseng,TSPN)作为三七的有效成分,对神经功能具有保护作用[3],但具体机制尚不清楚。神经调节蛋白(neuregulin,NRG)/表皮生长因子受体(epidermal growth factor receptor,ErbB)信号通路作为脑神经元中信号传导通路,对神经元具有保护作用[4];在抑郁大鼠模型中能保护神经元免受损伤,实现对疾病的缓解[5],但尚未显示其在偏头痛中的研究。因此,本研究采用硝酸甘油溶液皮下注射制备偏头痛大鼠模型,探讨TSPN 对偏头痛的保护机制,以期为临床上TSPN治疗偏头痛提供参考资料。
材 料 和 方 法
1 动物
48 只SD 大鼠(SPF 级、雄性),6 周龄,体重(190±10)g,购自北京维通利华实验动物技术有限公司,生产许可证号为SCXK(京)2016-0011。温度(23±0.5)℃、湿度(50±5)%、12 h 光照/12 h 黑暗条件下正常饮水摄食。本研究实验动物符合3R 原则,本研究遵守国际疼痛研究协会实验动物护理和指南有关规定,经本院伦理协会审核并通过。
2 主要试剂
硝酸甘油溶液(北京益民药业有限公司,批准文号:国药准字H11020289,规格:1 mL:5 mg×1支/盒);三七总皂苷片(滇虹药业集团玉溪生物制药有限公司,批准文号:国药准字Z53021487);NRG/ErbB 通路抑制剂AG825(Biosource);苏木精-伊红(hematoxylin-eosin,HE)染色液(北京索莱宝科技有限公司,货号:G1120);大鼠白细胞介素6(interleukin-6,IL-6)、IL-1β、5-羟色胺(5-hydroxytryptamine,5-HT)、β-内啡肽(β-endorphin,β-EP)、降钙素基因相关肽(calcitonin gene-related peptide,CGRP)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒及NRG1、ErbB2、ErbB3、ErbB4、caspase-3 和cleaved caspase-3 抗体(Abcam,货号分别为:ab234570、ab255730、ab114804、ab274398、ab203548、ab191139、ab237715、ab32121、ab19391、ab184787 和ab52072);大鼠一氧化氮(nitric oxide,NO)ELISA 试剂盒(上海润裕生物科技有限公司,货号:18941)。ChemiDoc XRS+蛋白成像系统(Bio-Rad)。
3 主要方法
3.1 实验分组及建模 SD 大鼠随机分为对照组(control group)、模型组(model group)、TSPN 组(TSPN group;10 mg/kg TSPN)和TSPN+抑制剂组(TSPN+inhibitor group;10 mg/kg TSPN+50 μg/kg AG825),每组12 只。TSPN 组参考人与动物等效剂量换算法灌胃10 mg/kg TSPN[6],TSPN+抑制剂组在TSPN 组基础上尾静脉注射50 μg/kg AG825,对照组和模型组分别灌胃和静脉注射等体积生理盐水,每天1次,连续1周。
末次给药1 h 后,模型组、TSPN 组和TSPN+抑制剂组大鼠参考Tassorelli 等[7]方法建立偏头痛模型:大鼠按10 mg/kg(2 mL)剂量硝酸甘油溶液皮下注射,当大鼠出现耳红、爬笼、挠头、咬尾、往返运动增加等现象,则为造模成功。对照组大鼠相同部位注射等体积生理盐水。
3.2 各组行为学评分 记录各组大鼠连续30 min内出现爬笼、挠头、咬尾和往返运动次数,每个症状出现1 次记1 分[8],以造模成功为0 min,共记录0~30 min、60~90 min 和120~150 min 三个时段。观察耳红出现时间和耳红消失时间。
3.3 样本收集 实验结束后腹主动脉采血,加入促凝管中,1 200×g离心10 min,收集血清,置于-20 ℃冰箱备用;断头处死,取脑组织,随机6 只置于4%多聚甲醛中固定,另6只置于-80 ℃冰箱保存。
3.4 HE 染色检测脑组织神经元形态 取出4%多聚甲醛中固定组织,石蜡切片(厚度:5 μm),二甲苯脱蜡、乙醇水合,经苏木精染色、盐酸分化、伊红复染后,显微镜下观察脑组织神经元形态。
3.5 ELISA 检测血清中NO、IL-6 和IL-1β 水平及脑组织中5-HT、β-EP和CGRP含量 取出血清,参考大鼠ELISA试剂盒说明书检测血清中NO、IL-6和IL-1β水平;脑组织取0.5 mg,加入预冷的磷酸盐缓冲液,冰上匀浆,1 200×g离心25 min,取上清,参考大鼠ELISA 试剂盒说明书检测脑组织中5-HT、β-EP 和CGRP含量。
3.6 Western blot 法检测脑组织中NRG1、ErbB2、ErbB3、ErbB4、caspase-3 和cleaved caspase-3 蛋白表达情况 取30 mg 脑组织,冰上匀浆,RIPA 裂解液裂解组织,10 000×g、4 ℃离心20 min,上清为总蛋白,上样20 μg 蛋白、PVDF 膜转膜,5%脱脂奶粉室温封闭2 h,加入Ⅰ抗(NRG1,1∶1 000;ErbB2,1∶1 000;ErbB3,1∶500;ErbB4,1∶500;caspase-3,1∶2 000;cleaved caspase-3,1∶2 000)于4 ℃孵育过夜;加入对应Ⅱ抗,室温孵育1 h;ECL 化学发光液避光显色,蛋白成像系统拍照和定量分析。
4 统计学处理
数据均采用GraphPad Prism7.0进行分析。计量资料以均数±标准差(mean±SD)描述。多组间比较行单因素方差分析,进一步两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结果
1 TSPN对大鼠头痛发作时行为学和耳红的影响
与对照组相比,模型组和TSPN+抑制剂组在0~30 min、60~90 min 和120~150 min 的行为学评分,以及TSPN 组在0~30 min和60~90 min的行为学评分显著升高(P<0.05);与模型组相比,TSPN 组在0~30 min、60~90 min 和120~150 min 的行为学评分,以及TSPN+抑制剂组在60~90 min 和120~150 min 的行为学评分显著降低(P<0.05),TSPN 组耳红出现时间延长(P<0.05),TSPN 组和TSPN+抑制剂组耳红消失时间缩短(P<0.05);与TSPN 组相比,TSPN+抑制剂组在0~30 min、60~90 min 和120~150 min 行为学评分升高(P<0.05),耳红出现时间缩短(P<0.05),耳红消失时间延长(P<0.05),见图1、2。

Figure 1. Comparison of behavioral scores during headache attack of the rats in the 4 groups. Mean±SD.n=12.*P<0.05vs control group;#P<0.05vs model group;&P<0.05vs TSPN group.图1 4组大鼠头痛发作时行为学评分比较

Figure 2. The appearance time and disappearance time of the rats in the 4 groups were compared. A:ear red appearance time;B:ear red disappearance time.Mean±SD.n=12.*P<0.05vs control group;#P<0.05vs model group;&P<0.05vs TSPN group.图2 4组大鼠耳红出现时间和耳红消失时间比较
2 TSPN对大鼠脑组织神经元的影响
对照组脑组织神经元染色均匀,细胞未肿胀、坏死;模型组神经元出现明显空泡状,细胞萎缩、坏死严重,出现局部坏死、血管阻塞现象;TSPN 组神经元损伤得到一定修复,神经元仅存在部分空泡现象;TSPN+抑制剂组细胞空泡现象明显,出现部分血管阻塞现象,见图3。
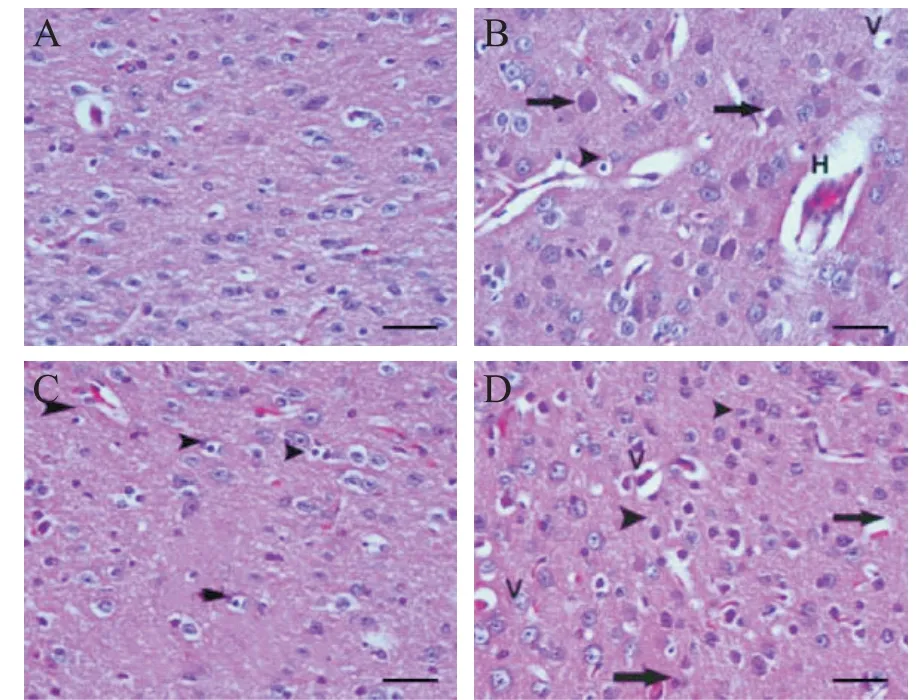
Figure 3. Neurons in brain tissues of the rats in the 4 groups(HE staining,scale bar=100 μm). A:control group;B:model group;C:TSPN group;D:TSPN+inhibitor group. Long arrow:vascular obstruction;short arrow:atrophic cells;H:local necrosis;V:vacuole cells. Obvious vacuoles,cell atrophy,severe necrosis,local necrosis,and blood vessel obstruction were observed in model group. Partial vacuolation was observed in TSPN group. Cellular vacuolation was obvious in TSPN+inhibitor group.图3 4组大鼠脑组织神经元形态
3 TSPN 对大鼠血清中NO、IL-6 和IL-1β 水平的影响
与对照组相比,模型组和TSPN+抑制剂组血清中NO、IL-6 和IL-1β 水平,以及TSPN 组血清中NO 水平显著升高(P<0.05);与模型组相比,TSPN 组血清中NO、IL-6 和IL-1β 水平,以及TSPN+抑制剂组血清中IL-6 和IL-1β 水平显著降低(P<0.05);与TSPN 组相比,TSPN+抑制剂组血清中NO、IL-6 和IL-1β 水平显著升高(P<0.05),见图4。

Figure 4. The levels of NO,IL-6 and IL-1β in serum of the rats in the 4 groups were compared. A:NO level in serum;B:IL-6 level in serum;C:IL-1β level in serum. Mean±SD.n=12.*P<0.05vs control group;#P<0.05vs model group;&P<0.05vs TSPN group.图4 4组大鼠血清中NO、IL-6和IL-1β水平比较
4 TSPN 对大鼠脑组织中5-HT、β-EP 和CGRP 含量的影响
与对照组相比,模型组脑组织中5-HT和β-EP含量,以及TSPN+抑制剂组脑组织中5-HT 含量显著降低(P<0.05),TSPN 组脑组织中β-EP 含量,以及模型组、TSPN 组和TSPN+抑制剂组脑组织中CGRP 含量显著升高(P<0.05);与模型组相比,TSPN 组脑组织中5-HT和β-EP含量,以及TSPN+抑制剂组脑组织中β-EP 含量显著升高(P<0.05),TSPN 组和TSPN+抑制剂组脑组织中CGRP 含量显著降低(P<0.05);与TSPN 组相比,TSPN+抑制剂组脑组织中5-HT 和β-EP含量显著降低(P<0.05),CGRP含量显著升高(P<0.05),见图5。

Figure 5. Comparison of the contents of 5-HT,β-EP and CGRP in brain tissues of the rats in the 4 groups. A:5-HT content in brain tissue;B:β-EP content in brain tissue;C:CGRP content in brain tissue. Mean±SD.n=6*P<0.05vs control group;#P<0.05vs model group;&P<0.05vs TSPN group.图5 4组大鼠脑组织中5-HT、β-EP和CGRP含量比较
5 TSPN 对大鼠脑组织中NRG1、ErbB2、ErbB3、ErbB4、caspase-3 和cleaved caspase-3 蛋白表达的影响
与对照组相比,模型组和TSPN+抑制剂组脑组织中NRG1、ErbB2、ErbB3 和ErbB4 蛋白水平,以及TSPN 组脑组织中ErbB2、ErbB3 和ErbB4 蛋白水平显著降低(P<0.05),模型组和TSPN+抑制剂组脑组织中cleaved caspase-3/caspase-3蛋白水平显著升高(P<0.05);与模型组相比,TSPN 组脑组织中NRG1、ErbB2、ErbB3 和ErbB4 蛋白水平,以及TSPN+抑制剂组脑组织中NRG1 蛋白水平显著升高(P<0.05),TSPN 组和TSPN+抑制剂组脑组织中cleaved caspase-3/caspase-3 蛋白水平显著降低(P<0.05);与TSPN 组相比,TSPN+抑制剂组脑组织中NRG1、ErbB2、ErbB3和ErbB4 蛋白水平显著降低(P<0.05),cleaved caspase-3/caspase-3 蛋白水平显著升高(P<0.05),见图6。

Figure 6. The protein levels of NRG1,ErbB2,ErbB3,ErbB4,caspase-3 and cleaved caspase-3 in brain tissues of the rats in the 4 groups. Mean±SD.n=6.*P<0.05vs control group;#P<0.05vs model group;&P<0.05vs TSPN group.图6 4组大鼠脑组织中NRG1、ErbB2、ErbB3、ErbB4、caspase-3和cleaved caspase-3蛋白水平情况
讨论
偏头痛中医属“头风”、“头痛”、“厥头痛”等范畴,表现为感受外邪、情至内伤、饮食不节、久病至淤所致肝、脾、肾失常,导致痰淤阻络[9]。本研究中,偏头痛大鼠出现耳红、爬笼、挠头、咬尾、往返运动增加,提示大鼠出现不适症状。TSPN 在神经保护方面研究成为热点,可缓解神经元损伤[10],在麻醉药七氟醚致神经元损害中,TSPN 可促进细胞增殖、抑制细胞凋亡进而缓解七氟醚导致的神经细胞凋亡、学习和记忆障碍现象,实现对机体的保护[11]。TSPN 治疗偏头痛后大鼠耳红、爬笼、挠头、咬尾、往返运动症状均有所减轻,耳红出现时间延后、耳红消退时间提前,提示TSPN 能够缓解偏头痛造成的不适症状。HE 染色检测,偏头痛大鼠脑组织出现明显的神经元坏死、空泡现象;经TSPN 治疗后,脑组织神经元损伤现象得到一定缓解,提示TSPN 可能缓解神经元损伤实现对偏头痛大鼠的保护。
在本研究用硝酸甘油诱导大鼠制备偏头痛模型,硝酸甘油作为NO 供体,在体内可直接作用于血管平滑肌细胞生成NO,增加血液中NO 含量[12];硝酸甘油也可刺激神经末梢释放CGRP,CGRP 在外周血中浓度增加会诱发血管扩张和脑膜肥大细胞脱颗粒,进而释放神经组织血管活性物质,包括IL-6 和IL-1β等,诱发神经源性炎症偏头痛[13]。5-HT在偏头痛发作期水平降低,可引起血管扩张性疼痛,临床上多种头痛药通过激活5-HT 发挥作用[14]。β-EP 在疼痛应激下可释放入血,抑制P 物质的释放,从而使神经疼痛感觉抑制[15]。本研究显示,模型组血清中NO、IL-6 和IL-1β 水平,以及脑组织中CGRP 含量升高,脑组织中5-HT和β-EP含量降低。这提示大鼠受硝酸甘油刺激,生成NO,增加血液中NO 含量;同时刺激CGRP 的生成,CGRP 水平升高诱发血管扩张和脑膜肥大细胞脱颗粒,促进IL-6 和IL-1β 的升高,诱发炎症偏头痛;偏头痛发生后神经递质5-HT和β-EP含量降低,增加痛感,导致大鼠出现不适症状。经TSPN 治疗后,血清中NO、IL-6 和IL-1β 水平,以及脑组织中CGRP 含量降低,脑组织中5-HT 和β-EP 含量升高,提示TSPN 能够缓解硝酸甘油造成的大鼠炎症性偏头痛,减少大鼠痛感,实现对疾病的保护。
NRG 可作为配体结合于细胞表面ErbB 受体,引起原有构象发生改变,进而影响下游信号通路的变化,进而调节神经细胞[16]。NRG 中NRG1 研究较广泛,ErbB 在脑中神经元胞体中可见ErbB2、ErbB3 和ErbB4。另有研究显示,NRG/ErbB 通路具有抗凋亡作用,能够抑制caspase-3的活化,实现对神经干细胞凋亡的缓解[17];能够抑制巨噬细胞的浸润,阻断巨噬细胞和小胶质细胞表达促炎因子[18]。在本研究中,模型组NRG1、ErbB2、ErbB3和ErbB4蛋白水平降低,cleaved caspase-3/caspase-3 蛋白水平升高,提示NRG/ErbB 通路蛋白在偏头痛脑组织中表达降低,对神经元的保护作用减弱,导致炎症损伤加剧、神经元凋亡严重。经TSPN 治疗后,NRG/ErbB 通路处于激活状态,cleaved caspase-3/caspase-3 蛋白水平降低;在TSPN 治疗基础上添加抑制剂AG825,虽然AG825作为ErbB2 的特异性抑制剂,但ErbB2 受NRG 刺激发挥作用,会促进cleaved caspase-3/caspase-3、炎症因子IL-6 和IL-1β 水平升高,提示TSPN 能够通过激活NRG/ErbB通路实现对炎症、细胞凋亡的缓解。
综上所述,TSPN 通过激活NRG/ErbB 通路实现对偏头痛大鼠的保护,可能与抑制炎症、抑制神经元凋亡有关,为TSPN 在临床上治疗偏头痛提供一定动物实验参考依据。

