中缝核NG2细胞及5-HT的共同作用对大鼠睡眠-觉醒功能的调节*
魏砚君, 全 睿, 王 慧, 郭海波, 滕 柳, 石 鹏
(贵州中医药大学基础医学院,贵州贵阳 550025)
睡眠对人类的健康及认知极为重要,其是由脑内多个区域、多种神经元、多种神经递质参与的生理过程,但睡眠的调节机制尚不完全清楚[1]。现代研究中,对睡眠-觉醒周期的判定与分析一般是通过记录受试对象的脑电图(electroencephalogram,EEG)/肌电图(electromyogram,EMG)信号,该方法得到科学界的普遍认可[2]。
中缝核分布于脑干中线附近,沿脑干的整个尾侧延伸,5-羟色胺(5-hydroxytryptamine,5-HT)能神经元是其主要神经元成分[3]。5-HT 是脑内的重要神经递质,其在睡眠-觉醒周期的转换与维持中起着重要作用[4]。最新研究表明,脑内5-HT 含量的降低能够引起大鼠中脑中缝背核星形胶质细胞和小胶质细胞活性的增加,提示5-HT 对睡眠的作用可能与调节脑内胶质细胞活性有关[5-6]。对氯苯丙氨酸(parachlorophenylalanine,PCPA)是5-HT 合成酶抑制剂,能抑制大脑中5-HT 的合成[7],因此PCPA 常用于脑内5-HT 对中枢神经系统(central nervous system,CNS)影响的研究。
NG2 胶质细胞又称为少突胶质前体细胞(oligodendrocyte progenitor cells,OPCs),其因表达神经元-胶质细胞抗原2(neuron-glial antigen 2,NG2)蛋白聚糖而得名,被认为是存在于CNS 的第4 个胶质细胞群[8]。研究发现NG2 细胞对中枢神经损伤有着高度反应性,可能成为CNS 疾病治疗的靶点[9-11]。NG2 细胞具有高度分化潜能,以及成熟细胞表达受体的特征,其可表达离子型谷氨酸受体、γ-氨基丁酸(γ-aminobutyric acid,GABA)受体和5-HT 受体等[12],并与神经元之间存在经典或非经典的突触连接[13]。NG2细胞的代谢受到睡眠-觉醒机制的调控,与睡眠有着密切联系[14-15]。
NG2 细胞与5-HT 系统有着密切的功能联系[16],NG2细胞不仅可表达5-HT受体[12],作用于5-HT系统的药物还可影响NG2 细胞向OPCs 分化和导致髓鞘畸形[17]。但5-HT 和NG2 细胞的相互联系在睡眠-觉醒调节中的作用目前尚未见报道。
NG2 单克隆抗体(anti-NG2 monoclonal antibody,NG2-Ab)可与NG2 细胞表面的NG2 蛋白聚糖结合,从而抑制NG2细胞的功能特性[18]。本研究通过向大鼠中缝核内分别微量注射5-HT、PCPA、NG2-Ab、NG2-Ab+5-HT 及NG2-Ab+PCPA,并记录给药前后大鼠的EEG/EMG 信号,分析给药前后的睡眠-觉醒时相及EEG 波形特征,探讨中缝核NG2 细胞及NG2 细胞与5-HT的共同作用对大鼠睡眠-觉醒功能的影响。
材 料 和 方 法
1 材料
1.1 动物 健康SPF 级成年Sprague-Dawley(SD)大鼠70 只,雄性,体重(200±20)g,购自重庆腾鑫生物科技有限公司,许可证号为SCXK(渝)2012-0012。实验前,动物饲养于室温24 ℃、相对湿度40%~60%、清洁干燥、12 h/12 h 明暗交替的环境中,适应实验环境7 d,期间自由饮食、水。本研究经贵州中医药大学动物实验伦理委员会批准。
1.2 仪器、试剂和药物 BL-420S 生物机能实验系统(成都泰盟软件有限公司)。PCPA 和NG2-Ab(Sigma);5-HT(Solarbio)。
2 方法
2.1 药品制备 将预称重的PCPA 粉末加入无菌研钵中,加入少量生理盐水研磨搅拌,同时以每1 g PCPA 加入10 μL 吐温-80 的用量进行表面活化,使PCPA 充分溶解后,继续研磨并加入生理盐水,直至达到所需浓度。将配制好的PCPA 溶液收集至试剂瓶,于4 ℃保存备用。用生理盐水将5-HT 配制成浓度为2.5 g/L的溶液。
2.2 EEG 和EMG 记录电极及微量注射套管的埋置 将70 只SD 大鼠随机分成正常(normal)组、空白(control)组、PCPA 组、NG2-Ab 组、5-HT 组、NG2-Ab+PCPA 组及NG2-Ab+5-HT 组,每组10 只。正常组大鼠不做任何处理;对其他6 组大鼠进行EEG 和EMG记录电极及微量注射套管的埋置:大鼠经腹腔注射25%的乌拉坦溶液(1.0 g/kg)麻醉后,取俯卧位固定于脑立体定位仪上。对大鼠颅顶皮肤进行备皮处理后,用组织剪剪去颅顶皮肤和筋膜,充分暴露颅骨。用牙科钻于颅骨上额叶(AP:2.2 mm,ML:2.0 mm)及顶叶(AP:1.2 mm,ML:4.5 mm)相应位置处分别开1 个孔,将不锈钢电极植入颅骨内使其与硬脑膜充分接触。将2 个肌电电极植入大鼠颈部肌肉内。根据Paxinos&Watson大鼠脑立体定位图谱(第3版)确定中缝核位置(AP:-7.4 mm,L/R:0.0 mm,H:6.4 mm),于颅骨相应位置植入微量注射套管。最后,用牙科水泥固定EEG 和EMG 记录电极及微量注射套管。动物术后独笼饲养,腹腔注射青霉素3 d以预防感染,共恢复7 d,期间自由饮水、进食。实验结束时对套管/注射部位进行组织学验证。套管/注射位置通过对大鼠脑组织进行HE染色进行鉴定,结果见图1。本研究中的所有数据均来自注射部位在中缝核范围内的动物。
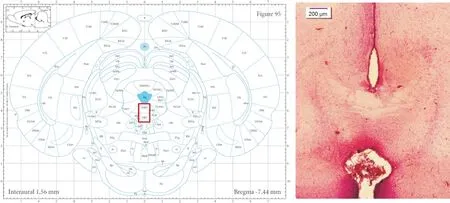
Figure 1. Location of microinjection casing/injection. A:the stereotactic map of Paxinos-Watson rat brain atlas[the red square:the position of raphe nuclei;Aq:aqueduct;DRD and DRV:dorsal and ventral DRN(dorsal raphe nuclei)];B:HE staining of the trocar/injection position,the corresponding position of DRN in rat brain.图1 微量注射套管/注射位置的HE染色情况
2.3 EEG/EMG 信号记录及微量注射给药 动物恢复后,将信号记录线与电极相连,独笼饲养于实验环境内训练并适应实验环境48 h。于早上9:00开始记录EEG/EMG 信号,连续记录24 h。于次日开始向除正常组外的各组大鼠中缝核内分别微量注射药物:(1)空白组大鼠微量注射1 μL生理盐水;(2)PCPA组大鼠微量注射1 μL PCPA 溶液(10 g/L)[19];(3)5-HT组大鼠微量注射1 μL 5-HT 溶液(2.5 g/L)[20];(4)NG2-Ab 组大鼠微量注射1 μL NG2-Ab 溶液(5 g/L)[16];(5)NG2-Ab+PCPA 组大鼠微量注射1 μL PCPA溶液(10 g/L)和1 μL NG2-Ab 溶液(5 g/L);(6)NG2-Ab+5-HT 组大鼠微量注射1 μL 5-HT 溶液(2.5 g/L)和1 μL NG2-Ab溶液(5 g/L)。于每日早9:00对每组大鼠微量注射药物,连续2 d。末次给药2 h 后再次记录各组大鼠的EEG/EMG 信号,连续记录72 h。记录完成后,利用BL-420S 生物机能实验系统对大鼠EEG/EMG 信号进行分析,根据波形特征将其分为醒觉(wake,W)期、非快眼动睡眠(non-rapid eye movement sleep,NREMS)期、快眼动睡眠(rapid eye movement sleep,REMS)期及总睡眠(total sleep,TS):W期EEG以不规则的α波(8~12 Hz)及β波(14~35 Hz)信号为主,EMG 高度活动;NREMS 期EEG 以高幅低频δ 波(0.5~4 Hz)信号为主,EMG 表现为静止或有轻度活动;REMS 期EEG 以低幅高频θ 波(4~8 Hz)信号为主,EMG表现为完全静止[21](图2);TS=NREMS+REMS。同时,对EEG/EMG 信号图谱波形成分进行分析,将其分为δ 波、α 波、β 波及θ 波。将各睡眠-觉醒时相及波形按照所占总记录时间百分比进行统计。

Figure 2. Waveform characteristics of EEG/EMG signals of the rats in wake(W),non-rapid eye movement sleep(NREMS)and rapid eye movement sleep(REMS)phases.图2 睡眠-觉醒周期各时相EEG/EMG信号的波形特征
3 统计学处理
实验数据采用SSPS 22.0软件进行处理,多组间比较采用单因素方差分析,进一步组间比较采用SNK-q检验,统计结果以均数±标准差(mean±SD)形式表示,以P<0.05为差异有统计学意义。
结果
1 中缝核内注射不同药物对大鼠睡眠-觉醒时间的影响
1.1 中缝核内注射NG2-Ab 对大鼠睡眠-觉醒时间的影响 与自身给药前1 d 相比,NG2-Ab 组大鼠的W 时间在中缝核内注射NG2-Ab后第1天及第2天均显著延长(P<0.05),NREMS 时间在注射药物后的第1 天及第2 天均显著缩短(P<0.05),REMS 时间在注射药物后的第1天及第2天均显著缩短(P<0.05),TS时间在注射药物后的第1天及第2天均显著缩短(P<0.05),见表1。这一结果提示中缝核NG2 细胞参与了大鼠睡眠-觉醒时间的调节。

表1 中缝核内微量注射NG2-Ab对大鼠睡眠-觉醒时间的影响Table 1. Effects of NG2-Ab solution microinjected into the raphe nuclei on sleep-wake duration of the rats(%. Mean±SD.n=10)
1.2 中缝核内注射PCPA 对大鼠睡眠-觉醒时间的影响 与自身给药前1 d 相比,PCPA 组大鼠的W 时间在中缝核内注射PCPA后第1天及第2天均显著延长(P<0.05),NREMS 时间在注射药物后的第1 天及第2天均显著缩短(P<0.05),REMS时间在注射药物后的第1 天及第2 天均显著缩短(P<0.05),TS 时间在注射药物后的第1 天及第2 天均显著缩短(P<0.05),见表2。这一结果提示中缝核5-HT 含量的下降对大鼠觉醒具有促进作用,对睡眠具有抑制作用。

表2 中缝核内微量注射PCPA对大鼠睡眠-觉醒时间的影响Table 2. Effects of PCPA solution microinjected into the raphe nuclei on the sleep-wake duration of the rats(%. Mean±SD.n=10)
1.3 中缝核内注射5-HT对大鼠睡眠-觉醒时间的影响 与自身给药前1 d 相比,5-HT 组大鼠的W 时间在中缝核内注射5-HT后第1天、第2天及第3天均显著缩短(P<0.05),NREMS 时间在注射药物后的第1天、第2 天及第3 天均显著延长(P<0.05),REMS 时间在注射药物后的第1 天显著延长(P<0.05),TS 时间在注射药物后的第1 天、第2 天及第3 天均显著延长(P<0.05),见表3。这一结果提示中缝核5-HT 含量的升高对大鼠觉醒具有抑制作用,对睡眠具有促进作用。

表3 中缝核内微量注射5-HT对大鼠睡眠-觉醒时间的影响Table 3. Effects of 5-HT solution microinjected into the raphe nuclei on the sleep-wake duration of the rats(%. Mean±SD.n=10)
2 中缝核NG2 细胞对5-HT 含量变化引起的睡眠-觉醒时间改变的影响
为了探究中缝核NG2 细胞是否参与了5-HT 含量变化引起睡眠-觉醒时间的改变,我们向大鼠中缝核内分别注射了NG2-Ab+5-HT及NG2-Ab+PCPA。
2.1 中缝核内注射NG2-Ab+PCPA 对大鼠睡眠-觉醒时间的影响 与PCPA 组相比,NG2-Ab+PCPA 组大鼠的W 时间在中缝核内注射NG2-Ab+PCPA 后第1 天显著缩短(P<0.05),见表4;NREMS 时间在注射药物后的第1天显著延长(P<0.05),见表5;REMS时间在注射药物后的第1 天显著延长(P<0.05),见表6;TS 时间在注射药物后的第1 天显著延长(P<0.05),见表7。这一结果提示中缝核NG2 细胞参与了5-HT含量下降引起的大鼠睡眠-觉醒时间的改变。
2.2 中缝核内注射NG2-Ab+5-HT 对大鼠睡眠-觉醒时间的影响 与5-HT 组相比,NG2-Ab+5-HT 组大鼠的W 时间在中缝核内注射NG2-Ab+5-HT 后第1 天、第2 天及第3 天均显著延长(P<0.05),见表4;NREMS 时间在注射药物后的第1 天及第2 天均显著缩短(P<0.05),见表5;REMS 时间在注射药物后的第1 天、第2 天及第3 天均显著缩短(P<0.05),见表6);TS 时间在注射药物后的第1 天、第2 天及第3 天均显著缩短(P<0.05),见表7。这一结果提示中缝核NG2 细胞参与了5-HT 含量升高引起的大鼠睡眠-觉醒时间的改变。

表4 中缝核内微量注射不同药物对大鼠觉醒时间的影响Table 4. Effects of different drugs microinjected into the raphe nuclei on the wake duration of the rats(%. Mean±SD.n=10)

表5 中缝核内微量注射不同药物对大鼠非快眼动睡眠时间的影响Table 5. Effects of different drugs microinjected into the raphe nuclei on the non-rapid eye movement sleep duration of the rats(%.Mean±SD.n=10)

表6 中缝核内微量注射不同药物对大鼠快眼动睡眠时间的影响Table 6. Effects of different drugs microinjected into the raphe nuclei on the rapid eye movement sleep duration of the rats(%. Mean±SD.n=10)
表7 中缝核内微量注射不同药物对大鼠总睡眠时间的影响Table 7. Effects of different drugs microinjected into the raphe nuclei on the total sleep duration of the rats(%. Mean±SD.n=10)
3 中缝核内分别注射不同药物对大鼠EEG 波形特征的影响
3.1 中缝核内注射NG2-Ab对大鼠EEG波形特征的影响 与空白对照组相比,NG2-Ab组大鼠的EEG 波形特征在中缝核内注射NG2-Ab后无显著变化,见表8~11。

表8 中缝核内微量注射不同药物对大鼠β波百分比的影响Table 8. Effects of different drugs microinjected into the raphe nuclei on the percentage of β wave in the rats(%. Mean±SD.n=10)

表9 中缝核内微量注射不同药物对大鼠δ波百分比的影响Table 9. Effects of different drugs microinjected into the raphe nuclei on the percentage of δ wave in the rats(%. Mean±SD.n=10)

表10 中缝核内微量注射不同药物对大鼠α波百分比的影响Table 10. Effects of different drugs microinjected into the raphe nuclei on the percentage of α wave in the rats(%. Mean±SD.n=10)

表11 中缝核内微量注射不同药物对大鼠θ波百分比的影响Table 11. Effects of different drugs microinjected into the raphe nuclei on the percentage of θ wave in the rats(%. Mean±SD.n=10)
3.2 中缝核内注射PCPA 对大鼠EEG 波形特征的影响 与空白对照组相比,PCPA 组大鼠的β 波百分比在中缝核内注射PCPA后第1天及第2天均显著减少(P<0.05),见表8;δ波百分比在注射药物后第1天及第2 天均显著增加(P<0.05),见表9;α 波百分比在注射药物后第2天显著减少(P<0.05),见表10。
3.3 中缝核内注射5-HT 对大鼠EEG 波形特征的影响 与空白对照组相比,5-HT 组大鼠的EEG 波形特征在中缝核内注射5-HT后无显著变化,见表8~11。
3.4 中缝核内注射NG2-Ab+PCPA 对大鼠EEG 波形特征的影响 与PCPA 组大鼠相比,NG2-Ab+PCPA组大鼠δ 波百分比在中缝核内注射NG2-Ab+PCPA后第2天显著降低(P<0.05),见表9。这一结果提示中缝核NG2 细胞参与了5-HT 含量下降引起的大鼠EEG波形变化。
3.5 中缝核内注射NG2-Ab+5-HT 对大鼠EEG 波形特征的影响 与5-HT 组大鼠相比,NG2-Ab+5-HT 组大鼠β波百分比在中缝核内注射NG2-Ab+5-HT后第3 天显著增加(P<0.05),见表8。这一结果提示中缝核NG2 细胞参与了5-HT 含量上升引起的大鼠EEG波形变化。
讨论
本实验通过向大鼠的中缝核内分别微量注射NG2-Ab、PCPA、5-HT、NG2-Ab+PCPA 和NG2-Ab+5-HT,并记录给药后大鼠的EEG/EMG 信号,研究了中缝核内NG2 细胞、5-HT 以及NG2 细胞和5-HT 的共同作用对大鼠睡眠-觉醒时间及EEG波形的影响。
NG2 细胞是存在于发育和成熟哺乳动物中CNS的灰质和白质中的一种常驻祖细胞群,与星形胶质细胞、成熟少突胶质细胞、小胶质细胞和神经干细胞有所区别[22]。NG2 细胞被认为是CNS 第4 种主要胶质细胞类型,占成年CNS 所有细胞的2%~8%[23-24]。由于NG2 细胞能够生成髓鞘或非髓鞘的少突细胞,因此NG2 被认为等同于OPCs[25]。研究表明,对富含OPCs 的小鼠前脑样本进行基因表达分析显示,许多OPCs 特定基因在睡眠和觉醒期间改变自身表达[14]。进一步对OPCs 基因进行功能聚类分析发现,促进OPCs 增殖的基因主要在睡眠期间表达上调,而主要参与OPCs 分化和凋亡的基因在清醒过程中得到较好的转录[15]。以上研究报道表明,NG2 细胞可能参与了睡眠-觉醒周期的调节过程。为了探究中缝核内NG2 细胞对睡眠-觉醒时间的作用,我们向大鼠的中缝核内微量注射NG2-Ab,观察在中缝核NG2 细胞活性受到抑制后,大鼠的睡眠-觉醒时间变化。实验结果表明,给药后大鼠的W 时间延长,同时TS 时间缩短,提示中缝核NG2 细胞具有调节睡眠-觉醒时间的作用,并且其作用可能是促进睡眠。对给药后大鼠的睡眠结构进行分析可以发现,大鼠的NREMS 时间及REMS 时间均显著缩短,说明中缝核NG2 细胞对睡眠中的NREMS 及REMS 均有调节作用。该结果与相关研究报道相符[15,26]。
5-HT 是参与睡眠-觉醒周期调节的重要神经递质,其在睡眠及觉醒的启动和维持中均起到重要作用。5-HT 能神经元主要分布在脑干的中缝核,其上行纤维与蓝斑去甲肾上腺素能神经元组成网状结构上行激活系统的一部分,在W 期放电增加,并通过GABA 抑制睡眠中枢——下丘脑腹外侧视前区的活动,维持和改变大脑皮层的兴奋状态以促进觉醒[26]。在清醒状态下,5-HT 能神经元轴突末梢释放的5-HT能够影响脑内特定区域中促睡眠物质的合成,而在睡眠状态下当5-HT 在催眠物质的触发下被树突释放后,其通过自身抑制过程参与了5-HT 核周体的抑制以维持睡眠[4]。在本实验中,我们通过向大鼠中缝核内微量注射5-HT 及其合成酶抑制剂PCPA,探究中缝核内的5-HT 对大鼠睡眠-觉醒时间的影响。研究结果表明,向大鼠中缝核内注射5-HT 后,大鼠的W 时间缩短,同时TS 时间延长;相反地,PCPA 能够使大鼠的W 时间延长,TS 时间缩短。提示中缝核内的5-HT 具有促进睡眠的作用。对给药前及给药后的大鼠睡眠结构分析发现,5-HT 能够延长大鼠NREMS 和REMS 时间,PCPA 则具有抑制作用,说明中缝核内的5-HT 对NREMS 和REMS 均具有调节作用。该实验结果与国外以往研究结果相符[27-28]。
NG2 细胞与5-HT 在睡眠-觉醒周期的调节中都起到了重要作用,为了探究中缝核NG2 细胞与5-HT在睡眠-觉醒调节中是否存在相互作用,本实验向大鼠的中缝核内分别注射了NG2-Ab+5-HT 和NG2-Ab+PCPA,在抑制中缝核NG2 细胞活性的同时增加或减少5-HT 的含量。实验结果表明,与仅增加或减少中缝核5-HT 含量相比,抑制NG2 细胞活性同时增加或减少中缝核5-HT 含量对大鼠睡眠的促进或抑制作用减弱。前期研究发现,PCPA 可引起大鼠脑干内NG2 细胞的mRNA 表达升高[29];微透析法对给药后大鼠中缝核内促睡眠因子进行含量分析发现,NG2 细胞调节谷氨酸含量的作用与5-HT 的合成有关(该研究论文已被接收,待发表),表明5-HT 浓度变化和NG2 功能活动具有相关性。结合以上结果,提示中缝核NG2 细胞与5-HT 对大鼠睡眠-觉醒功能具有共同调节作用,中缝核NG2 细胞参与了5-HT 含量的变化导致的大鼠EEG/EMG 信号及睡眠-觉醒时间的改变,提示NG2 细胞可能是5-HT 调节睡眠-觉醒功能的机制之一。
EEG 波形按照波形特征可分为δ波、θ波、α波及β 波[30-31]。正常成年人在清醒时一般不会出现δ 波,当缺氧、大脑发生病变、昏迷或深度睡眠时会出现δ波[32]。当在疲倦、心情压抑或中枢神经收到抑制时,脑电图中会出现θ 波。α 波是正常人脑电图中的最基本波形,在没有外界刺激的条件下,α 波呈现十分稳定的频率。α 波在人处于闭目养神的状态下最为明显,当人被外来条件刺激或者睁眼时,α 波立即消失。β 波主要是人清醒状态时脑电活动的表现。本研究对各组大鼠的EEG波形特征进行分析比较后发现,中缝核NG2细胞活性受到抑制后,大鼠EEG波形特征无明显变化;与仅降低5-HT 含量相比,5-HT 含量降低及NG2 细胞活性被抑制后,大鼠的δ 波百分比减少;与仅升高5-HT 含量相比,5-HT 含量升高及NG2 细胞活性被抑制后,大鼠的β 波百分比增加。提示中缝核NG2 细胞与5-HT 共同作用可以影响大鼠EEG波形特征。
失眠症严重影响人类的健康和生活质量,已经成为一项亟需解决的公共卫生问题。本研究结果表明中缝核NG2 细胞及NG2 细胞与5-HT 的共同作用能够调节大鼠的睡眠-觉醒时间及脑电活动,该研究为失眠机制的研究及失眠治疗药物的研发提供了实验依据。

