构建“装置-原理”二维模型 厘清电化学反应原理
安徽 董 顺
《普通高中化学课程标准(2017年版2020年修订)》指出,证据推理与模型认知是化学学科重要的核心素养之一。解决问题的思维模型对学生化学学科核心素养的落实有着重要的作用,在高三复习过程中帮助学生建立解决问题的“模型”能够很好地提高学生复习备考的效率。
在近年高考化学试题中电化学内容是高频考点,详细考查情况如表1所示,有的试题以选择题形式呈现,有的试题以非选择题形式呈现,该类试题对考生的思维能力要求较高,有一定的难度和较高的区分度。
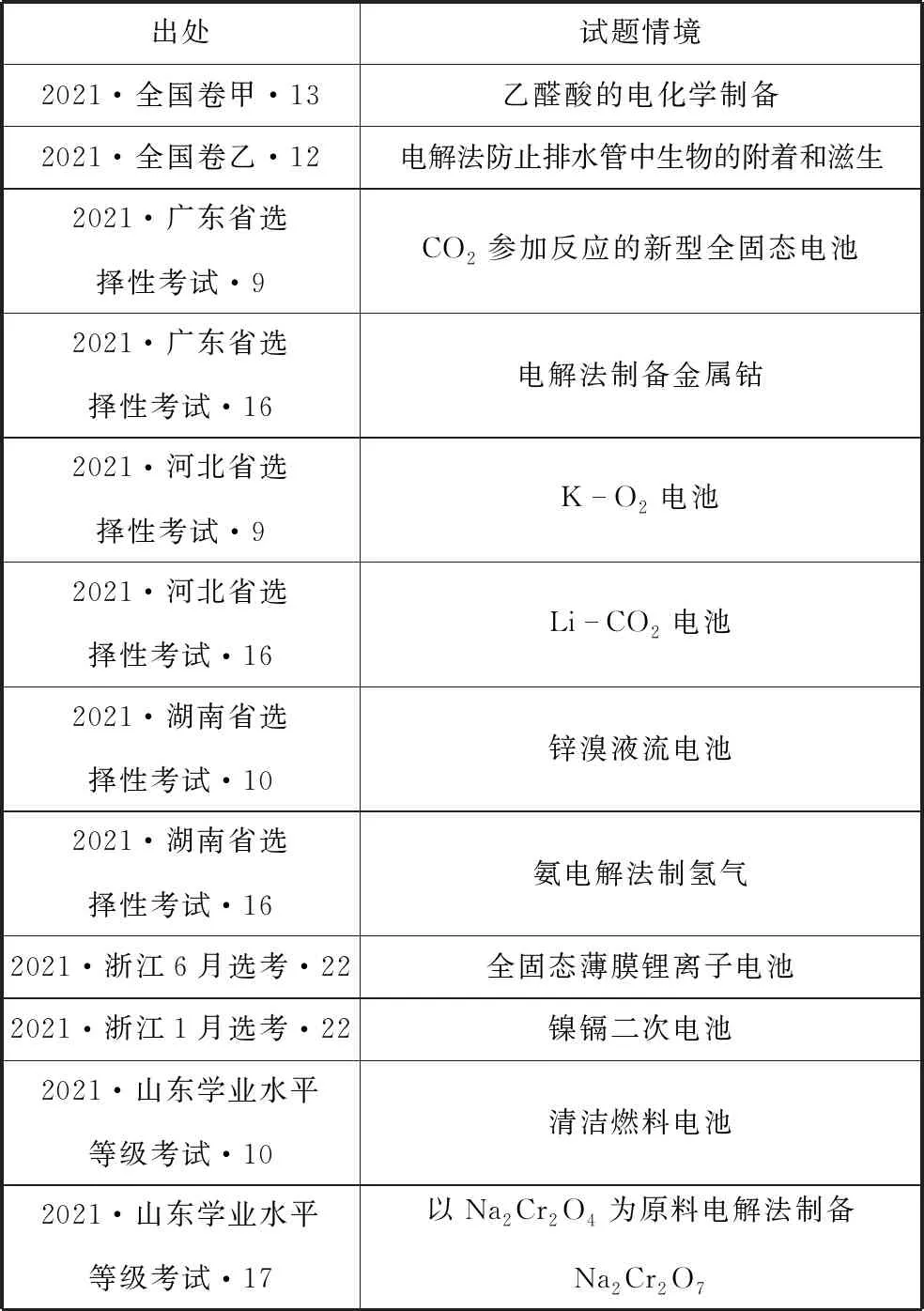
表1 2021年电化学在高考中的考查统计
1.构建原电池及电解池“装置原理”二维模型
原电池及电解池的构成都包括电极材料、电极反应物、电子导体和离子导体,根据电化学原理,构建“装置-原理”二维模型如图1。
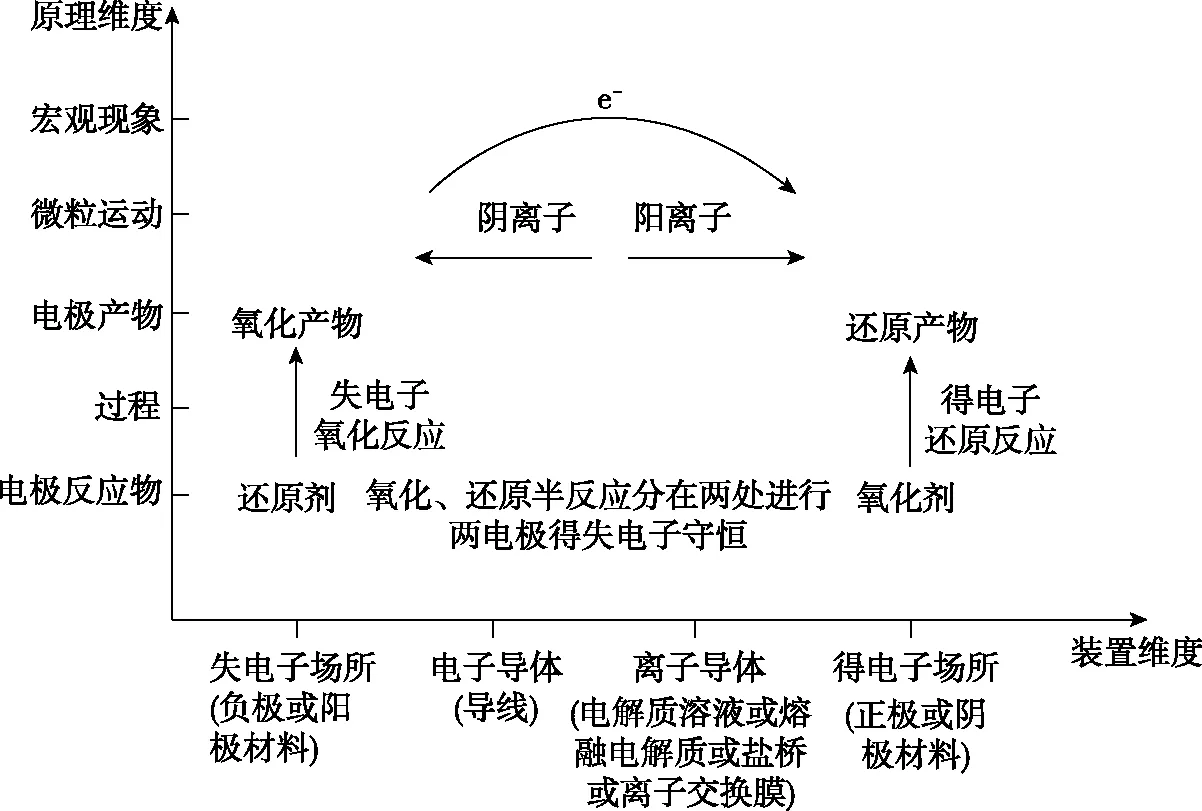
图1 电化学“装置-原理”二维模型图
在原电池中电子由负极经导线流向正极,在电解池中电子由电源负极经导线流向电解池阴极,由电解池阳极流向电源正极。在离子导体中,阳离子移向阴极(原电池正极也可称为阴极),阴离子移向阳极(原电池负极也可称为阳极),从而形成闭合回路。还原剂在阳极发生氧化反应,氧化剂在阴极发生还原反应。原电池将自发进行的氧化还原反应过程中的化学能转化为电能,电解池将电能转化为化学能。
在原电池及电解池中,各个电极转移的电子数目与电路中通过的电子数目相等,并遵循以下等量关系:
电量Q=It,t为时间,单位为秒;电解时Q=nF,n为转移电子的物质的量,法拉第常数F=96 485 C·mol-1(即为1 mol电子的电量为96 485 C)。
根据电化学基本原理解答电化学类试题,首先判断是原电池还是电解池,若为原电池则根据各电极物质元素化合价的变化判断正负极;若为电解池,则应先判断其阴阳极。若能判断外电源正负极,则容易判断阴阳极,若无法判断外电源正负极,则根据各电极物质元素化合价的变化判断阴阳极。电极反应方程式的书写首先需要判断反应物和产物,再根据元素化合价的变化结合介质环境书写。
2.典例分析
2.1 原电池原理的考查
【例1】(2021·广东省选择性考试·9)火星大气中含有大量CO2,一种有CO2参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠为负极,碳纳米管为正极,放电时
( )
A.负极上发生还原反应
B.CO2在正极上得电子
C.阳离子由正极移向负极
D.将电能转化为化学能
【答案】B

【模型应用】根据“装置-原理”二维模型图知,负极发生氧化反应,正极发生得电子的还原反应,阳离子移向正极,容易判断B项正确。
【例2】(2021·山东学业水平等级考试·10)以KOH溶液为离子导体,分别组成 CH3OH-O2、N2H4-O2、(CH3)2NNH2-O2清洁燃料电池,下列说法正确的是
( )
A.放电过程中,K+均向负极移动
B.放电过程中,KOH物质的量均减小
C.消耗等质量燃料,(CH3)2NNH2-O2燃料电池的理论放电量最大
D.消耗1 mol O2时,理论上N2H4-O2燃料电池气体产物的体积在标准状况下为11.2 L
【答案】C

【模型应用】根据“装置-原理”二维模型图知,阳离子(K+)移向正极,又有得失电子守恒知C正确、D错误。
2.2 电解池原理的考查
【例3】(2021·全国甲卷·13)乙醛酸是一种重要的化工中间体,可采用如图2所示的电化学装置合成。图中的双极膜中间层中的H2O解离为H+和OH-,并在直流电场作用下分别向两极迁移。下列说法正确的是
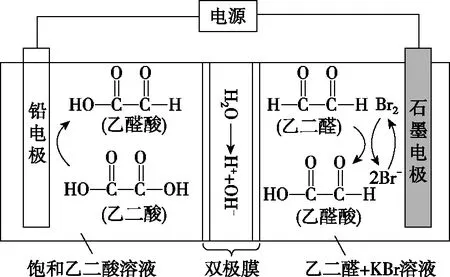
图2
( )
A.KBr在上述电化学合成过程中只起电解质的作用
C.制得2 mol乙醛酸,理论上外电路中迁移了1 mol电子
D.双极膜中间层中的H+在外电场作用下向铅电极方向迁移
【答案】D
【解析】该装置通电时,乙二酸被还原为乙醛酸,因此铅电极为电解池阴极,石墨电极为电解池阳极,阳极上Br-被氧化为Br2,Br2将乙二醛氧化为乙醛酸,双极膜中间层的H+在直流电场作用下移向阴极,OH-移向阳极。KBr在上述电化学合成过程中除作电解质外,同时还是电解过程中阳极的反应物,生成的Br2为乙二醛制备乙醛酸的中间产物,A错误;阳极上为Br-失去电子生成Br2,Br2将乙二醛氧化为乙醛酸,B错误;电解过程中阴阳极均生成乙醛酸,1 mol乙二酸生成1 mol乙醛酸转移电子为2 mol,1 mol乙二醛生成1 mol乙醛酸转移电子为2 mol,根据转移电子守恒可知每生成1 mol乙醛酸转移电子为2 mol,因此制得1 mol乙醛酸时,理论上外电路中迁移了2 mol电子,C错误;由上述分析可知,双极膜中间层的H+在外电场作用下移向阴极,即H+移向铅电极,D正确;答案为D。
【模型应用】根据“装置-原理”二维模型图知,阴极发生还原反应,则铅电极为阴极,阳离子(H+)移向阴极,D项正确。
【例4】(2021·全国乙卷·12)沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率。为解决这一问题,通常在管道口设置一对惰性电极(如图3所示),通入一定的电流。
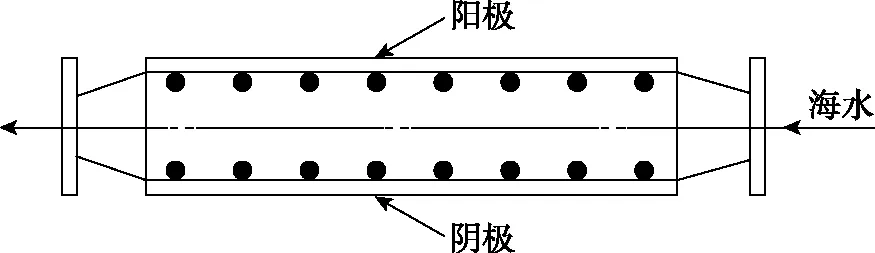
图3
下列叙述错误的是
( )
A.阳极发生将海水中的Cl-氧化生成Cl2的反应
B.管道中可以生成氧化灭杀附着生物的NaClO
C.阴极生成的H2应及时通风稀释安全地排入大气
D.阳极表面形成的Mg(OH)2等积垢需要定期清理
【答案】D

【模型应用】根据“装置-原理”二维模型图知,阴极发生还原反应,有OH-生成,从而在阴极表面形成Mg(OH)2,D项错误。
【例5】(2021·广东省选择性考试·16)钴(Co)的合金材料广泛应用于航空航天、机械制造等领域。如图4为水溶液中电解制备金属钴的装置示意图。下列说法正确的是
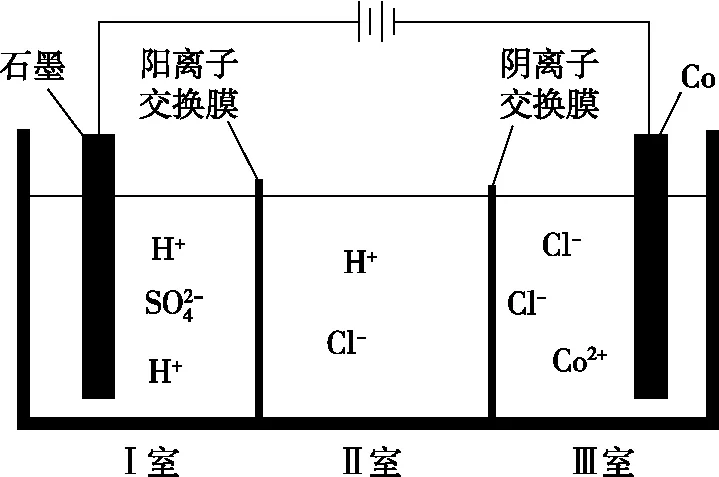
图4
( )
A.工作时,Ⅰ室和Ⅱ室溶液的pH均增大
B.生成1 mol Co,Ⅰ室溶液质量理论上减少16 g
C.移除两交换膜后,石墨电极上发生的反应不变
【答案】D

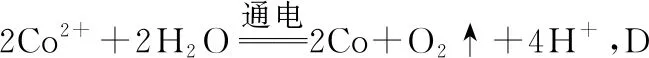
【例6】(2021·湖南省选择性考试·16节选)利用电解原理,将氨转化为高纯氢气,其装置如图5所示。

图5
(1)电解过程中OH-的移动方向为________(填“从左往右”或“从右往左”);
(2)阳极的电极反应式为_______________。

【解析】(1)由图可知,通NH3的一极氮元素化合价升高,发生氧化反应,为电解池的阳极,则另一电极为阴极,电解过程中OH-移向阳极,则从右往左移动,故答案为从右往左;

【模型应用】根据“装置-原理”二维模型图知,阳极发生氧化反应,阴离子移向阳极。
2.3 可逆电池的考查
【例7】(2021·湖南省选择性考试·10)锌/溴液流电池是一种先进的水溶液电解质电池,广泛应用于再生能源储能和智能电网的备用电源等。三单体串联锌/溴液流电池工作原理如图6所示:
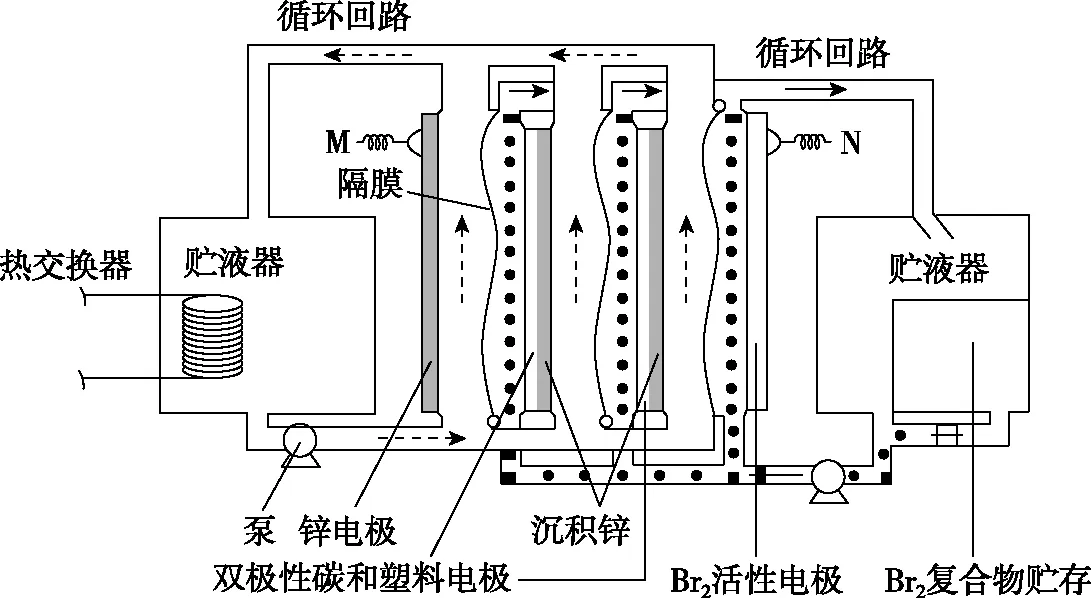
图6
下列说法错误的是
( )
A.放电时,N极为正极
B.放电时,左侧贮液器中ZnBr2的浓度不断减小

D.隔膜允许阳离子通过,也允许阴离子通过
【答案】B

3.电化学类试题的考查趋势预测


